Гонартроз – распространенное заболевание коленных суставов, дегенеративного характера, которое затрагивает все компоненты сустава, связанное с локальной потерей хрящевой ткани с течением времени. В настоящее время считается, что разрушение суставного хряща при остеоартрозе является результатом чрезмерной нагрузки, возрастных изменений и нарушения обмена веществ [4, 7]. При развитии гонартроза часто возникает варусная деформация, которая влечет за собой перераспределение биомеханической нагрузки на суставные поверхности с ее увеличением на хрящевую ткань в области медиального мыщелка большой берцовой кости. В результате в коленном суставе возникают зоны с разной степенью дегенерации хрящевой ткани. По степени биомеханической нагрузки, соответствующей степени дегенерации хряща, их условно можно назвать ненагружаемая (задний край внутреннего мыщелка бедра), малонагружаемая (латеральный мыщелок большой берцовой кости) и нагружаемая зоны – наиболее измененный хрящ (соответствует медиальному мыщелку большой берцовой кости) [5, 4].
Способности гиалинового хряща к регенерации весьма ограничены и поиск методов восстановления суставных поверхностей является актуальной и нерешенной задачей [1, 3]. В последнее десятилетие активно разрабатываются клеточные методы восстановления гиалинового хряща, в том числе, аутологичная трансплантация хондроцитов (ХЦ) [1]. В качестве источника ХЦ может быть использован суставной хрящ ненагружаемой зоны. В литературе представлен ряд применяемых клеточных продуктов на основе аутологичных ХЦ ненагружаемого суставного хряща, полученных методом артроскопии [1,8,9]. Для замещения хрящевого дефекта, нужно достаточное количество ХЦ, сохранивших свой хондрогенный фенотип, способных выжить в среде сустава, пораженного патологическим процессом. При этом для формирования гиалинового хряща в области дефекта хрящевой ткани трансплантированные клетки должны синтезировать необходимое количество ключевых компонентов внеклеточного матрикса, таких как коллаген II типа и агрекан [1], с тем, чтобы откладываемый ими внеклеточный матрикс обладал физико-химическими свойствами близкими нативному гиалиновому хрящу [3]. Показано, что ХЦ больных гонартрозом, выделенные из зон коленного сустава с разной степенью дегенерации хряща имеют неодинаковый фенотип. Это проявляется в снижении экспрессии генов коллагена II типа, версикана и KLF4 хондроцитами, выделенными из наиболее разрушенной зоны коленного сустава у больных гонартрозом – медиального мыщелка большой берцовой кости [4]. Также установлено, что в разных топографических зонах коленного сустава больных гонартрозом в зависимости от степени дегенерации хряща коллаген и протеогликаны существенно различаются по количеству, качеству, характеристикам связей с другими компонентами матрикса [6], что указывает на перестройку метаболизма хондроцитов под действием патологического процесса. Неясно, являются ли изменения метаболического фенотипа ХЦ необратимыми, а также не определено, каким образом влияет унификация условий функционирования в культуре на фенотипические черты клеток, полученных из разных зон коленного сустава, различающихся по степени дегенерации хряща.
Цель исследования: сравнительный анализ синтеза основных компонентов матрикса хряща – агрекана и коллагена II типа хондроцитами in vitro, выделенных из зон коленного сустава, различающихся по степени дегенерации хрящевой ткани.
Материал и методы исследования
Исследовали хрящевую ткань разных топографических зон коленного сустава больных посттравматическим гонартрозом III степени с варусной деформацией (5 пациентов в возрасте от 60 до 75 лет) после резекции сустава в ходе операции эндопротезирования. В группу исследования входили 2 мужчин и 3 женщины. У всех пациентов не было выявлено инфекционных, онкологических и психических заболеваний, врожденных и наследственных патологий, а так же сахарного диабета, остеопороза и других заболеваний провоспалительного характера. Все пациенты подписали добровольное информированное согласие на использование их биоматериала для научных исследований.
Измельченную и промытую 0,9% NaCl ткань лизировали 0,2% раствором коллагеназы II типа («Gibco», США) в течение 18 часов при 37°С. Выделенные клетки отмывали PBS и ресуспензировали в DMEM/F12 («Биолот», Россия), содержащей 15% FBS («Gibco», США) 42.19 ед./мл пенициллина, 0.042 мг/мл стрептомицина («Биолот», Россия), 0.053 мг/л амфотерицина В («Biowest», Франция) в конечных концентрациях. Клетки культивировали в 12-луночных планшетах («TPP», Швейцария) при 37°С, в атмосфере 5% СО2, в концентрации 23 000 клеток на 1 см².
Оценку синтеза коллагена II типа и агрекана ХЦ разных топографических зон производили методом иммуноцитохимии. Планшеты с клетками выводили из эксперимента на 7-е сутки культивирования. Клетки промывали PBS и фиксировали раствором 4% формалина в фосфатном буфере, через 10 мин. проводили пермеблилизацию мембран 4% раствором Triton X-100 (v/v) в 4% формалине (v/v). Затем препараты инкубировали в 1% растворе BSA (w/v) (Sigma, США) в течение 30 мин., после чего в течение 19 ч инкубировали с первичными поликлональными мышиными антителами к агрекану («Abcam», США) и кроличьими антителами к коллагену II типа («Abcam», США) [2]. Через 20 ч препараты промывали PBS и окрашивали вторичными мышинными антителами, конъюгированными с Alexa Fluor 488 (Invitogene, США) и кроличьими антителами – с Alexa Fluor 568 (Invitogene, США). ДНК маркировали DAPI. Наблюдение, съемку препаратов и оценку интенсивности свечения производили с помощью микроскопа Axio Observer Z1 («Zeiss», Германия) и программы ZEN Pro («Zeiss», Германия) при увеличении до 100 раз (10х) и с использованием фильтров DAPI, Alexa Fluor 488 и Alexa Fluor 568. Наблюдение каждого препарата проводили в 5-ти полях зрения.
Результаты и обсуждение
При визуальной оценке выявлено, что распределение (Рис. 1а) и интенсивность (Рис. 1 г) флуоресценции клеточных ядер в поле зрения (канал DAPI, голубой график) неравномерны (Рис. 1а). Ядра ХЦ преимущественно образуют скопления, часть из которых настолько плотны, что отдельные ядра трудно дифференцировать. Участки высокой интенсивность свечения в канале DAPI совпадает с участками высокой интенсивности свечения агрекана в канале Alexa Fluor 488 (Рис. 1 б, г). Полученные данные указывают на то, что на 7-е сутки культивирования ХЦ формируют довольно крупные агрегаты, содержащие агрекан.
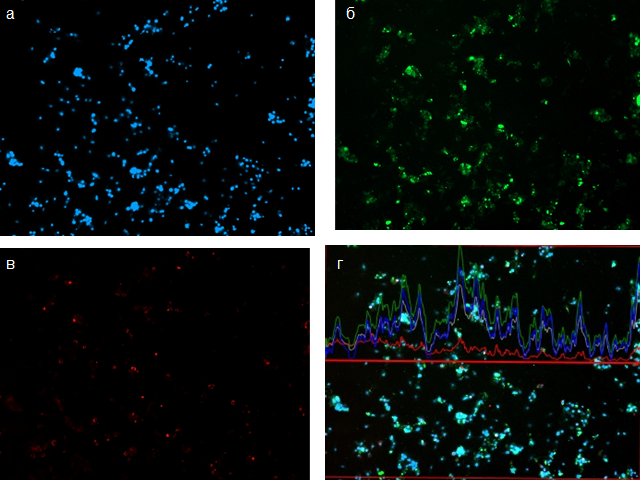
Рис. 1. Синтез аггрекана и коллагена 2 типа хондроцитами ненагружаемой зоны
А – ядра хондроцитов, окрашенные флуоресцентным красителем DAPI
Б – аггрекан, синтезируемый хондроцитами, окрашеныый Alexa Fluor 488;
В – коллаген 2 типа, синтезируемый хондроцитами окрашеныый Alexa Fluor 568;
Г – График неравномерности интенсивности флуоресценции в трех каналах: DAPI, Alexa Fluor 488 и Alexa Fluor 568
Флуоресценция коллагена II типа (красный график) менее интенсивна, по сравнению с флуоресценцией агрекана (зеленый график) (Рис. 1 г), участки отложения коллагена II типа не всегда совпадают с агрегатами клеток. В агрегатах клеток коллаген II типа располагается компактно, на поверхности клеточного агрегата. Данный белок хорошо визуализируется и рядом с клетками, ядра которых лежат одиночно (Рис. 1 в), при этом коллаген располагается под клеткой и/или вокруг клетки, но не на ее поверхности. Вокруг значительного большего количества клеток отложения коллагена II типа не визуализируются (Рис. 1 в). Возможно, ХЦ не успели синтезировать необходимое для визуализации количество коллагена. С другой стороны, гиалиновый хрящ ненагружаемой зоны коленного сустава имеет относительно слабую коллагеновую сеть при большом содержании протеогликанов по сравнению с двумя другими исследуемыми зонами [6], поэтому не исключено, что у ХЦ из ненагружаемой зоны способность к сниженному синтезу коллагена II типа и более высокому синтезу агрекана детерминирована особенностями хрящевой ткани, из которой они были выделены.
Известно, что коллаген II типа и агрекан секретируют ХЦ преимущественно зоны изогенных групп клеток суставного хряща [3]. Возможно, отсутствие отложений коллагена II типа около части ХЦ из ненагружаемой зоны связано с присутствием в этой культуре клеток всех глубинных зон хряща: клеток поверхностной зоны, зоны колонковых структур и зоны гипертрофических клеток, которые отличаются по размерам, функциям и спектру экспрессируемых маркеров.
Клеточный покров в культуре ХЦ из малонагружаемой зоны (хрящ с латерального мыщелка большой берцовой кости) к 7-м суткам более редкий, по сравнению с культурой ХЦ из ненагружаемой зоны, в поле зрения наблюдаются участки, где интенсивность свечения близка к нулю (Рис. 2 а, г). Это свидетельствует о сниженной жизнеспособности и/или пролиферации клеток данной зоны в культуре [6]. Как и в случае ХЦ из ненагружаемой зоны, в культуре ХЦ из малонагружаемой зоны отмечается неравномерность распределения и интенсивности флуоресценции клеточных ядер, клетки собраны в агрегаты (Рис. 2 а), но менее плотные, чем в культуре клеток ненагружаемой зоны (Рис. 1).
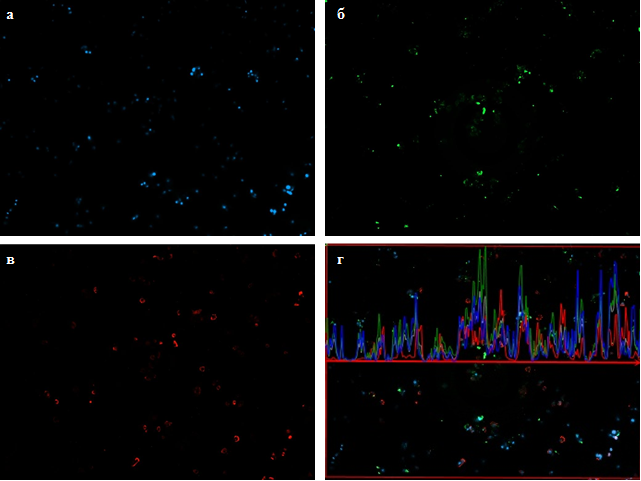
Рис. 2. Синтез аггрекана и коллагена 2 типа хондроцитами малонагружаемой зоны
А – ядра хондроцитов, окрашенные флуоресцентным красителем DAPI
Б – агрекан, синтезируемый хондроцитами, окрашеныый Alexa Fluor 488;
В – коллаген 2 типа, синтезируемый хондроцитами окрашеныый Alexa Fluor 568;
Г – график интенсивности флуоресценции в трех каналах (DAPI, Alexa Fluor 488 и Alexa Fluor 568.)
Отношение интенсивности свечения в канале Alexa Fluor 488 к интенсивности свечения в канале DAPI в культуре ХЦ из малонагружаемой зоны ниже, по сравнению с клетками из ненагружаемой зоны, что свидетельствует о сниженном количестве синтезируемого агрекана в пересчете на клетку (Рис. 2 г). В культуре клеток из этой топографической зоны агрекан визуализируется слабо в виде мелких агрегатов и точечных отложений (Рис. 2 б). Расположение агрегатов агрекана не всегда соответствует расположению клеточных ядер хондроцитов. Такой феномен можно объяснить несколькими причинами: возможно, что не все наблюдаемые клетки синтезируют агрекан в количестве, достаточном для визуализации, или клетки мигрируют с мест синтеза аггрекана. Кроме того возможна локализация коллагена над поверхностью клеток, что маскирует свечение агрекана. Очевидно, ХЦ малонагружаемой зоны на 1-й неделе культивирования не способны к формированию крупных агрегатов, содержащих агрекан.
Коллаген II типа локализуется как в клеточных конгломератах, так и вокруг одиночно расположенных клеток, причем отложения коллагена в околоклеточной зоне обнаруживаются не у всех клеток. Коллаген II типа располагается преимущественно вокруг ядра в виде полукольца или подковы. В культуре присутствуют клетки, вокруг которых коллаген визуализируется точечно (Рис. 2 в). На графике интенсивности флуоресценции коллагена пики, отражающие характеристики расположения его в культуре, отличаются по высоте и ширине (Рис. 2 г) (красный график), что свидетельствует о разном количестве и площади отложений коллагена в культуре. В начале графика и на небольших участках поля зрения, интенсивность флуоресценции коллагена близка к нулю. Часто пики коллагена не совпадают с пиками агрекана, что, возможно, связано со специализацией синтеза молекул внеклеточного матрикса клетками в процессе культивирования, а также с низкой плотностью культуры клеток малонагружаемой зоны к данному сроку культивирования.
Культура ХЦ из нагружаемой зоны коленного сустава к 7-м суткам культивирования отличается пониженным количеством клеток по сравнению с культурами клеток, полученных из других зон. Судя по свечению в канале DAPI, клетки собраны в менее плотные конгломераты, по сравнению с ХЦ из ненагружаемой зоны, и в более плотные – по сравнению с малонагружаемой зоной (Рис. 3 а). Агрекан (Рис. 3 б) и коллаген II типа располагается вблизи групп клеточных ядер. На графике интенсивности флуоресценции (Рис. 3 г) видно, что кривые флюоресценции агрекана (зеленый), коллагена II типа (красный) и DAPI (голубой) коррелируют, пики интенсивности свечения практически совпадают по частоте, чего не наблюдалось в культуре ХЦ из других зон.
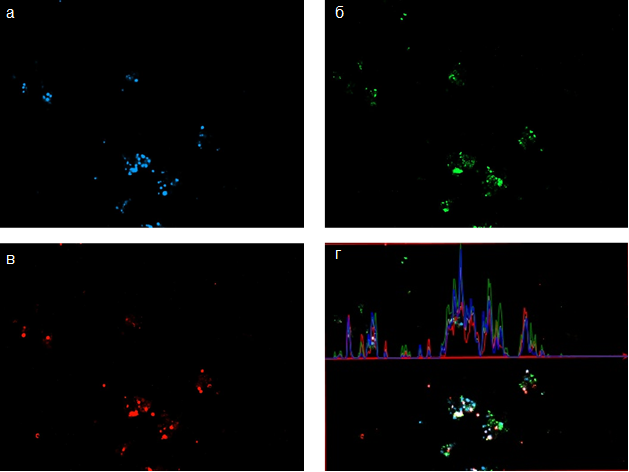
Рис. 3. Синтез аггрекана и коллагена 2 типа хондроцитами нагружаемой зоны
А – ядра хондроцитов, окрашенные флуоресцентным красителем DAPI
Б – аггрекан, синтезируемый хондроцитами, окрашенный Alexa Fluor 488;
В – коллаген 2 типа, синтезируемый хондроцитами окрашенный Alexa Fluor 568;
Г – График неравномерности интенсивности флуоресценции в трех каналах (DAPI, Alexa Fluor 488 и Alexa Fluor 568.)
Таким образом, судя по характеристикам культуры, ХЦ, полученные из нагружаемой зоны коленного сустава, менее различаются по фенотипу, чем ХЦ из других зон. Возможно, это связано с отсутствием и/или сокращением в культуре популяций ХЦ из поверхностной и средней зоны хряща, поскольку хрящ в области медиального мыщелка бедренной кости является наиболее поврежденным, без признаков деление на зоны. Не исключено, что это может быть следствием низкой пролиферативной и миграционной активности клеток.
Известно, что у ХЦ процессы биосинтеза коллагена и протеогликанов происходят в противофазе. Когда энергетический заряд клетки высок, внутри ХЦ преобладают UTP-гексозы – предшественники протеогликанов, в то время как при пониженном энергетическом заряде в ХЦ обнаруживается увеличение концентрации предшественников коллагена –пролина, глицина [10]. Снижение энергетического заряда клетки происходит и вследствие митоза [10]. Принимая эти факты во внимание, можно предположить, что ХЦ, полученные из разных зон коленного сустава, по каким-то причинам отличаются возможностью восстановления энергетического заряда клетки. Так, ХЦ из самой сохраненной зоны обладали наибольшей пролиферативной активностью и наибольшей способностью синтезировать агрекан, что свидетельствует об успешном восстановлении энергетического заряда ХЦ после цикла деления. В культурах клеток из более поврежденных зон коленного сустава при снижении отношения интенсивности флуоресценции агрекан/коллаген одновременно наблюдали пониженное количество клеток в культуре. В обеспечении клеток энергией основную роль играют два метаболических пути – дыхание и гликолиз. Определение вклада каждого пути в обеспечение культивируемых ХЦ энергией может способствовать выяснению механизмов, приводящих к различию фенотипов ХЦ из разных топографических зон коленного сустава больных гонартрозом, а также обеспечить наиболее благоприятные условия культивирования данных клеток с точки зрения пролиферации и синтеза компонентов внеклеточного матрикса.
Заключение
Исследованы синтетические особенности ХЦ, культивированных в течение 7-ми суток, полученных из зон коленного сустава, различающихся по степени дегенерации хряща у больных гонартрозом. Показано, что пролиферативная активность ХЦ в культуре падает в зависимости от выраженности дегенерации хрящевой ткани, из которой они были выделены, от ненагружаемой к нагружаемой зоне.
Показано, что агрекан и коллаген II типа синтезируются хондроцитами всех зон, но в разном количестве. Наибольший потенциал к синтезу агрекана на данном этапе культивирования имеют клетки ненагружаемой зоны. Высокая интенсивность флуоресценции и наличие агрегатов в культуре клеток свидетельствует о сохранении метаболической активности хондроцитами этой зоны по сравнению с другими. Сниженная способность к синтезу агрекана клетками малонагружаемой и нагружаемой зон может быть следствием изменений метаболизма клеток в процессе развития патологического процесса в суставном хряще.
При визуальной оценке синтеза коллагена II типа ХЦ из разных зон коленного сустава, различающихся по степени дегенерации хрящевой ткани, показано, что наиболее интенсивно данный белок синтезируют хондроциты нагружаемой и малонагружаемой зон.
Работа выполнена на средства гранта Президента Российской Федерации для государственной поддержки молодых российских ученых №МК-6370.2015.7
Библиографическая ссылка
Щелкунова Е.И., Воропаева А.А., Русова Т.В., Баитов В.С. СИНТЕЗ АГРЕКАНА И КОЛЛАГЕНА II ТИПА IN VITRO ХОНДРОЦИТАМИ ИЗ РАЗНЫХ ЗОН КОЛЕННОГО СУСТАВА БОЛЬНЫХ ГОНАРТРОЗОМ // Современные проблемы науки и образования. 2016. № 6. ;URL: https://science-education.ru/ru/article/view?id=25854 (дата обращения: 26.12.2025).



