За последнее время произошли существенные изменения в понимании механизмов развития злокачественных новообразований разных локализаций. Онкогенез, как и любой морфогенетический процесс, является результатом действия многих генов так называемой генной сети, в которой главная роль отводится онкогенам и генам-супрессорам. В то же время модифицирующее влияние на функционирование генов онкосупрессоров могут оказывать такие системы, как гены ферментов биотрансформации ксенобиотиков, ответственные за метаболизм и инактивацию широкого класса эндо- и экзобиотиков, в том числе канцерогенов [1,5,6].
Под биотрансформацией понимают ферментативное превращение жирорастворимых экзогенных или эндогенных соединений в полярные растворимые метаболиты, легко выводимые из организма. В процессе биотрансформации ксенобиотики, как правило, превращаются в менее активные метаболиты. Однако промежуточные продукты биотрансформации могут быть более токсичными, чем исходные соединения.
В классическом варианте система метаболизма ксенобиотиков включает процессы: активации (фаза I), детоксикации (фаза II) и элиминации ксенобиотиков. Первая фаза обеспечивается семейством ферментов цитохромов P450 (монооксигеназы), микросомальной эпоксидгидролазой, эстеразами, амилазами, алкогольдегидрогеназами и альдегиддегидрогеназами. Главная функция ферментов этой фазы – активация ксенобиотиков в электрофильные метаболиты. Детоксикация и нейтрализация гидрофобных и токсичных продуктов фазы активации – главная функция II фазы метаболизма ксенобиотиков. Функционирование всех ферментов фазы II сводится к метаболизму только тех веществ, которые уже имеют функциональные группы. В этом процессе принимают участие глутатион-S-трансферазы, глюкуронилтрансферазы, сульфотрансферазы, ацетилтрансферазы, метилтрансферазы и др. Большинство из этих ферментов локализованы в гиалоплазме, часть в мембранах эндоплазматического ретикулума и митохондрий.
Эффективность действия всей системы детоксикации обеспечивается слаженной работой ферментов каждой фазы. Десинхронизация их активности может наступить вследствие одновременного действия разных ксенобиотиков или в результате неблагоприятного сочетания в организме разных по своей активности изоформ ферментов детоксикации, в результате чего возникает повышенная чувствительность организма к различным ксенобиотикам, что может послужить причиной оксидативного стресса, токсичности или мутагенности.
Все ферменты системы детоксикации отличаются высоким полиморфизмом и существуют в большом количестве изоформ с различающейся и перекрывающейся субстратной специфичностью. Совместное функционирование первых двух фаз детоксикации обеспечивает обезвреживание десятков тысяч ксенобиотиков всех химических классов [5].
Гены ферментов биотрансформации высоко полиморфны, причем разные аллели этих генов могут кодировать белки, различающиеся по уровню ферментативной активности [1]. Это обусловливает неодинаковую способность к биотрансформации у разных людей, их метаболическую специфичность, что, в свою очередь, может быть основой индивидуальной предрасположенности к некоторым заболеваниям [2,3,4].
Наиболее широка и многообразна активность семейства генов глутатион-S-трансфераз (GST), продукты которых участвуют во второй фазе детоксикации, метаболизируют тысячи ксенобиотиков и ряд эндогенных веществ. О важности этих ферментов свидетельствует их чрезвычайно широкая распространенность [1,5,6].
Глутатион-S-трансферазы катализируют взаимодействие глутамата с различными алифатическими, ароматическими, эпоксидными и гетероциклическими радикалами широкого спектра соединений. Коферментом глутатион-S-трансфераз является глутатион – низкомолекулярный водорастворимый трипептид, который присутствует в высокой концентрации почти во всех клетках, а также вне клеток. Глутатионовая антиоксидантная система эффективно защищает клетки от оксидативного стресса.
Функциональная роль суперсемейства глутатион-S-трансфераз заключается в ферментативной конъюгации сульфгидрильной (SH2) группы с электрофильными молекулами самих ксенобиотиков или их метаболитов, образовавшимися в процессе фазы I.
Синтез глутатион-S-трансфераз контролируется генами, расположенными на различных хромосомах, для каждого из них описан ряд полиморфных вариантов, которые влияют на функциональную активность ферментов. Полиморфизм ферментов семейства глутатион-S-трансфераз определяет индивидуальную чувствительность организма к воздействию факторов внешней среды.
Целью настоящего исследования является изучить аллельные варианты гена детоксикации ксенобиотиков GSTP1 (глутатион-S-трансферазы) у больных раком молочной железы (РМЖ) и здоровых женщин в Кабардино-Балкарской Республике с целью определения групп риска с повышенной предрасположенностью к развитию наследственных и спорадических формы РМЖ.
Материалы и методы
Материалом для исследования служили образцы ДНК здоровых и больных раком молочной железы женщин Кабардино-Балкарии. Образцы венозной крови были собраны на базе ГБУЗ «Онкологический диспансер» МЗ КБР и ФГОУ ВПО «Кабардино-Балкарский Государственный университет им. Х.М. Бербекова», начиная с 2009 года. Данные представлены по материалам комплексного обследования и лечения 140 больных раком молочной железы в возрасте от 35 до 78 лет. Во всех случаях диагноз рака молочной железы был верифицирован морфологически. По настоящее время продолжается работа по пополнению банка ДНК из числа больных РМЖ и здоровых лиц. С информированного согласия о цели исследований производился забор крови. Методом анкетирования получены популяционно-генетические данные обследованных здоровых (контрольная группа n=140) и больных РМЖ пациенток.
Выделение ДНК из цельной крови осуществляли при помощи набора реагентов «QIAamp DNA Blood Mini Kit» (фирмы «Qiagen», Германия). При проведении полимеразной цепной реакции (ПЦР) был использован набор реагентов для проведения аллель-специфичной полимеразной реакции ООО НПФ «Литех».
Принцип метода заключается в том, что при полном совпадении последовательности специфических праймеров с комплементарной матрицей аллеля амплифицируется выбранная последовательность аллеля, а при несовпадении последнего нуклеотида на 3’-конце специфического праймера с комплементарной матрицей аллеля специфическая реакция не проходит. В этой же реакции используется пара неспецифических праймеров, которая является комплементарной к обоим аллелям и служит внутренним контролем наличия ингибирования реакции. Каждый неспецифический праймер создает с одним из специфических пару и амплифицирует специфический ПЦР продукт определенного размера.
Определение точечной замены основано на присутствии или отсутствии специфического ПЦР продукта при обязательном наличии неспецифического ПЦР продукта определенного размера внутреннего контроля, который регистрируется с помощью электрофореза в 3 % агарозном геле в УФ-свете при длине волны 312 нм.
Результаты и обсуждения
В результате ПЦР-генотипирования образцов ДНК больных РМЖ и лиц контрольной группы были определены частоты аллелей и генотипов полиморфного варианта Ile105Val гена GSTP1.
Согласно полученным результатам, частота аллеля Ile достигает 66 % у больных РМЖ и 68 % у здоровых лиц. Частота аллели Val в исследованной группе больных равна 34 %, тогда как в контрольной группе составила 32 % (рис. 1).
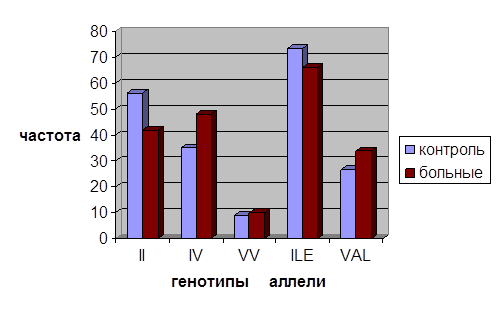
Рис. 1. Распределение частот аллелей и генотипов полиморфного варианта Ile105Val в гене GSTP1
Доля генотипа Ile/Ile является преобладающей в контрольной группе и составляет 56 % (79/140 чел.). В группе больных РМЖ генотип Ile/Ile обнаружен в 42 % случаев (59/140 чел.), что достоверно ниже показателей в группе здоровых лиц. Гомозиготы по аллелю Val были зарегистрированы у лиц с РМЖ (10 %), в контрольной группе (9 %). Гетерозиготный генотип выявлен в контрольной группе у 35 % (49/140 чел) обследованных. В группе больных генотип Ile/Val идентифицирован с частотой 48 % (67/140 чел.).
На электрофореграмме (рис.2) представлены выявленные в исследуемой выборке генотипы у больных РМЖ.
Анализ литературных данных показал, что GSTP1 Ile105Val полиморфизм достаточно широко распространен: он имеется почти у 50 % лиц европеоидной расы, причем 10–15 % составляют гомозиготы [2,3]. Полученные нами данные по обеим выборкам вписываются в частотные показатели по европейским популяциям.
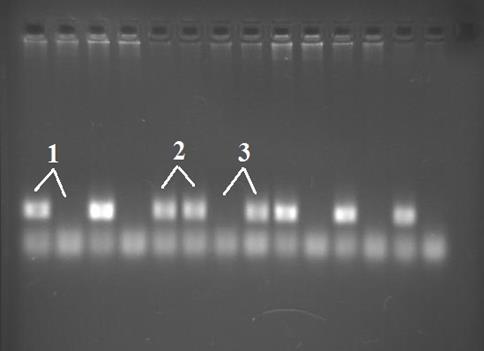
Рис. 2. Электрофореграмма анализа Ile105Val полиморфизма гена GSTP1 у больных раком молочной железы. 1 – генотип Ile/Ile, 2 – Ile/Val, 3 – Val/Val
Анализ Ala114Val полиморфизма гена GSTP1. Сравнительный анализ частот аллелей и генотипов исследуемого полиморфного варианта между больными раком молочной железы и группой контроля показал, что частота аллеля Ala достигает 89 % у больных РМЖ и 90 % у здоровых лиц. Частота аллели Val в исследованной группе больных равна 11 %, тогда как в контрольной группе составила 10 %.
Согласно полученным результатам, генотип Ala/Ala выявлен с частотой 80% (112/140 чел.) и 78 % (109/140 чел.) у здоровых лиц и больных РМЖ, соответственно. Гетерозиготный генотип идентифицирован в контрольной группе у 20 % обследованных (28/140 чел.). В группе больных РМЖ гетерозиготный генотип обнаружен в 22 % случаев (31/140 чел.). Гомозиготы по аллелю Val не были зарегистрированы ни в одной из выборок (рис. 3).
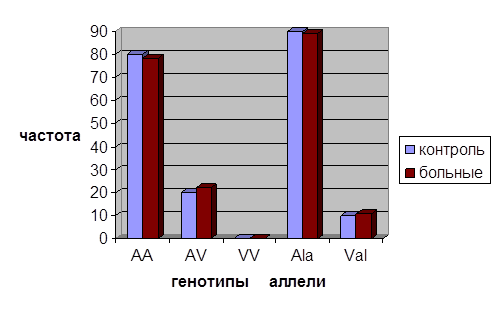
Рис. 3. Распределение частот аллелей и генотипов полиморфного варианта Ala114Val в гене GSTP1
На электрофореграмме (рис. 4) представлены два выявленных в исследуемой выборке генотипа у больных РМЖ.
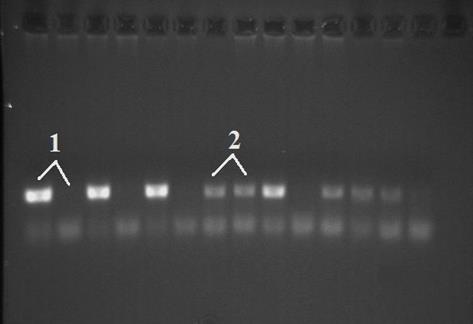
Рис. 4. Электрофореграмма анализа Ala114Val полиморфизма гена GSTP1 у больных раком молочной железы. 1 – генотип Ala/Ala, 2 – Ala/Val
Полученные нами данные по обеим выборкам также вписываются в частотные показатели по европейским популяциям [1,2,4].
Данные последних лет свидетельствует о важной роли ферментов детоксикации ксенобиотиков и репарации ДНК в развитии раковых заболеваний. Учитывая то, что повышенный риск развития рака связан с наличием определенных аллельных вариантов генов ферментов прооксидантов и антиоксидантов, можно предположить, что цитохромы P450 и глутатионзависимые ферменты, а также гены репарации ДНК могут быть важной составной частью генетической структуры подверженности развития злокачественных опухолей.
Генетический полиморфизм ферментов семейства глутатион-S-трансфераз вносит весомый вклад в развитие рака наряду с воздействиями окружающей среды. Присутствие хотя бы одного предполагаемого высокорискового генотипа увеличивает вероятность развития злокачественных новообразований.
Проведение исследований системы детоксикации ксенобиотиков является перспективным, так как это может помочь при выборе оптимальных режимов лечения онкопатологий с учетом индивидуальных генетических особенностей, позволит достичь максимального противоопухолевого эффекта и снизить риск осложнений в процессах, связанных с развитием различных раковых заболеваний.
Библиографическая ссылка
Даурова Л.В., Биттуева М.М., Боготова З.И., Джамбетова П.М., Паритов А.Ю., Гидова Э.М., Хандохов Т.Х., Ситников М.Н. ИЗМЕНЧИВОСТЬ В ГЕНE GSTP1 У БОЛЬНЫХ РАКОМ МОЛОЧНОЙ ЖЕЛЕЗЫ В КАБАРДИНО-БАЛКАРИИ. // Современные проблемы науки и образования. 2016. № 6. ;URL: https://science-education.ru/ru/article/view?id=25831 (дата обращения: 16.11.2025).



