Проблема лечения острой кишечной непроходимости остается одной из наиболее актуальных проблем в абдоминальной хирургии. Частота острой кишечной непроходимости (ОКН) не имеет тенденции к уменьшению, достигает 9,4–27,1 % в экстренной хирургии от всех хирургических заболеваний [2]. Уровень летальности от кишечной непроходимости составляет 18,9–19,8 %, а с развитием послеоперационных осложнений (13,2–79 %) [2,7]. Ишемия реперфузия тонкого кишечника – частые осложнения такой экстремальной патологии, как обтурационная и странгуляционная кишечная непроходимость [7, 8]. Мезентериальная ишемия-реперфузия является серьезным осложнением шока. Очень важным является исход ликвидации кишечной непроходимости и имеющие нарушения процессов микроциркуляции с развитием в последующем гипоксии и всасыванием патологических микробов через стенку кишки, что ведет к развитию синдрома системной воспалительной реакции. Синдром кишечной недостаточности (СКН) развивается при большинстве острых хирургических заболеваний и является важной составляющей патогенеза острой кишечной непроходимости и перитонита [5, 10, 11]. Прогрессирование патофизиологических процессов при СКН во многом определяется ишемией кишечной стенки и активацией свободнорадикальных процессов [4, 6]. Острая кишечная непроходимость сопровождается гипоксией с последующей реоксигенацией, что сопровождается существенными изменениями метаболизма клеток, развитием окислительного стресса, приводящего к нарушениям функции органов и тканей. Развитие окислительного дистресса происходит на фоне недостаточности ферментной и неферментной антиоксидантных систем [6]. При критических состояниях, таких как перитонит, синдром системной воспалительной реакции с органной недостаточностью, сепсис, повышенный уровень окислительного дистресса или пониженный антиоксидантный статус свидетельствуют о необходимости прогноза. Особенно у больных после ишемии – реперфузионного синдрома необходима количественная оценки окислительного дистресса, с одной стороны, определить изменения в накоплении продуктов окисления, а с другой, оценить изменения активности антиоксидантных ферментов. При повышенном образовании активных форм кислорода (АФК) происходит значительная активация свободнорадикальных процессов перекисного окисления липидов (ПОЛ) [4]. При количественной оценке ПОЛ наиболее часто используют такие продукты, как диеновые каньюгаты (ДК), а также один из его конечных продуктов – малоновый диальдегид (МДА). Очень важную роль в поддержании редокс-баланса в организме играет ферментативная антиоксидантная система эритроцитов, которая первой сталкивается с окислительным дистрессом. Основными компонентами этой системы являются супероксиддисмутаза (СОД), каталаза (КТ), глутатионпероксидаза (ГТП) и глутатионредуктаза (ГТР).
Цель. Изучение окислительного дистресса в динамике и его роль в развитии синдрома ишемии-реперфузии при острой кишечной непроходимости.
Материалы и методы. В данную работу были включены результаты клинического наблюдения и обследования 88 пациентов, оперированных в 2010–2015 гг. по поводу острой кишечной непроходимости в Республиканском центре экстренной медицинской помощи г. Махачкала и Республиканской межрайонной многопрофильной больнице. Мужчин было 40, женщин 48. Возраст пациентов от 18 до 80 лет. Средний возраст составил 49,41±3,86. Операции выполнялись при следующих видах патологии: странгуляционная кишечная непроходимость – 65, спаечная кишечная непроходимость – 15, обтурационная кишечная непроходимость – 8. У всех больных на момент поступления, а также на 1, 3, 5, 7 и 10-е сутки после операции были изучены лейкоцитарный индекс интоксикации по Каль – Калифу (ЛИИ). Содержание диеновых коньюгатов в плазме (ДКпл) оценивали по методу Гаврилова В.Б. с соавт. Концентрацию малоновогодиальдегида в плазме (МДАпл) определяли по методу М. Mihara (1990), в эритроцитах (МДАэр) оценивали методом L.Ernster. [9]. Содержание диеновых коньюгатов в эритроцитах (ДКэр) проводили с помощью метода
Placer Z.[11]. В эритроцитах определяли активность следующих ферментов: глутатионредуктазы (ГТР), используя метод Tilbotsen J. A. [12], глутатионпероксидазы (ГТП) с помощью метода Millis G.[13], каталазы (КТ) по методу N. Oshino [15], супероксиддисмутазы (СОД) с помощью метода M. Nishikimi [14].
Для оценки антиоксидантного статуса использовали антиоксидантный индекс (АОИ1) – который оценивали как среднее арифметическое отношений показателей ПОЛ (содержание ДК и МДА в плазме и эритроцитах) к среднему значению этих показателей у доноров, принятое за 1. АОИ1= (ДКпл/ДКплN + ДКэр/ДКэрN + МДАпл/МДАплN +МДАэр/МДАэрN)/4. Интегральный индекс ферментативной антиоксидантной защиты (антиоксидантный индекс – 2, АОИ2) вычисляли как среднее арифметическое отношение активностей антиоксидантных ферментов эритроцитов (СОД, КТ, ГПТ и ГТР), принятые за 1 у доноров: АОИ2= (ГТП/ГТПN + ГТР/ГТРN + СОД/СОДN + КТ/КТN)/4. Показатели c «N» в знаменателе – значения в группе доноров в количестве n = 18 в возрасте от 20 до 48 лет принятое за норму. Разность этих двух факторов (АОИ = АОИ2 – АОИ1) было предложено рассматривать как интегральный показатель, отражающий общий антиоксидантный статус [4]. Протокол исследования одобрен этическим комитетом ДГМА МЗ РФ. Исследование было выполнено в соответствии с национальным стандартом Российской Федерации (ГОСТ Р52379-2005 «Надлежащая клиническая практика»). До включения в исследование у всех пациентов и доноров было получено добровольное письменное информированное согласие. Полученные результаты обработали статистически с использованием программ «Statistica 6.0» и «Statsoft». В работе приведены значения средней (М), (±) m (ошибки средней) и объем выборки (n). При сравнении данных после проверки характера распределения использовали критерий x2 и t – критерий Стьюдента. Достоверными считали различия при p< 0,05.
Результаты и их обсуждение. Динамика частного антиоксидантного индекса (АОИ1) у пациентов в группе с развившимися реперфузионными осложнениями, и группа без реперфузионных осложнений представлена на (рис. 1). Достоверные различия (р < 0,05) между группами отмечались лишь первые 6–12 часов после развития реперфузионных осложнений, при этом в группе с реперфузионным синдромом обнаружены более высокие уровни продуктов ПОЛ. Исследование динамики индекса АОИ1 установили, что минимальные отклонения наблюдались в первые 6–12 часов, а максимальные – на 4–6 сутки, при этом на 3 и 5–7-е сутки выявили достоверные различия со значениями в группе контроля. На первые сутки в обеих группах наблюдали некоторое снижение уровня метаболитов цепи перекисного окисления липидов. Динамика индекса ферментативной антиоксидантной защиты (АОИ2) в группах острой кишечной непроходимости с развившимися реперфузионным осложнением и без реперфузионных осложнений представлены на (рис. 2).
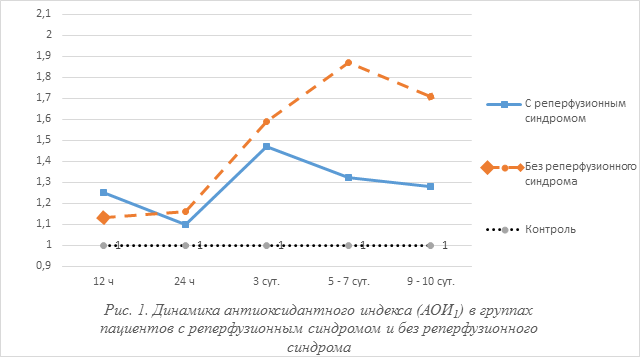
На оси ординат указаны относительные единицы АОИ1. По оси абсцисс время после операции. Достоверно при сравнении между группами (р < 0,05); достоверно по сравнению с группой контроля (р < 0,05).
Как следует из данных, если в группе реперфузионных осложнений в первые 3 – 6 часов отмечалось незначительное повышение уровня АОИ2, по сравнению со значениями в контрольной группе (1,0), то после первых суток начиналось незначительное, но достоверное (р < 0,05) снижение уровня АОИ2 до (0,93), который только на 9 сутки возвращался к пределам нормы после проведенной лекарственной коррекции.
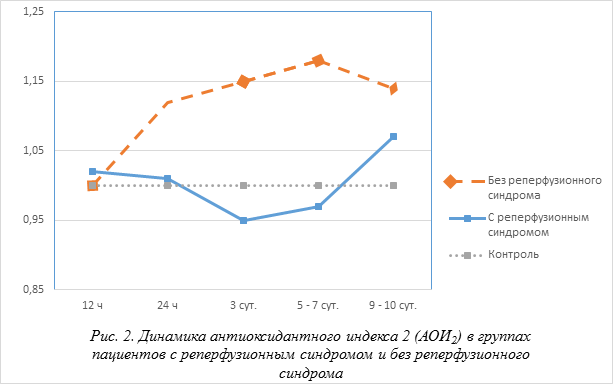
На оси ординат указаны относительные единицы АОИ2. По оси абсцисс время после операции. Достоверно при сравнении между группами (р < 0,05); достоверно по сравнению с группой контроля (р < 0,05).
В группе пациентов без последствия реперфузионного синдрома величина АОИ2 прогрессивно повышалась и достигала максимальных значений – 1,20 на 8 сутки и к 9 – 11 суткам снижалась до 1,13, оставалась выше нормы (р < 0,01). Динамика индекса, отражающего общий антиоксидантный статус (АОИ) представлена на (рис. 3). Динамика показателей интегрального антиоксидантного индекса (АОИ) с реперфузионным синдромом и без реперфузионного синдрома острой кишечной непроходимости отражают состояние окислительного стресса, что подтверждают отрицательные значения АОИ при нормальном значении равном нулю. Однако при практически параллельном характере изменения АОИ после операции у пациентов острой кишечной непроходимости, осложненный реперфузионным синдромом, значения индекса были достоверно ниже в первые 3–6 часов, 12–24 часов и на 6-е сутки (р < 0,05), чем при отсутствии реперфузионного синдрома. На 3– 5 сутки после развития реперфузионного синдрома амплитуда сдвига индекса в отрицательную сторону составляла от 30 до 60 % (рис. 3).
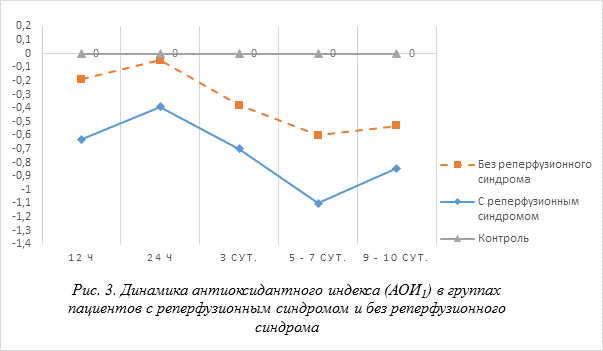
На оси ординат указаны относительные единицы АОИ. По оси абсцисс время после операции. Достоверно при сравнении между группами (р < 0,05); достоверно по отношению к контрольной выборке (р < 0,05).
Таким образом, в состоянии антиоксидантной системы пациентов можно отметить два критических периода, связанных с усилением окислительного стресса первые 6–12 часов после операции и 5–7 сутки, причем при развитии несостоятельности анастомоза с осложнением перитонита резко возрастает окислительный стресс. С целью анализа прогностической ценности АОИ в развитии после операции реперфузионных осложнений у пациентов были построены RОС-кривые для уровня АОИ, измененного в разные временные промежутки с момента операции. При этом прогностический эффект АОИ оказался максимальным в интервале 6–12 часов, исходя из величины значения площади под ROC- кривой. Значение площади составляло 0,870, что является прогностически плохим показателем. В динамике ROC-анализ в интервале 12–24 часа показал, что АОИ прогнозирует развитие первых признаков реперфузионного синдрома у пациентов острой странгуляционной кишечной непроходимости. В группе пациентов с развитием реперфузионного синдрома, в отличие от группы без реперфузионного синдрома, отмечали достоверное (р < 0,05) угнетение антиоксидантной системы в первые 6–12 часов и 3–5 сутки, что указывает на его возможную раннюю прогностическую значимость в развитии реперфузионных осложнений в первые 6–12 часов. При изучении длительности предоперационного периода установлено, что только 28,4 % больных оперированы в первые сутки с уровнем летальности 4 %. В сроки от 2 до 3 суток с момента заболевания оперированы 22,7 % пациентов с летальностью 15,0 %. Пациенты оперированы в сроки 4 и более суток с максимальной летальностью – 55–60 % (таблица). Установлено, что минимальный уровень послеоперационных осложнений 5,6 % отмечался при длительности предоперационного периода до 6–12 часов без прогностических признаков реперфузионного синдрома. В сроки более 12 часов с проявлением прогностических признаков реперфузионного синдрома более достоверно выше и составляет от 23,6 % до 35,2 % летальности. Проведенный анализ динамики тяжести состояния пациентов в послеоперационном периоде зависит от реперфузионных осложнений с учетом критерия состояния при поступлении 6–12 ч и на 5–7 сутки после операции. Это время является наиболее критическим для пациентов после наложения анастомозов. У пациентов, которым наложен анастомоз, несмотря на исходно более низкий уровень SAPS (2.98), к пятым суткам послеоперационного периода наблюдалось ухудшение показателя на 0,25 – у 4-х пациентов, и у них отмечался резко выраженный окислительный стресс. В то же время как у пациентов, не имеющих осложнения реперфузионного синдрома, отмечалось улучшения показателя SAPS на 0,85. Данные различия статистически достоверны (Mann – WhitneyU тест р = 0,00003).
Летальность при различной длительности предоперационного периода
|
Длительность предоперационного периода. |
Количество пациентов |
Тяжесть по шкале SAPS |
Умерло |
Летальность |
|
0 – 12 часов |
18 |
3,12 |
- |
- |
|
13 – 24 часа |
25 |
5,52 |
1 |
4 % |
|
25 – 48 часа |
20 |
6,23 |
3 |
15 % |
|
49 – 72 часа |
15 |
6,56 |
5 |
33,3 % |
|
73 – 96 часа |
10 |
6,85 |
6 |
60 %* |
|
Всего |
88 |
15 |
17 % |
* – р < 0.05 по сравнению с длительностью предоперационного периода до 12 часов.
Заключение. Таким образом, полученные результаты свидетельствуют, что улучшение кровотока и доставка кислорода к ишемизированным тканям кишечника после устранения кишечной непроходимости сопровождается развитием относительной гипероксии в кишечнике, где процессы гиперпероксидации липидов превалируют над активностью антиоксидантной системы. Эти факторы приводят к дальнейшей интенсификации ПОЛ и ослаблению АОС. Ухудшение микроциркуляции, увеличение кислородного дефицита и проявление системной воспалительной реакции характерны для развития реперфузионного синдрома. Так, наиболее интенсивное нарушение баланса между накоплением ПОЛ и активности антиоксидантных ферментов выявлено у пациентов острой кишечной непроходимости, у которых во время операции была обнаружена странгуляционная кишечная непроходимость с дальнейшим развитием реперфузионного синдрома. Таким образом, индекс АОИ может быть включен в комплекс ранних прогностических маркеров развития реперфузионных осложнений у пациентов острой кишечной непроходимости.
Библиографическая ссылка
Магомедов М.М., Бациков Х.А., Иманалиев М.Р., Дамадаев Д.М. РОЛЬ ОКИСЛИТЕЛЬНОГО СТРЕССА КАК КОМПОНЕНТА РЕПЕРФУЗИОННОГО СИНДРОМА ПРИ ОСТРОЙ КИШЕЧНОЙ НЕПРОХОДИМОСТИ // Современные проблемы науки и образования. 2016. № 6. ;URL: https://science-education.ru/ru/article/view?id=25746 (дата обращения: 23.01.2026).



