В лечении ряда заболеваний и сопровождающих воспалительных процессов важно, чтобы высвобождение лекарства происходило постепенно, в требуемых дозах и в течение определенного времени. Для этого создают системы контролируемой доставки, используя технологию иммобилизации лекарственного средства на подходящем носителе, что является перспективным направлением биотехнологии и фармакологии.
Одним из способов модификации и улучшения потребительских свойств лекарственных средств является инкапсулирование, представляющее собой процесс заключения в оболочку микроскопических частиц твердых, жидких или газообразных веществ [2; 6]. Этим приемом решаются и многие проблемы, связанные с повышением устойчивости витаминных, ферментных, вакцинных, сывороточных, антимикробных препаратов, маскировкой вкуса горьких и тошнотворных лекарств, их высвобождением в нужном участке желудочно-кишечного тракта, пролонгированием действия, совмещением в одном средстве не сочетаемых между собой веществ и пр.
Инкапсулирование с использованием пленкообразователей - альгината натрия, желатина, поливинилового спирта и др. – один из широко практикуемых методов модификации как лекарственных препаратов, так и пробиотиков [12].
Цель работы – обоснование подходов к созданию эффективного способа инкапсулирования антимикробных веществ, полученных из штаммов Bacillus lentus, Geobacillus thermoglucosidasius и Paenibacillus polymyxa, с использованием альгината натрия и хитозана.
Материалы и методы исследования
Объектами исследования служили:
1. Антимикробное вещество – биосурфактант (далее - препарат БСФ), полученный из штамма B. lentus В-7150 по методике выделения в межфазную пленку [1; 4; 5]. Препарат БСФ отличается преимущественным действием на широкий спектр грамотрицательных бактерий (исключая Pseudomonas), устойчивостью к нагреву до 120 °С в течение 15 мин. Разрушается при сочетанном действии щелочной среды (рН 10) и автоклавирования (120 °С, 20 мин), а также протеиназой К (36 °С, 48 ч).
2. Антимикробное вещество – поверхностно-клеточный экстракт (далее - препарат ПКЭ), полученный из штамма B. lentus В-7150 по методике обработки бактерий водно-спиртовой смесью с последующим удалением этанола [4]. Препарат ПКЭ действует на некоторые виды грамположительных и грамотрицательных бактерий, выдерживает нагрев до 120 °С в течение 15 мин, не разрушается протеолитическими ферментами.
3. Антимикробное вещество – бактериоцин В-602 широкого спектра противобактерийного действия, полученный из штамма P. polymyxa B-602 [10].
4. Антигрибковое вещество – низкомолекулярный метаболит, полученный из штамма G. thermoglucosidasius 97 (далее - препарат Gbt-97) [3]. Препарат Gbt-97 эффективен против возбудителя микозов (Candida albicans), возбудителей фузариозов (Fusarium spp.) зерновых культур и возбудителя «снежной плесени» (Microdochium nivale). Выдерживает нагрев при 80 °С в течение 20 мин, устойчив к протеолизу.
Тест-штаммы: Escherichia coli M17, Listeria monocytogenes 776, Fusarium spp., Microdochium nivale 4995, Candida albicans РКПГУ 1244/CBS-8837.
Иммобилизация веществ в альгинатные шарики. Приготовление объектов грануляции проводили растворением антимикробных веществ (АМВ) во взвешивающей среде в виде жидкого концентрата либо сухого вещества. В первом случае по 5 мл раствора АМВ смешивали с 10 мл 2%-ного раствора альгината натрия (Acros Organic, Бельгия). Во втором случае в альгинате указанной концентрации растворяли 200 мг навески АМВ. Для увеличения растворимости вещества в альгинат дополнительно вводили 0,1% неионогенного поверхностно-активного вещества (ПАВ) Triton X-100 (Serva). Смеси альгината с АМВ заправляли в разовые 10 мл шприцы и капали с высоты около 15 см через 0,8 мм иглы в 0,55%-ный раствор СаСl2. После 30 мин полимеризации образовавшиеся шарики вынимали из раствора, промывали дистиллятом, сливали воду и во флаконах помещали в холодильник. Одну часть гранул оставляли без изменений, вторую покрывали хитозановой мембраной.
Покрытие альгинатных шариков мембраной из хитозана. Для получения рабочего раствора 2 г хитозана пищевого кислоторастворимого (ООО «Биопрогресс», Московская обл., п. Биокомбината) вносили в 95 мл дистиллированной воды с 1 мл ледяной уксусной кислоты (Россия), смесь инкубировали при температуре 60 °С в течение 1 часа и после фильтровали через плотную хлопчатобумажную ткань - бязь. В полученный раствор хитозана после коррекции рН до 6,0 с помощью 1 моль/л NaOH вносили при перемешивании альгинатные гранулы с АМВ (около 12 г/100 мл) и выдерживали в течение около 30 мин. Гранулы вынимали из раствора хитозана, промывали дистиллированной водой и собирали в стеклянные флаконы для последующего высушивания и анализа.
Микрокапсулирование с хитозаном. Проводили методом эмульгирования водного раствора АМВ в масле с последующим разделением фаз и сбором целевой фракции [11]. Для получения водной фазы в стакан с 20 мл водного раствора хитозана (Х), приготовленного как описано выше, вносили с перемешиванием 5 мл раствора бактериоцина В-602. Для получения масляной фазы в стакан с 1 мл Triton X-100 вносили 80 мл парафинового (вазелинового) масла (Тульский фармзавод, Россия) и перемешивали на магнитной мешалке при 50 °С до растворения ПАВ. Затем туда медленно вводили водный раствор бактериоцина с хитозаном и после по каплям еще 25 мл 2%-ной лимонной кислоты как сшивающего агента. Образовавшуюся эмульсию дополнительно гомогенизировали 5 минут при 900-1000 об/мин на смесителе пропеллерного типа «MLM» (Венгрия) с последующей экспозицией при температуре 40 °С и постоянном перемешивании на магнитной мешалке в течение 1 часа. Далее гомогенизат заливали в делительную воронку, закрепленную на штативе, и оставляли при комнатной температуре на 3 дня. После полного расслоения фаз избыток масляной фазы (внизу) сливали, а эмульсию с микрогранулами декантировали и промывали гексаном при центрифугировании (5000 об/мин) в течение 10 мин и заливали водой для последующего использования в исследованиях.
Высушивание гранул. Для лиофилизации флаконы с различными вариантами приготовленных гранул замораживали при температуре -30 °С в течение 5 ч, помещали в камеру сублимационной установки Virtis BT-4k (США) и высушивали в течение 20 ч. Для конвективного обезвоживания альгинатные гранулы раскладывали монослоем на чистую ткань типа бязь на решетке сушилки «Суховей» (Россия), выдерживали при температуре 60° С в течение 1,5-2 ч. Хитозановые микрогранулы высушивали в тех же условиях за исключением того, что они помещались в стеклянные чашки, которые накрывали слоем ткани во избежание их уноса с потоком воздуха. Сухие гранулы собирали и перекладывали в стерильные флаконы, которые закрывали резиновыми пробками, фиксировали металлическими колпачками и помещали в холодильник для хранения и последующего изучения.
Контроль выхода веществ из гранул. Во флаконы с различными вариантами сухих гранул вносили по 5 мл стерильного физраствора и оставляли для обводнения на 20 мин. Затем из каждого флакона отбирали по 3-5 гранул (опытных и контрольных) и накладывали их на чашки Петри со свежезасеянными газонами тест-штаммов. Такую же процедуру повторяли через сутки-двое в течение месяца. Чашки с посевами инкубировали при температуре 36 °С в течение 20 ч, учитывая наличие и величину зоны ингибирования тест-штаммов.
Контроль целостности гранул в жидкости. Содержимое каждого флакона выливали в стерильные стаканы диаметром 40 мм и подсчитывали распределившееся монослоем количество гранул с измененной формой, соотнося их к числу с интактной морфологией в процентном выражении по формуле:
K = (ni/n0) x 100,
где К – коэффициент изменения формы, %;
ni – количество измененных гранул;
n0 - количество исходных гранул.
По результатам определений строили графические зависимости разрушения гранул от времени нахождения гранул в жидкости и проявления у них антимикробной активности.
Определение размера гранул. Размер альгинатных гранул определяли с помощью линейки и/или штангенциркуля, а хитозановых микрогранул - в препарате «раздавленная капля» под световым микроскопом, снабженным винтовым окулярным микрометром и объект-микрометром.
Все опыты проводили в трех повторностях и в расчет принимали средние их значения.
Результаты исследований и их обсуждение
При инкапсулировании образцов было установлено, что размер и внешний вид гранул различались в зависимости от условий введения АМВ в альгинат (жидкость-жидкость, порошок-жидкость) и последующего их высушивания. Так, сырые гранулы, приготовленные по варианту «жидкость-жидкость» (Ж:Ж) имели размер 2,5±0,3 мм (рис. 1а). Несколько крупнее (2,9±0,3 мм) получались сферы по варианту «порошок-жидкость» в случае введения в альгинат сухого порошкового (П) АМВ (рис. 1б). Еще более крупными (3,1± 0,2 мм) были гранулы, полученные по варианту «П:Ж с ПАВ+Х» при котором дополнительно использовали поверхностно-активное вещество (ПАВ) тритон Х100 в количестве 0,1% и выдерживание в растворе хитозана (рис. 1в). Лиофилизация приводила к частичному разрушению альгинатных шариков (рис. 2 б, в) что практически не наблюдали после их конвективного высушивания (рис. 2г).
 а
а  б
б  в
в
Рис. 1. Вид альгинатных гранул, приготовленных из жидкого (а), сухого (б, в) БСФ, а также его варианта с ПАВ и дополнительным покрытием хитозаном (в)
 а
а  б
б
 в
в  г
г
Рис. 2. Альгинатные гранулы с АМВ B. lentus В-7150 до (а) и после высушивания методом лиофилизации (б, в) и тепловой конвекции (г)
Все варианты гранул, как показали результаты тестирования, не распадались, но несколько видоизменялись при нахождении в воде в условиях комнатной температуры в течение месяца (рис. 3 а, б, в). Морфологически наиболее стабильными были гранулы, полученные с использованием тритон Х100 и хитозана (рис. 3г, 4).
 а
а  б
б  в
в  г
г
Рис. 3. Варианты альгинатных гранул после месяца нахождения в воде при комнатной температуре, приготовленных из: жидкого вещества (а), то же - с хитозаном (б), порошка вещества (в), то же – с тритон Х100 и хитозаном (г)
Биологическое тестирование показало, что антимикробная активность (АА) сохраняется на всех стадиях приготовления образцов гранул: смешивания АМВ с раствором полимера, в процессе и после инкапсулирования (рис. 5а, 6), высушивания и регидратации (рис. 5 б, в). При этом в контрольных гранулах, не содержащих АМВ, антимикробная активность не выявлялась (рис. 5б, 6, 7).
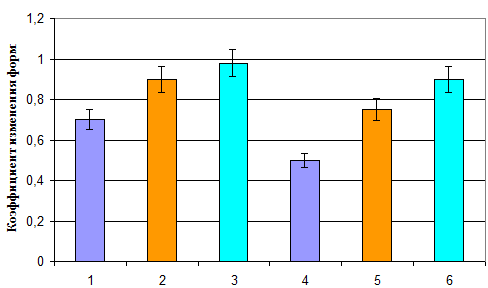
Рис. 4. Изменение формы альгинатных гранул в зависимости от способа их подготовки и введения антимикробных веществ.
Столбцы 1, 2, 3 – параметры сырых гранул; 4, 5, 6 – после сушки; 1 и 4 – гранулы, приготовленные введением в альгинат раствора АМВ-СФ (вариант Ж:Ж), 2 и 5 – то же, порошка (вариант П:Ж); 3 и 6 – до введения порошка АМВ альгинат был предварительно модифицирован 0,1% ПАВ, а сырые гранулы до их сушки выдержаны в растворе хитозана (вариант П:Ж с ПАВ+Х)
 а
а  б
б 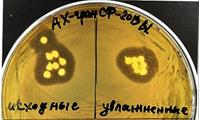 в
в
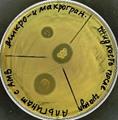
Рис. 5. Проявление активности образцов АМВ на основе B. lentus В-7150 против тест-штамма E.coli M17 в процессе инкапсулирования, после высушивания и увлажнения: а) чашка с пробами исходной смеси «альгинат+АМВ» (слева внизу), полученных из них гранул (в центре), жидкости после промывки гранул (справа внизу) и хитозановых микрогранул (верх); б) чашка с лиофилизированными образцами альгинатных гранул с пятью вариантами действующих веществ и контролем (без них); в) чашка с конвективно высушенными и увлажненными альгинатными гранулами, содержащими БСФ
 а
а 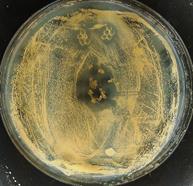 б
б  в
в
Рис. 6. Проявление активности антигрибкового вещества Gbt-97 на основе G. thermoglucosidasius 97 против тест-штамма C. albicans в процессе инкапсулирования, после высушивания и увлажнения: а) вид чашки с пробами (по часовой стрелке) альгината натрия, противогрибкового вещества, его смеси с альгинатом и в гранулах (сырых – вверху, высушенных – в центре) со стороны донышка; б) вид той же чашки со стороны крышки; гранулы, использованные в опыте (в)
 а
а 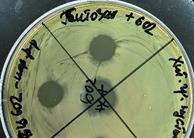 б
б  в
в
Рис. 7. Проявление активности хитозановых микрогранул с бактериоцином P. polymyxa B-602 против тест-штаммов L.monocytogenes 776 (а) и E.coli M17 (б) в процессе получения. Пробы на чашках (по часовой стрелке): хитозановые микрогранулы без АМВ 602, раствор рабочий 602 и микрогранулы с ним. В центре – неразбавленный 602. Микрогранулы (в)
Установлено, что динамика снижения противобактерийной активности гранул зависела от состава действующего начала (рис. 8) и способа их высушивания (рис. 9). На примере биосурфактанта B. lentus было выявлено, что активность альгинатных гранул, покрытых хитозаном и высушенных методом тепловой конвекции, сохранялась более длительно. Также отличались высокой стабильностью и чисто хитозановые гранулы.
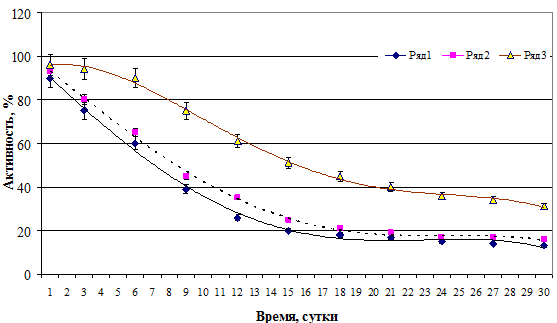
Рис. 8. Динамика изменения активности альгинатных гранул в зависимости от состава антимикробного вещества B. lentus. Ряд 1 – ИФП-А; ряд 2 – ПКЭ-А+Х; ряд 3 – СФ-А+П+Х
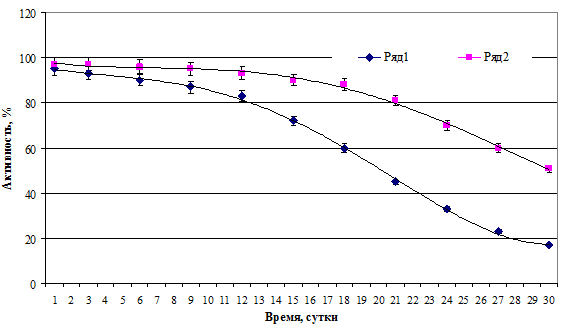
Рис. 9. Динамика изменения активности альгинатных гранул с антимикробным веществом на основе B. lentus в зависимости от способа их высушивания. Ряд 1 – ПКЭ-А+Х после лиофилизации; ряд 2 – ПКЭ-А+Х после конвективного высушивания
Таким образом, в результате проведенных исследований были отработаны условия получения альгинатных и хитозановых гранул c антимикробными веществами естественного происхождения, выделенными из представителей спорообразующих бактерий – B. lentus, Gb. thermoglucosidasius и P. polymyxa. Выбор указанных веществ для инкапсулирования в полимерные носители был обусловлен натуральностью их происхождения и оригинальностью, активностью против представителей бактерий и грибов, а также перспективностью как потенциальных моделей для совершенствования материалов и методов борьбы с опасными микроорганизмами. Альгинат натрия и хитозан с успехом используются для доставки лекарств через нос [7], слизистые мембраны глаз [9], а также ротовую полость [8].
Выводы
Исследованы зависимости формы получаемых матриксов из альгината натрия от состава используемых ингредиентов и времени пребывания в жидкости.
Установлено, что лиофилизация альгинатных гранул вызывает частичную деструкцию матриксов, сопровождаемую снижением антимикробного потенциала дозированной формы, что не происходит после их конвективного высушивания.
Наиболее стабильные результаты по устойчивости к распаду и сохранению антимикробной активности показали варианты альгинатных гранул с хитозановым покрытием.
Результаты выполненных исследований позволили выбрать методические подходы к созданию эффективного способа капсулирования антимикробных веществ бациллярного происхождения как доступных моделей при создании систем контролируемой доставки перспективных лекарственных средств.
Работа была выполнена по теме: «Разработка технологии инкапсулирования и контролируемого высвобождения антимикробных субстанций для борьбы с опасными патогенами человека» в рамках отраслевой научно-исследовательской программы Роспотребнадзора «Проблемно-ориентированные научные исследования в области эпидемиологического надзора за инфекционными и паразитарными болезнями».
Библиографическая ссылка
Похиленко В.Д., Дунайцев И.А., Перелыгин В.В., Лев И.О., Калмантаев Т.А. ИММОБИЛИЗАЦИЯ АНТИМИКРОБНЫХ ВЕЩЕСТВ БАКТЕРИАЛЬНОГО ПРОИСХОЖДЕНИЯ В ПОЛИМЕРНЫЕ МАТРИКСЫ И ОЦЕНКА ИХ СВОЙСТВ // Современные проблемы науки и образования. 2016. № 6. ;URL: https://science-education.ru/ru/article/view?id=25742 (дата обращения: 03.02.2026).
DOI: https://doi.org/10.17513/spno.25472



