В настоящее время сахарный диабет (СД) является одним из самых распространённых эндокринных заболеваний; так к концу 2015 года численность больных СД по данным Международной диабетической федерации составила 415 млн человек и число пациентов продолжает стремительно расти. Причиной этому служит возрастание влияния на человека негативных факторов внешней среды – неправильное питание, малоподвижный образ жизни, стресс, плохая экология и множество других факторов [4].
Исследования последних лет показали, что применение устойчивых аналогов глюкагон подобного пептида 1 (ГПП-1) – эксенатида и лираглутида для лечения СД 2 типа, помимо выраженного гипогликемического действия, значимо снижает риск развития сердечно-сосудистых осложнений сахарного диабета. В большом количестве экспериментальных работ было отмечено их эндотелио-, кардио- и нейропротекторное действие [1,2,7,11].
Рецептор GPR119, расположенный на энтероэндокринных клетках, вырабатывающих ГПП-1 и ГИП, рассматривается в качестве перспективной фармакологической мишени для новой группы соединений с гипогликемической активностью, повышающих секрецию эндогенных инкретинов [5,10]. Однако пока нет опубликованных данных, показывающих церебропротекторный потенциал соединений, повышающих секрецию эндогенных инкретинов, при ишемическом поражении головного мозга.
Цель исследования: оценить влияние лечебно-профилактического введения нового агониста GPR119 рецептора, соединения ZB-16 на течение ишемии головного мозга при необратимой окклюзии общих сонных артерий.
Материалы и методы
Исследование проводилось на 85 интактных крысах-самцах массой 280–300 г, в возрасте 6–7 месяцев (питомник лабораторных животных ФГУП ПЛЖ «Рапполово», Санкт-Петербург). Животные содержались в стандартных условиях вивария со свободным доступом к воде и пище. Все манипуляции с животными проводились с учетом правил лабораторной практики, изложенных в «Руководстве по проведению доклинических исследований лекарственных средств», ч. I (М.,2012) под ред. А.Н. Миронова.
Исследование церебропротективной активности агониста рецептора GPR119 выполнено на модели ишемии головного мозга, воспроизводимой одномоментной необратимой перевязкой общих сонных артерий [9]. В качестве наркоза использовали хлоралгидрат (400 мг/кг, внутрибрюшинно).
Исследуемое соединение под лабораторным шифром ZВ-16 (дипиарон) (рисунок 1) было синтезировано в ЗАО ИИХР г. Химки РФ и представляет собой высокоселективный агонист рецептора GPR119 (EC50 M – 7.25E-09). По результатам предыдущих исследований, соединение ZВ-16 оказывает сопоставимое с препаратом из группы ингибиторов ДПП-4 (ситаглиптин) гипогликемическое действие у животных с экспериментальным сахарным диабетом [5,10].
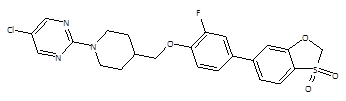
Рис. 1. Химическая структура агониста GPR119 рецептора – соединения ZВ-16
Агонист рецептора GPR119 вводился в 4-х дозах (0,1, 1, 10, 25 мг/кг), с учетом фармакокинетических параметров соединения (Tmax=4ч, t1/2=13ч): за 4 часа до операции, затем через 12, 24, 48 и 72 часа после операции, в виде водной суспензии перорально. В качестве препарата сравнения использовали цитиколин в дозе 500 мг/кг (peros) [6].
Летальность, неврологический дефицит (баллы по шкале McGrow) и нарушение координации движений (в тесте «Ротарод») регистрировали через 24, 48 и 72 часа после операции. Двигательную и ориентировочно-исследовательскую активность оценивали через 72 часа в тесте «Открытое поле» [8].
Были сформированы 7 групп животных:«ЛО+физ.р-р» – ложнооперрированная (ЛО) – у животных этой группы выполнялись все манипуляции по выделению сонных артерий и подведению под них лигатур, но окклюзию не воспроизводили (n=10); «ООСА+физ.р-р» – животным воспроизводили двустороннюю окклюзию общих сонных артерий (ООСА) и вводили физиологический раствор (n=15); 3-я, 4-я, 5-я и 6-я группа животных с ООСА получали соединение ZB-16 соответственно в дозах 0,1, 1, 10 и 25 мг/кг (n=12); 7-я группа животных с ООСА получала препарат сравнения цитиколин (500 мг/кг) (n=12).
Статистическую обработку результатов исследования проводили с использованием пакетов программ: Microsoft Office Excel 2013, (Microsoft, США) и Statistica 6,0 (StatSoft, Inc., США), а также критериев Краскела – Уолиса, Дана и критерия хи-квадрат. Статистически значимой считалась разница при p<0,05.
Результаты
Перевязка сонных артерий вызвала гибель большинства животных контрольной группы (60 %), которые получали физиологический раствор, а также соединение ZB-16 в дозе 0,1 мг/кг (58 %) в качестве лечения (таблица). Введение соединения ZB-16 в дозе 1 мг/кг также не приводило к значительному снижению количества погибших, однако в группах, получавших его в дозах 10 и 25 мг/кг, наблюдалась сходная тенденция к снижению количества погибших животных по сравнению с контрольной группой (p<0,1) (по 4 погибших животных из 12 (33 %)), что было сопоставимо с таковым в группе, получавшей цитиколин (25 %) (p<0.05).
Летальность животных после перевязки общих сонных артерий
|
Группа |
Количество погибших животных после ООСА |
n |
% |
||||
|
6 часов |
12 часов (сумма) |
24 часа (сумма) |
48 часа (сумма) |
72 часа (сумма) |
|||
|
ЛО+физ.р-р |
- |
- |
- |
- |
- |
10 |
0 |
|
ООСА+физ.р-р |
2 |
1 (3) |
3 (6) |
2 (8) |
1 (9) |
15 |
60 |
|
ООСА+ZB-16(0,1 мг/кг) |
2 |
1 (3) |
2 (5) |
1 (6) |
1 (7) |
12 |
58 |
|
ООСА+ZB-16 (1 мг/кг) |
1 |
3 (4) |
- (4) |
1 (5) |
1 (6) |
12 |
50 |
|
ООСА+ZB-16 (10 мг/кг) |
1 |
- (1) |
1(2#) |
2 (4) |
- (4#) |
12 |
33 |
|
ООСА+ZB-16 (25 мг/кг) |
1 |
1 (2) |
1 (3) |
- (3#) |
1(4#) |
12 |
33 |
|
ООСА+Цитиколин |
- |
2 (2) |
- (2#) |
-(2*) |
1(3*) |
12 |
25 |
Примечание: * – различия достоверны относительно группы «ООСА+физ.р-р» при p<0,05, # – тенденция к снижению количества погибших животных по сравнению с группой «ООСА+физ.р-р» (p<0,1) (критерий хи-квадрат).
У выживших животных после моделирования ишемии головного мозга возникали симптомы неврологического дефицита в виде парезов и параличей конечностей, одно- и двусторонних блефароптозов, мышечного тремора, манежности движений, судорог и ком. Наиболее выраженными они были у животных контрольной группы, получавших физиологический раствор. Так, через 24 часа после перевязки неврологический дефицит по балльной шкале McGrowу этих животных достиг 4,87±1,13 балла, к 48 и 72 часам уже 6,47±1,07 и 6,80±1,06 балла соответственно. У животных, которым вводилось исследуемое соединение в дозе 10 и 25 мг/кг, выраженность симптомов неврологического дефицита была значимо меньше и через 72 часа соответственно составляла 3,88±1,32 и 3,83±1,33 балла (рисунок 2). Таким образом, введение исследуемого агониста GPR119 в дозе 10 и 25 мг/кг значимо снижает тяжесть неврологических симптомов у животных после перевязки сонных артерий, незначительно уступая по эффективности цитиколину.
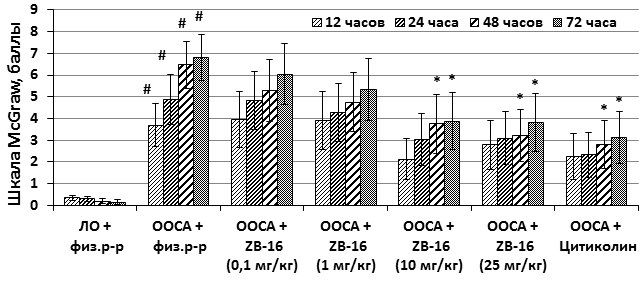
Рис. 2. Неврологический дефицит животных в баллах (McGrow)
Обозначения: # – различия достоверны относительно группы «ЛО+физ.р-р»; * – различия достоверны относительно группы «ООСА+физ.р-р» (p<0,05, критерий Дана).
На фоне введения исследуемого соединения в дозах 1, 10 и 25 мг/кг, ориентировочно-исследовательская активность выживших животных через 72 часа после перевязки общих сонных артерий была дозозависимо выше по сравнению с контрольной группой (рисунок 3).
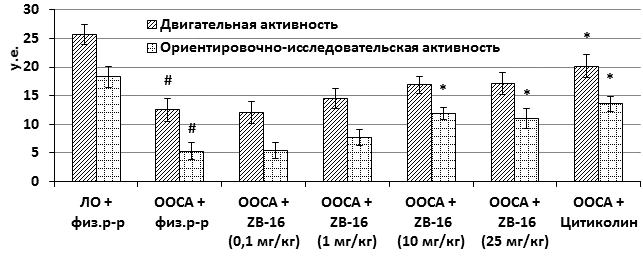
Рис. 3. Двигательная и ориентировочно-исследовательская активность животных после перевязки сонных артерий
Обозначения: # – различия достоверны относительно группы «ЛО+физ.р-р»; * – различия достоверны относительно группы «ООСА+физ.р-р» (p<0,05, критерий Дана).
Для оценки сенсомоторной координации, силы и выносливости в экспериментальной практике широко используется тест Ротарод, в том числе и для определения неврологических нарушений после моделирования различных патологий мозгового кровообращения. В нашем исследовании тест Ротарод проводили через 24, 48 и 72 часа после перевязки общих сонных артерий, фиксировали латентный период первого падения после «посадки» животного на вращающийся барабан (время наблюдения 3 минуты). В контрольной группе наблюдалось значительное снижение обоих показателей (в 6–7 раз по сравнению с группой ЛО), при этом во всех опытных группах (кроме группы, получавшей ZB-16 в дозе 0,1 мг/кг) наблюдалось увеличение времени удержания с первых к третьим суткам тестирования. У животных, получавших соединение ZB-16 в разных дозах, начиная с 1 мг/кг, и особенно при использовании 10 и 25 мг/кг, наблюдалась выраженная позитивная динамика восстановления мышечной силы и координации движений. Животные, получавшие соединение ZB-16 в дозах 10 и 25 мг/кг, значимо превосходили показатели контрольной группы животных и лишь незначительно уступали тем, которые получали цитиколин (рисунок 4А и Б).
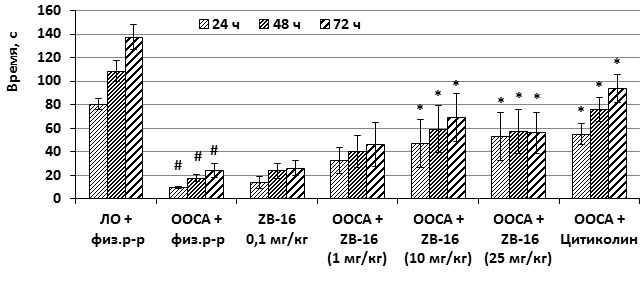
Рис. 4. Время удержания на вращающемся стержне в тесте «Ротарод» за 1 попытку
Обозначения: # – различия достоверны относительно группы «ЛО+физ.р-р»; * – различия достоверны относительно группы «ООСА+физ.р-р» (p<0,05, критерий Дана).
Обсуждение
Противодиабетические препараты на основе агонистов GPR119 предполагаются для применения пациентами с СД2 типа, которые, как известно, имеют повышенный риск развития ишемического инсульта [3]. Соединение ZB-16 является селективным агонистом GPR119 рецептора и в наших предыдущих исследованиях проявляло выраженную гипогликемическую активность и нормализовало параметры коагуляционного гемостаза у животных с экспериментальным СД 2 типа, что очевидно связано с повышением уровня инкретинов при активации данного рецептора на энтероэндокринных клетках [5,10]. Учитывая нейро- и эндотелиопротекторные свойства средств с инкретиновой активностью [2,11], мы предположили, что исследуемый агонист рецептора GPR119 может снижать тяжесть течения ишемического поражения головного мозга при перевязке общих сонных артерий у интактных животных.
В проведенном исследовании, в группах животных, получавших соединение ZB-16 в дозах 10 и 25 мг/кг перед моделированием ишемии головного мозга и ежедневно в течение 3-х дней после нее, отмечалась меньшая смертность, более низкий неврологический дефицит и более высокая исследовательская активность, мышечная сила и координация движений по сравнению с группой без лечения. Ранее нами было показано, что увеличение дозы соединения ZB-16 с 0,1 мг/кг до 1 мг/кг приводило к увеличению его гипогликемического действия на животных со стрептозотоцин-никотинамид-индуцированным СД, но дальнейшее увеличение до 10 мг/кг такого эффекта не оказывало. В то же время исследуемый агонист относится к малотоксичным веществам (острая токсичность при пероральном применении составляла выше 2500 мг/кг для крыс, неопубликованные данные), что позволяет оценить его плейотропные эффекты на более высоких дозах. Мы предположили, что гипогликемическое действие соединения ZB-16 ограничено возможностью поджелудочной железы, поскольку является инкретинопосредованным и, следовательно, инсулинозависимым, однако это утверждение может не распространяться на его плейотропные эффекты. Поэтому при анализе церебропротекторного действия мы увеличили дозу соединения ZB-16 до 10 и 25 мг/кг. Оказываемое исследуемым соединением церебропротекторное действие при его превентивно-терапевтическом применении в дозах 10 и 25 мг/кг было сопоставимо с таковым у препарата сравнения – цитиколина.
Полученные результаты позволяют говорить о способности агониста GPR119 рецептора – cединения ZB-16 оказывать положительное влияние на течение и исход ишемического поражения головного мозга при превентивно-терапевтическом применении.
Выводы
Лечебно-профилактическое введение агониста GPR119 рецептора – соединения ZB-16 в дозах 10 и 25 мг/кг значимо повышало выживаемость животных после одномоментной необратимой перевязки общих сонных артерий, уменьшало выраженность неврологических нарушений по шкале McGraw, координацию движений в тесте Ротарод, а также двигательную и ориентировочно-исследовательскую активность в тесте Открытое поле.
Работа выполнена при финансовой поддержке Минпромторга РФ, в рамках реализации государственного контракта «Доклинические исследования лекарственного средства для лечения сахарного диабета 2 типа на основе агонистов GPR119 рецептора» № 13411.1008799.154 от 24 июля 2013 года.
Библиографическая ссылка
Бакулин Д.А., Куркин Д.В., Волотова Е.В., Шафеев М.А., Тюренков И.Н. ЦЕРЕБРОПРОТЕКТОРНАЯ АКТИВНОСТЬ РАЗНЫХ ДОЗ АГОНИСТА GPR119 – СОЕДИНЕНИЯ ZB-16 ПРИ ЭКСПЕРИМЕНТАЛЬНОЙ ИШЕМИИ ГОЛОВНОГО МОЗГА // Современные проблемы науки и образования. 2016. № 6. ;URL: https://science-education.ru/ru/article/view?id=25714 (дата обращения: 13.02.2026).



