Глюкокортикоиды (GC) широко применяются при терапии лейкозов и лимфом как самостоятельный цитостатический препарат [7]. Биологические эффекты GC реализуются посредством активации глюкокортикоидного рецептора (GR) – фактора транскрипции, который регулирует экспрессию генов по двум различным механизмам. Терапевтическое действие GC реализуется через транс-репрессию – белок-белковое взаимодействие GR с факторами транскрипции, что приводит к снижению жизнеспособности опухолевых клеток. Развитие метаболических осложнений связано с запуском транс-активации, требующей связывания GR с респонсивными элементами в промоторных областях антиапоптотических генов [2, 4, 10].
За последнее десятилетие было предложено большое количество подходов по увеличению активности GC и снижению побочных эффектов от их применения. В частности, были описаны селективные агонисты глюкокортикоидного рецептора (SEGRA), которые не приводят к образованию гомодимера GR и, соответственно, запускают лишь транс-репрессорные механизмы [3, 8]. К классу SEGRA относится соединение растительного происхождения 2-(4-ацетоксифенил)-2-хлор-N-метилэтиламмоний хлорид, или CpdA. Ранее нами был продемонстрирован GR-зависимый противоопухолевый эффект CpdA in vitro и in vivo на моделях гемобластозов [1, 6]. Однако также было показано, что CpdA является нестабильной молекулой, распадающейся в водном растворе до производного азиридина, относящегося по классификации к канцерогенам класса 2Б [5, 9]. Аналоги CpdA с более стабильной структурой в литературе не описаны.
Таким образом, разработка путей химической модификации селективного модулятора GR, соединения растительного происхождения CpdA с целью увеличения стабильности и биологической активности данной молекулы, а также оценка биологических эффектов полученных соединений на модельной системе лейкозов и лимфом [1, 6] является актуальной задачей современной молекулярной биологии и экспериментальной онкологии.
Цель исследования
Целью данного исследования являлся синтез химического производного CpdA (аналога Синефрина), исследование его связывания с GR и оценка его GR-зависимых антипролиферативных и проапоптотических эффектов на модельной системе гемобластозов in vitro в сравнении с CpdA и дексаметазоном (Dex).
Материалы и методы исследования
Синтез CpdA–01. Синтез CpdA–01 был проведен по схеме, указанной на рис. 1.
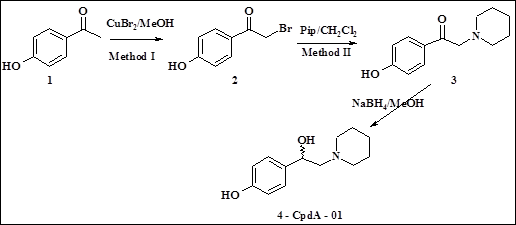
Рис. 1. Схема получения CpdA–01
Смесь ацетофенона1 (3.00 ммоль) и бромида меди (II) (7.50 ммоль) в метаноле (15 мл) перемешивали при комнатной температуре в течение ночи, затем кипятили до полного исчезновения в реакционной массе исходного кетона, вылили в ледяную воду (200 мл), экстрагировали хлористым метиленом (3×60 мл), объединённые органические фазы промыли водой (3×40 мл), профильтровали через слой (1 см) силикагеля, упарили и остаток очищали с помощью колоночной хроматографии на силикагеле (элюент петрол. эфир/этилацетат 6:1). Полученный твердый остаток (соединение 2) перекристаллизовали из смеси петролейный эфир-этилацетат. Далее смесь бромкетона2 (0.26 ммоль), пиперидина (0.55 ммоль) в абс. хлористом метилене (8 мл) перемешивали при комнатной температуре в течение 4 ч, затем – кипятили до полного исчезновения исходного бромкетона (ТСХ-контроль), вылили в ледяную воду (60 мл) и экстрагировали хлористым метиленом (3×20 мл). Объединённые органические фазы промыли водой (2×30 мл), высушили над сульфатом магния, упарили, остаток очистили с помощью колоночной хроматографии на силикагеле (элюент петрол. эфир / этилацетат/Et3N 3:1;0.05). Твердый остаток (соединение 3) перекристаллизовали из смеси петролейный этанола. Далее к охлажденному до 10 °С раствору аминокетона 3 (3.0 ммоль) в абс. метаноле (30 мл) порциями добавили боргидрид натрия (30 ммоль) и перемешивали раствор при комнатной температуре в течение 5 часов. Реакционную смесь вылили в воду (150 мл), экстрагировали этилацетатом (3×30 мл), экстракт промыли водой (50 мл) и упарили. Остаток очистили хроматографически (элюент петролейный эфир / этилацетат/Et3N 1:1:0,05), диастереомеры не были разделены. Остаток перекристаллизовали из смеси хлористый метилен-гептан. Получали 4-(1-гидрокси-2-пиперидин-1-илэтил) фенол 4. Выход 68 %. 1H ЯМР (300 МГц,DMSO-d6) 1.26-1.40 (m, 2H); 1.40-1.59 (m, 4H); 2.14-2.53 (m. 6H); 4.47-4.60 (m, 1H); 6.67 (d, 2H, J = 6.60 Гц); 7.10 (d, 2H, J = 6.60 Гц); Масс-спектр (EI, 70 eV): m/z (%) = 221.
Клеточные линии и обработка клеток. В работе использовали клетки острого лимфобластного лейкоза линии СЕМ и клетки мантийноклеточной лимфомы Granta, стабильные клеточные линии Granta-shGR и СЕМ-shGR с подавленной экспрессией GR, полученные нами ранее путем трансдукции в клетки указанных линий лентивирусных конструкций, экспрессирующий короткую шпилечную РНК к гену GR [6]. Клетки культивировали в стандартной среде RPMI-1640, содержащей 5 %-ную эмбриональную сыворотку телят и гентамицин (все реактивы «ПанЭко», Россия) (50 ед/мл) при 37 °С и в 5 %-ном СО2. Клетки обрабатывали CpdA,CpdA-01 и Dex(«Sigma-Aldrich», США).
Конкурентное связывание. Анализ связывания CpdA, CpdA-01 и Dex проводили с использованием набора для PolarScreen™ Glucocorticoid Receptor Competitor Assay (Invitrogen, США) по протоколу производителя. Вкратце, в 96-луночном черном планшете смешивали буферный раствор, содержащий рекомбинантный GR в концентрации 4 нМ, буферный раствор, содержащий 2,5 нМ флуоресцентно-меченого лиганда GR Fluormone GS1, а также водные растворы исследуемых соединений в конечных концентрациях 0,1 нМ-0,1 мМ. Далее пробы инкубировали в защищенном от света месте при комнатной температуре 4 ч. Поляризацию флуоресценции измеряли на микропланшетном ридере Infinite F500 Tecan (Tecan, Австрия) (волна возбуждения 485 нм, эмиссии – 535 нм). За концентрацию тестируемого соединения, при которой наблюдалось 50 % ингибирование связывания Fluormone GS1 (IC50), принимали ту концентрацию соединения, при которой наблюдалось уменьшение поляризации комплекса GR с Fluormone GS1 в 2 раза.
Определение антипролиферативного эффекта. Антипролиферативный эффект определяли путем прямого подсчета живых клеток. Клетки культивировали в 24-луночном планшете в присутствии исследуемых соединений или растворителя (0,1 %-ного этанола или ДМСО) с плотностью посева 50 тыс. клеток в лунке. Для дифференцировки мертвых и живых клеток использовали окрашивание трипановым синим, подсчет клеток проводили через 24 ч после обработки.
Определение уровня апоптоза. Уровень апоптоза определяли с помощью метода проточной цитофлуориметрии после окраски йодистым пропидием (PI), для чего клетки центрифугировали, осадок суспендировали в 1 мл раствора, содержавшего 5 мкг/мл PI, 0,1 % цитрата натрия и 0,3% NP-40. Полученные образцы анализировали на проточном цитофлуориметре FACSCalibur.
Статистическая обработка данных. Все эксперименты были повторены трижды. Средние значения и среднеквадратичное отклонение рассчитывали с помощью пакета программ MicrosoftExcel и сравнивали с парным двухвыборочным t-тестом Стьюдента для средних. Во всех случаях статистические критерии считали достоверными при Р<0,05.
Результаты исследования и их обсуждение
Химическое производное CpdA-01 (аналог Синефрина) является более стабильным и инертным соединением, не способным образовывать производное азиридина из-за отсутствия протона при атоме азота. Выбор стратегии синтеза (введение циклического вторичного амина взамен первичного амина) был обусловлен двумя факторами: первый из них, как было отмечено выше, связан с необходимостью исключить возможности образования азиридина [10]. Вторая причина обусловлена тем, что CpdA при гидролизе легко может давать производное Синефрина, обладающее собственным противоопухолевым эффектом.
Анализ связывания CpdA-01 с глюкокортикоидным рецептором
При исследовании связывания CpdA-01 было показано, что концентрация, при которой наблюдалось уменьшение поляризации комплекса GR с флуоресцентно-меченым лигандом Fluormone GS1 в 2 раза относительно максимума (825 mP), составило1,1 мкМ. Концентрации лигандов GR, CpdA и Dex, при которых наблюдалось 50 % ингибирование связывания Fluormone GS1, составили 0,52 мкМ и 0,67 мкМ. Таким образом, было показано, что CpdA-01 является лигандом GR и связывается с GR с аффинностью, сходной с CpdA и Dex.
Оценка противоопухолевого эффекта CpdA-01 in vitro
Антипролиферативные и проапоптотические эффекты препарата на клетки линии конкретной нозологической формы злокачественного новообразования в настоящее время определяют как противоопухолевое действие препарата in vitro. Нами были исследованы способность CpdA-01 подавлять пролиферацию клеток гемобластозов, а также индуцировать апоптоз. При изучении биологических эффектов CpdA-01 в первую очередь нами был проведен подбор его оптимальных концентраций для обработки клеток. Соединение исследовали в диапазоне концентраций 1 нм – 1мМ. Было показано, что рабочие концентрации CpdA-01 лежат в диапазоне 1–5 мкМ, что сравнимо с рабочей концентрацией дексаметазона и CpdA. В дальнейших экспериментах были использованы Dex, CpdA и CpdA-01 в концентрациях 1 мкМ. При определении антипролиферативного эффекта CpdA-01 было показано, это соединение обладает способностью подавлять пролиферацию клеток на уровне, сравнимом с Dexи CpdA. При инкубации клеток GrantacCpdA-01 в концентрации 1 мкМ доля жизнеспособных клеток составила 63,7±15,8 % после 24 ч, что сравнимо с 67,8±8,4 % живых клеток после обработки CpdA и 63,7±9,4 % – после инкубации с Dex (рис. 2), и согласуется с результатами предыдущих исследований [1, 6]. При исследовании клеток СЕМ число живых клеток после инкубации с CpdA-01 составил 65,4±3,7 % (рис. 3). Наблюдаемые для CpdA-01 эффекты были GR-зависимыми, поскольку данное соединение вызывало гибель клеток, в которым экспрессия GR была подавлена (Granta-shGR и СЕМ-shGR, рис. 2 и 3), в количестве, статистически незначимо отличимом от контроля.
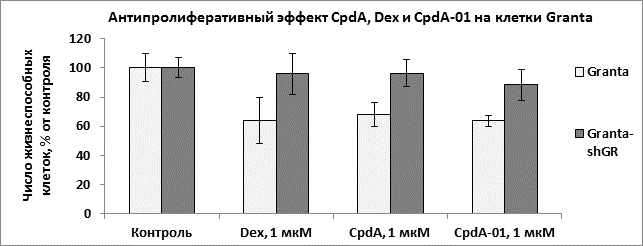
Рис. 2. Антипролиферативный эффект CpdA-01, CpdA и Dex на клетки Granta
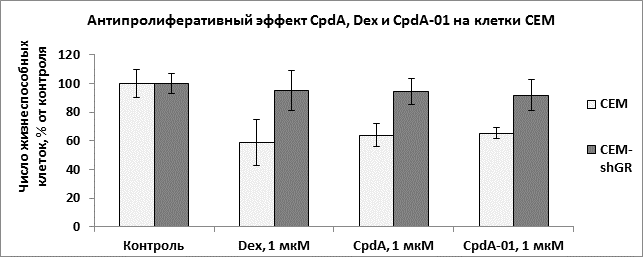
Рис. 3. Антипролиферативный эффект CpdA-01, CpdA и Dex на клетки СЕМ
Индукция апоптоза после обработки CpdA-01 наблюдалась в обеих клеточных линиях (табл. 1) и была сопоставима с уровнем апоптоза в данных клетках после обработки дексаметазоном и CpdA.
Таблица 1
Проапоптотический эффект энантиомеров CpdA в клетках СЕМ и Granta
|
Соединение, концентрация, время обработки |
% апоптотических клеток, клетки Granta |
% апоптотических клеток, клетки СЕМ |
|
Контроль, 48 ч |
3,5±0,6 |
6,7±1,4 |
|
Dex, 1 мкМ, 48 ч |
18,9±3,7 |
19,4±4,3 |
|
CpdA, 1 мкМ, 48 ч |
15,4±4,2 |
17,6±3,8 |
|
CpdA-01, 1 мкМ, 48 ч |
13,7±3,9 |
18,2±4,4 |
Таким образом, можно сделать вывод о том, что антипролиферативный эффект CpdA-01 связан с запуском апоптоза, причем CpdA-01 обладает эффектом на пролиферацию клеток лейкоза и лимфомы, сравнимым с эффектами исходной молекулы CpdA и Dex.
Заключение
В ходе данной работы было показано, что в клетках гемобластозов СЕМ и Granta производное CpdA-01 проявляет GR-зависимый антипролиферативный эффект, связанный с индукцией апоптоза в данных клетках. Таким образом, CpdA-01 является перспективным кандидатом для дальнейших исследований.
Работа выполнена при частичной поддержке грантов РФФИ №15-04-04006, 15-04-09216, 16-04-01410, а также гранта фонда Династия.
Библиографическая ссылка
Тилова Л.Р., Савинкова А.В., Бочаров А.К., Кузин К.А., Борисова О.И., Жидкова Е.М., Кирсанов К.И., Белицкий Г.А., Якубовская М.Г., Яминова Л.В., Ширинян В.З., Лесовая Е.А. СИНТЕЗ НОВОГО СЕЛЕКТИВНОГО АГОНИСТА ГЛЮКОКОРТИКОИДНОГО РЕЦЕПТОРА И ОЦЕНКА ЕГО ПРОТИВООПУХОЛЕВОЙ АКТИВНОСТИ НА МОДЕЛИ ГЕМОБЛАСТОЗОВ IN VITRO // Современные проблемы науки и образования. 2016. № 6. ;URL: https://science-education.ru/ru/article/view?id=25648 (дата обращения: 06.02.2026).



