Приоритетом научных изысканий в регенеративной медицине является формирование тканеинженерных конструкций, способных в короткие сроки восстановить дефекты костной ткани. Непременными условиями, предъявляемыми к подобным конструкциям, является биосовместимость, иммунотолерантность и возможность формирования костной ткани denovo на месте замещенного дефекта [2,3,6,7]. В этой связи вопрос о выборе материала для замещения костного дефекта, близкого к ткани реципиента, остается весьма актуальным.
Формирование регенерата костной ткани в некоторых анатомических областях человека имеет ряд эволюционных особенностей, проявляющихся на стадиях эмбриогенеза. Так, замещение костного дефекта лицевого черепа ограничено особенностями эмбрионального развития этой анатомической области, в которой основой для остеогенеза служат клетки, являющиеся производными нервного гребня. И забор материала для регенерации костной ткани нейрального генеза в этом случае должен производиться из пульпы зуба, периодонтальной связки, зубного фолликула и т.д. [1].
Другой областью, представляющей значительный интерес исследователей, является позвоночник – основа опорно-двигательного аппарата. Действительно повреждения позвоночника относятся к числу наиболее тяжелых травм [2,8]. Нарушение целостности костной ткани, возникающее при переломе тела позвонка, требует реконструктивного хирургического вмешательства и замещения образовавшегося дефекта с помощью имплантации различных материалов [4]. Альтернативой аутотрансплантатам и аллотрансплантатам являются костные имплантаты на основе скаффолдов и трехмерных клеточных конструкций [3].
В Новосибирском НИИТО апробирован в эксперименте трехмерный остеотрансплантат, который был создан путем прямой трансдифференцировки из трехмерного хондротрансплантата (патент RU 2574942). Остеотрансплантат состоит из клеток остеогенного ряда и матрикса, содержащего тканеспецифические белки предкостной ткани, минеральные компоненты в виде матричных пузырьков и кальцификатов, щелочной фосфатазы и сосудистой эндотелиальной выстилки [8]. Подобная структурная композиция остеотрансплантата, по существу, является аналогом эмбриональной костной ткани, что позволяет предполагать возможность использования последней для более широкого спектра регенерации тканей. Тем более что предварительные исследования применения остеотрансплантата для регенерации дефекта нижней челюсти показало подобную возможность.
Цель исследования: изучение регенерации костной ткани разного генеза при замещении её дефектов трехмерным остеотрансплантатом в эксперименте.
Материалы и методы
Исследование выполнено на мини-свиньях с соблюдением положений Хельсинской декларации Всемирной медицинской ассоциации и Правилами проведения работ с использованием экспериментальных животных (утв. приказом Министерства Здравоохранения Российской Федерации от 19.03.2003 г. №226), одобрено локальным этическим комитетом Новосибирского НИИТО.
Основой для создания остеотрансплантатов послужили хондротрансплантаты, изготовленные из культивированных хондробластов, извлеченных в стерильных условиях из позвоночника новорожденного мини-поросенка. Выделение клеток из ткани, культивирование хондробластов, формирование хондротрансплантата осуществляли согласно запатентованным методикам (патенты RU № 2285039 и № 2392973). Направленную остеогенную дифференцировку производили на основе хондротрансплантата при помощи остеоиндуктивной среды на основе RPMI-1640 с 15 % FBS, стрептомицин-пенициллином, амфотерицином В и индукторами остеогенной дифференцировки клеток: 10 мМ/л ß-глицерофосфа, 100 нМ/л дексометазона и 0,2 мМ/л аскорбиновой кислоты, методом, описанном в патенте (патент RU № 2574942).
Эксперимент по регенерации дефекта костной ткани тела позвонка остеотрансплантатом осуществляли на мини-свиньях (возраст 6 месяцев). Под общим наркозом выполняли передний забрюшинный доступ к телам поясничных позвонков. При помощи бора формировали костный дефект в вентральном отделе тела позвонка размерами в глубину и ширину соответствующий размерам трансплантата (около 5 мм). В сформированный дефект укладывали с плотным прилеганием к материнскому ложу трехмерный остеотрансплантат. В качестве контроля использовали незаполненный, сформированный при помощи бора стандартный костный дефект в теле позвонка [8]. Животных выводили из эксперимента через 1 и 3 месяца. Фиксацию, проводку материалов и изготовление морфологических препаратов проводили по традиционной методике. Препараты окрашивали гематоксилин-эозином по Ван-Гизону.
Эксперимент по регенерации дефекта нижней челюсти выполняли на 10 самцах крыс линии Wistar, возрастом 1 месяц. Под общим наркозом скальпелем производили разрез 5 мм в проекции угла нижней челюсти. Распатором отслаивали жевательную мышцу, обнажая кость. При помощи твердосплавного шаровидного бора с вестибулярной поверхности ветви нижней челюсти на расстоянии 3 мм выше угла нижней челюсти формировали трепанационное отверстие диаметром 1 мм. Животным I группы дефект заполняли трехмерным остеотрансплантатом диаметром 1,2 мм. За счет трехмерной структуры и упруго эластических свойств остеотрансплантат плотно прилегал к стенкам артифициального дефекта. Замещенный трехмерный остеотрансплантатом дефект закрывали фасцией и жевательной мышцей. 10 животным контрольной группы формировали трепанационное отверстие диаметром 1 мм, и закрывали фасцией и жевательной мышцей, не заполняя дефект. Рану ушивали материалом «Vicryl».
Животных выводили из эксперимента через 1, 3 и 6 месяцев. Визуально оценивали наличие остаточного дефекта и выраженность гипертрофии мягких и костных тканей в области трансплантации. Выделенные препараты фиксировали, декальцинировали, изготавливали парафиновые блоки, окрашивали методом гематоксилин-эозином по Ван Гизону.
Результаты
Эксперимент по регенерации дефекта костной ткани тела позвонка мини-поросенка
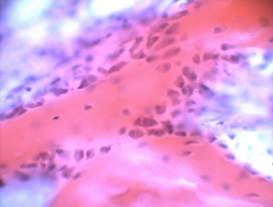
Через месяц после пересадки остеотрансплантата зона дефекта полностью замещена сформированной грубоволокнистой костной тканью (Рис. 1А).
 А
А 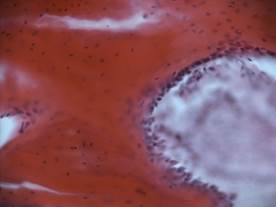 Б
Б
 В
В 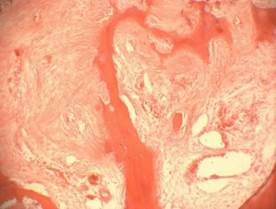 Г
Г
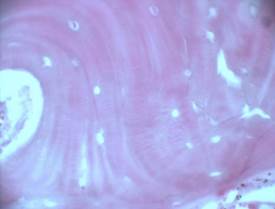
Рис.1. Зона дефекта костной ткани тела позвонка мини-поросенка, заполненная остеотрансплантатом: А – через 1 месяц после трансплантации; Б – через 3 месяца после трансплантации; В – через 6 месяцев после трансплантации; Г – контрольная серия через 6 месяцев (пояснения в тексте); гематоксилин-эозин, ув. 200
Костные балки широкие, нерегулярного строения, с большим количеством хаотично расположенных остеобластов, линии склеивания отсутствуют. По краям балок большое скопление активно синтезирующих клеток, которые располагаются несколькими рядами. Среди остеобластов встречаются преостеобласты – клетки треугольной формы с округлым базофильным, эксцентрично расположенным ядром и интенсивно базофильной, альциан-позитивной цитоплазмой. Между костными балками выявляется преостеогенная ткань с большим количеством клеток, комитированных к остеогенезу, и кровеносных сосудов; встречаются участки гемопоэтической ткани с небольшими включениями жировых клеток.
В контрольной серии через 1 месяц в зоне дефекта сформирована соединительная ткань.
Через 3 месяца в области пластического замещения остеотрансплантатом сформирована костная ткань пластинчатого строения, заполнившая все пространство бывшего дефекта (Рис. 1Б). Регенерат представлен костными балками, находящимися в состоянии перестройки. Между костными структурами располагается гемопоэтическая ткань и сосуды.
В контрольной серии через 3 месяца в зоне дефекта сформирована грубоволокнистая фиброзная ткань с редкими сосудами и нерегулярными фрагментами костных структур.
Через 6 месяцев область бывшего дефекта тела позвонка полностью замещена органоспецифической костной тканью (Рис. 1В). Границы имплантации нивелированы.
В контрольной серии через 6 месяцев зона дефекта замещена грубоволокнистой фиброзной тканью с редкими сосудами и фрагментами костных структур (Рис. 1Г).
Эксперимент по регенерации дефекта нижней челюсти крысы
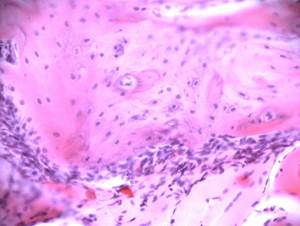
Через 1 месяц эксперимента в зоне трансплантации сформирована примитивная костная ткань балочного строения (Рис.2А). Между балками располагается костный мозг и сосуды, заполненные эритроцитами. Костные балки имеют мозаичное строение. Участки более зрелой костной ткани с регулярным расположением остеобластов и линиями склеивания чередуются с зонами примитивной костной ткани. Остеобласты располагаются нерегулярно, матрикс гомогенный, линии склеивания отсутствуют. Костные структуры окружены цепочками остеобластов. Активный процесс остеогенеза продолжается.
Через 3 месяца эксперимента зона трансплантации заполнена костной тканью балочного строения (Рис. 2Б). В некоторых участках процесс трансформации в органоспецифическую костную ткань все еще не завершен. Участки примитивной костной ткани располагаются среди зрелых структур. Процесс остеогенеза еще не закончен. Вокруг костных балок располагаются активные остеобласты. Между костными структурами сформированы очаги костного мозга.
 А
А 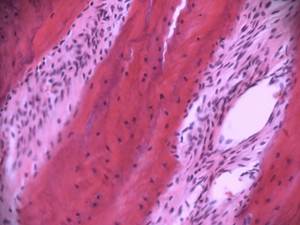 Б
Б
 В
В 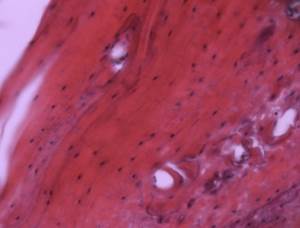 Г
Г
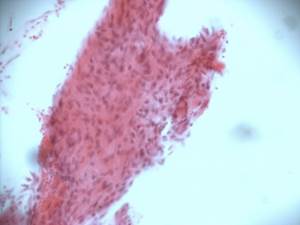
Рис.2. Зона дефекта нижней челюсти крысы, заполненная остеотрансплантатом:
А – через 1 месяц после трансплантации;Б – через 3 месяца после трансплантации;
В – через 6 месяцев после трансплантации; Г – контрольная серия через 6 месяцев
(пояснения в тексте); гематоксилин-эозин, ув. 200
Через 6 месяцев эксперимента в области пластического замещения дефекта остеотрансплантатом образовался единый костный массив (Рис. 2В). Зона трансплантации слилась с материнским ложем, границы бывшего дефекта установить невозможно. В центре сформированной костной ткани происходит процесс ремоделирования в пластинчатую костную ткань, органоспецифичную для нижней челюсти.
В контрольной серии через 6 месяцев артифициальная полость заполнена соединительнотканным регенератом плотноклеточной структуры (Рис. 2Г). Процесс костеобразования отсутствует.
Обсуждение
Процесс регенерации дефекта костной ткани различного генеза происходит в два этапа: 1) формирование первичной костной ткани на основе остеотрансплантата; 2) формирование органоспецифической костной ткани в соответствии с биомеханическими потребностями органа.
Первичный костный регенерат образуется за счет инвазии сосудов из материнского ложа дефекта, в соответствии с общебиологическими закономерностями эмбрионального остеогенеза. Сформированная вокруг сосудов костная ткань обеспечивает устойчивость к нагрузке.
Вторым этапом происходит перестройка первичной костной ткани в органоспецифическую костную ткань. Особенностью регенерации костной ткани на основе остеотрансплантата является ангиогенный тип остеогенеза, который обеспечивается структурными компонентами пластического материала: клетки остеобластического ряда, синтезируют углеводные, белковые и минеральные компоненты матрикса, сосудистые полости с эндотелиальной выстилкой, нарабатывающие факторы роста, инициируют васкуляризацию регенерата и остеогенез. Сформированный in vitro трансплантат, представляет собой остеогенную ткань, которая позволяет восстановить дефект костной ткани в короткие сроки.
Одной из уникальных особенностей трансплантата является его иммунотолерантность. Как видно из фактических данных, процесс интеграции остеотрансплантата в дефекты: нижней челюсти (производное нервного гребня) и тело позвонка (производное мезенхимы) происходит однотипно. Вместе с тем пластическое замещение дефекта нижней челюсти хондротрансплантатом вызвало формирование гранулемы (Зайдман А.М., неопубликованные данные). Процесс несовместимости хондротрансплантата и объекта пластического замещения вполне объясним – энхондральный остеогенез не свойственен нижней челюсти. Остеотрансплантат, полученный путем прямой трансдифференцировки на основе хондротрансплантата, оказался иммунотолерантным. Об этом свидетельствует отсутствие реакции регионарных лимфатических узлов при пересадке остеотрансплантата в костную ткань нижней челюсти крысы [5]. Данный феномен нуждается в дальнейших исследованиях. В настоящее время можно предположить несколько объяснений: 1) эмбриональные остеогенные клетки трансплантата лишены рецепторов к антигенам; 2) отсутствие гемопоэтической ткани в остеотрансплантате обеспечивает иммунотолераность; 3) при пересадке остеотрансплантата проходит быстрая реакция формирования собственных клеток, взамен клеток трансплантата (что является наиболее вероятным).
Выводы
Остеотрансплантат, полученный путем прямой трансдифференцировки из хондротрансплантата в остеогенной среде, обладает высокими регенераторными потенциями и иммунотолерантностью.
Регенерация костной ткани на основе остеотрансплантата независимо от его гистогенеза происходит путем первичного остеогенеза.
Причины иммунотолерантности остеотрансплантата подлежат дальнейшему более глубокому исследованию.
Библиографическая ссылка
Зайдман А.М., Косарева О.С., Щелкунова Е.И., Корель А.В., Сухих А.В., Строкова Е.Л., Иванова Н.А., Рерих В.В., Предеин Ю.А., Ластевский Д.А., Агеева Т.А., Гусев А.Ф. ЭКСПЕРИМЕНТАЛЬНОЕ ОБОСНОВАНИЕ ПРИМЕНЕНИЯ ТРЕХМЕРНОГО ОСТЕОТРАНСПЛАНТАТА ДЛЯ РЕГЕНЕРАЦИИ КОСТНОЙ ТКАНИ РАЗЛИЧНОЙ ЛОКАЛИЗАЦИИ И ГИСТОГЕНЕЗА // Современные проблемы науки и образования. 2016. № 6. ;URL: https://science-education.ru/ru/article/view?id=25582 (дата обращения: 23.12.2025).



