Изучение структурных основ и молекулярных механизмов регенерации миокарда, в том числе его основной клеточной популяции – кардиомиоцитов, после повреждающих воздействий остается одной из важнейших задач современной регенераторной медицины. Значительные ограничения пролиферативной активности и, как следствие, клеточных форм регенерации кардиомиоцитов у взрослых млекопитающих обусловливают недостаточность тканеспецифической регенерации миокарда при массивных очаговых или диффузных повреждениях [3]. С учетом этих обстоятельств особо актуальным является установление сигнальных путей и каскадов внутриклеточных реакций, обеспечивающих выживание кардиомиоцитов, их физиологическую регенерацию и возможное вступление в клеточный цикл нетерминально дифференцированных клеток.
В последнее время появляются данные о том, что cосудистый эндотелиальный фактор роста (VEGF), являющийся сильным митогеном для эндотелиальных клеток, может выполнять функции фактора выживания для других клеток и тканей [7; 8]. Экспрессия Flk-1 наблюдается не только в эндотелиальных клетках, но и в кардиомиоцитах [6; 10; 15]. Более того, показано, что сами кардиомиоциты под действием внешних стрессирующих факторов, например гипоксии, способны вырабатывать VEGF и секретировать его во внешнюю среду [14]. Воздействие VEGF повышает жизнеспособность эндотелиальных клеток и кардиомиоцитов, подавляя активность проапоптотических белков [11].
VEGF оказывает свои клеточные эффекты, взаимодействуя с рецепторами с тирозинкиназной активностью, главным образом с VEGFR-1 (Flt-1; fms-like tyrosine kinase) и VEGFR-2 (Flk-1; fetal liver kinase). Установлено, что широкий спектр клеточных реакций на VEGF реализуется преимущественно через взаимодействие с Flk-1. В частности, начинается более интенсивное деление и миграция эндотелиальных клеток, повышается их проницаемость. Рецепторы Flt-1 не способны обеспечивать перечисленные биологические реакции эндотелиальной клетки, но они могут связывать избыток VEGF, циркулирующего в плазме крови, и контролировать его воздействие на сосуды. Реализация эффектов VEGF в кардиомиоцитах опосредуется через внутриклеточный сигнальный путь PI3K/Akt, играющий центральную роль в регуляции роста, дифференцировки и выживания клеток [4; 12].
Следует отметить, что, несмотря на значительное внимание исследователей к роли VEGF при ишемии сердца, прямое действие VEGF на кардиомиоциты в этих и других патологических условиях изучено мало. Имеющиеся данные получены, главным образом, на клеточных культурах неонатальных сердечных миоцитов [9]. В то же время является актуальным изучение и предотвращение негативных последствий химиотерапии [2], связанных с блокадой проведения сигнала через Flk-1 в сердце.
Цель работы – с помощью иммуногистохимического метода оценить экспрессию Flk-1 в миокарде экспериментальных животных при воспроизведении антрациклиновой кардиомиопатии.
Материал и методы исследования
Антрациклиновую кардиомиопатию воспроизводили у крыс-самцов Вистар (n=28), которым однократно внутрибрюшинно вводили доксорубицина гидрохлорид («Фармахеми Б.В.», Нидерланды) в дозе 7 мг/кг в растворе 0,9% NaCl. Контрольным животным (n=5) одновременно с опытными внутрибрюшинно однократно вводили физиологический раствор в объеме, соответствующем их массе тела. Всех животных содержали в стандартных условиях вивария на полноценном рационе, вода ad libitum. Эксперименты проведены с соблюдением всех правил и рекомендаций Европейской конвенции по защите позвоночных животных, используемых в экспериментальных работах.
Животных выводили из эксперимента декапитацией в первой половине дня через 3 и 14 сут. после введения доксорубицина. После вскрытия и взвешивания сердца образцы миокарда фиксировали в 10%-ном растворе нейтрального формалина, обрабатывали по стандартной методике для заливки в парафин. Парафиновые срезы окрашивали гематоксилином и эозином с постановкой реакции Перлса, по методу ван Гизона с докраской эластических волокон резорцин-фуксином Вейгерта, ставили PAS-реакцию.
С помощью метода иммуногистохимии оценивали экспрессию рецептора вазоэндотелиального фактора роста-2 – KDR/Flk-1 (использовали кроличьи поликлональные антитела E3712 в разведении 1:50, Spring Bioscience, USA). В качестве хромогена использовали 3,3’-диаминобензидин (ДАБ), докрашивали гематоксилином.
Исследования срезов проводили в универсальном микроскопе «Leica DM 4000B». С помощью компьютерной программы «Leica QWin V3» проводили подсчет Flk-1-позитивных кардиомиоцитов при увеличении в 400 раз (тестовая площадь 61171,56 мкм2). Для каждого животного подсчет кардиомиоцитов проводили в 15 непересекающихся тестовых площадях. Затем вычисляли индекс Flk-1-позитивных кардиомиоцитов.
Статистическую обработку проводили с использованием критерия Стьюдента, различия считали достоверными при p<0,05.
Результаты исследования и их обсуждение
В миокарде контрольных животных экспрессия Flk-1 выявлялась в отдельных кардиомиоцитах, при этом интенсивность окраски была умеренной (рис. 1а). Индекс Flk-1-позитивных кардиомиоцитов в миокарде контрольных животных составил 13,58±1,45%. В кардиомиоцитах экспрессия Flk-1 регистрировалась в основном в миофибриллярных пучках. Кроме мышечных клеток сердца Flk-1 выявлялась в эндотелиоцитах и гладкомышечных клетках интрамуральных артерий и вен, а также в эндотелиоцитах капилляров (рис. 1б). В гладкомышечных клетках следует отметить неравномерный характер распределения продукта реакции по цитоплазме.
Однократное введение доксорубицина крысам Вистар обусловливало появление во всех слоях миокарда через 3 сут. эксперимента литически измененных кардиомиоцитов, которые мы считаем морфологическим эквивалентом развивающейся регенераторно-пластической недостаточности миокарда. Кардиомиоциты с контрактурными повреждениями миофибрилл (преимущественно I – II степеней) были единичными. Следует отметить умеренную липидную инфильтрацию кардиомиоцитов, которая, вероятно, отражала изменения метаболизма липидов в кардиомиоцитах в результате дислипидемического эффекта доксорубицина, который был описан нами ранее [1]. Нарушения гемодинамики при антрациклиновой кардиомиопатии проявлялись в выраженном венозном и капиллярном полнокровии, развивающемся лимфостазе, умеренном периваскулярном и интерстициальном отеке.
а 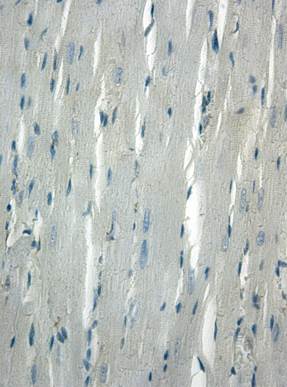 б
б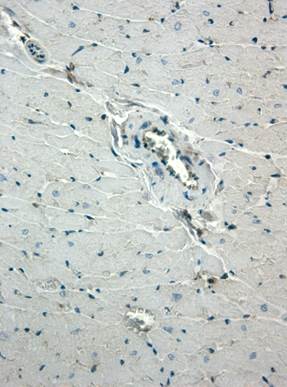
Рис. 1. Иммуногистохимическое выявление Flk-1 в миокарде контрольных животных. Ув. 400
а – отсутствие экспрессии Flk-1 в кардиомиоцитах; б – умеренная экспрессия Flk-1 в эндотелиоцитах интрамуральной артерии
В этот срок эксперимента значительно усиливалась интенсивность окрашивания кардиомиоцитов при постановке иммуногистохимической реакции с антителами в Flk-1. Практически все кардиомиоциты экспрессировали Flk-1, индекс окрашенных клеток составлял в этот срок 94,32±0,76% (p<0,001 при сравнении с контролем). В миокарде присутствовали как равномерно, так и неравномерно окрашенные участки (рис. 2). Особо следует отметить отсутствие окрашивания так называемых малых кардиомиоцитов (рис. 2б), которые располагались небольшими кластерами в среднем слое миокарда, чаще вблизи верхушки сердца. Кроме кардиомиоцитов, экспрессия Flk-1 выявлялась также в эндотелиоцитах и гладкомышечных клетках кровеносных сосудов. В этот срок эксперимента периваскулярно и в интерстиции появлялись интенсивно окрашенные соединительнотканные клетки (макрофаги и фибробласты).
а  б
б 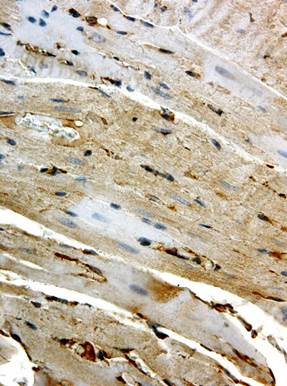
Рис. 2. Иммуногистохимическое выявление Flk-1 в миокарде крыс через 3 сут. после однократного введения доксорубицина. Ув. 400
а – интенсивная равномерная окраска кардиомиоцитов; б – мозаичность окрашивания, отсутствие экспрессии Flk-1 в «малых» кардиомиоцитах
Через 14 сут. после введения доксорубицина в кардиомиоцитах нарастали литические изменения, что отражало усиление регенераторно-пластической сердечной недостаточности. Одновременно регистрировались участки миокарда со значительными контрактурными повреждениями кардиомиоцитов, преимущественно сегментными. При этом в отдельных кардиомиоцитах различались субсегментарные контрактуры. Сохранялись нарушения гемодинамики, отмечалась умеренная диффузная мононуклеарная инфильтрация стромы. Индекс Flk-1-позитивных кардиомиоцитов существенно не менялся по сравнению с предыдущим сроком и составлял 91,14±1,56% (p<0,001 при сравнении с контролем). Следует отметить выраженную неравномерность экспрессии Flk-1 в кардиомиоцитах (рис. 3): в одних кардиомиоцитах окрашивание было интенсивным, в других – умеренным, в отдельных клетках (с выраженными контрактурными изменениями и в «малых» кардиомиоцитах) оно отсутствовало (рис. 3б). Кроме кардиомиоцитов, Flk-1 экспрессировалась в соединительнотканных клетках, при этом интенсивность их окрашивания была высокой.
а 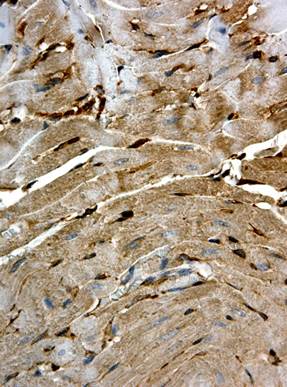 б
б 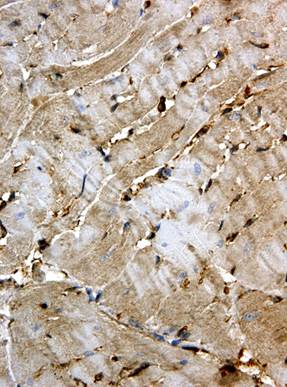
Рис. 3. Иммуногистохимическое выявление Flk-1 в миокарде крыс через 14 сут. после однократного введения доксорубицина. Ув. 400
а – интенсивная неравномерная окраска кардиомиоцитов; б – мозаичность окрашивания, отсутствие экспрессии Flk-1 в полосах сокращения
Значительное увеличение экспрессии Flk-1 в кардиомиоцитах после однократного введения доксорубицина может отражать стимуляцию цитопротекторных реакций через усиление экспрессии генов, ответственных за дифференцировку. Известно, что добавление VEGF к культивируемым мышиным эмбриональным стволовым клеткам активирует дифференцировку кардиомиоцитов через активацию рецепторов Flk-1 и Flt-1, которые, в свою очередь, способствуют усилению экспрессии кардиоспецифических – белков α-MHC, cTn-I, коннексина-43 и транскрипционного фактора Nkx2.5 [5]. Установлено также, что экспрессия Flk-1и Flt-1 значительно усиливается в дифференцирующихся эмбриональных стволовых клетках по сравнению с недифференцирующимися.
При использовании ингибиторов Flk-1 (например, бевацизумаба, ранибизумаба), подавляющих ангиогенез в опухолях и эффективных при лечении некоторых видов рака (например, почечно-клеточного рака, саркомы мягких тканей и гепатоклеточной карциномы), выявлена блокада распространения сигналов через Flk-1 в разных тканях, что впоследствии может быть причиной развития застойной сердечной недостаточности, гипертонической болезни и других патологий [13].
Показано, что VEGF значительно усиливает фосфорилирование ERK, но не JNK [5]. Применение специфического для ERK ингибитора PD-098059, в отличие от специфического для JNK ингибитора SP-600125, приводит к подавлению VEGF-индуцированной дифференцировки кардиомиоцитов из эмбриональных стволовых клеток, т.е. VEGF влияет на дифференцировку кардиомиоцитов через ERK-сигнальные пути.
Развитие антрациклиновой кардиомиопатии (в частности, доксорубицин-индуцированной кардиомиопатии) в значительной степени опосредовано усилением генерации активных форм кислорода и, как следствие, связано с повреждением структурных белков и мембран кардиомиоцитов. Показано, что добавление VEGF (100 нг/мл) в культуру неонатальных кардиомиоцитов заметно снижает их Н2О2-индуцированную гибель [9]. В этом же исследовании показано, что фосфорилирование Akt осуществляется в дозозависимой манере и не связано с изменением общего содержания Akt. Выявленное в нашем исследовании увеличение индекса Flk-1-позитивных кардиомиоцитов при воспроизведении антрациклиновой кардиомиопатии может свидетельствовать о стимулировании цитопротекторных реакций в кардиомиоцитах путем усиления экспрессии Flk-1.
Таким образом, по данным иммуногистохимического исследования, развитие антрациклиновой кардиомиопатии сопровождается усилением экспрессии KDR/Flk-1 в кардиомиоцитах (индекс Flk-1-позитивных кардиомиоцитов возрастает в 7 раз по сравнению с контролем). Выявленное усиление экспрессии Flk-1 в кардиомиоцитах может быть активацией цитопротекторных реакций в ответ на повреждающее действие доксорубицина.
Библиографическая ссылка
Колдышева Е.В., Клинникова М.Г., Ивлева Е.К., Листвягова Н.А., Лушникова Е.Л. ЭКСПРЕССИЯ KDR/FLK-1 (VEGFR2) В МИОКАРДЕ ПРИ МОДЕЛИРОВАНИИ АНТРАЦИКЛИНОВОЙ КАРДИОМИОПАТИИ // Современные проблемы науки и образования. 2016. № 6. ;URL: https://science-education.ru/ru/article/view?id=25577 (дата обращения: 13.03.2026).
DOI: https://doi.org/10.17513/spno.25577



