Введение:Протоковая аденокарцинома поджелудочной железы (ПАКПЖ) является самым распространенным типом злокачественных опухолей поджелудочной железы (ПЖ) и отличается крайне неблагоприятным прогнозом. 5-летняя выживаемость пациентов с ПАКПЖ не превышает 8%, что связано как с высокой агрессивностью опухоли (быстрая прогрессия, раннее метастазирование), так и с низкой эффективностью современных методов диагностики и терапии (позднее диагностирование из-за отсутствия явных симптомов, отсутствие специфических биомаркеров, устойчивость к химиотерапии) [2].
ПАКПЖ возникает из протоковых клеток поджелудочной железы, которые способны к контролируемой дедифференцировке с последующей пролиферацией и транс-дифференцировкой в другие типы панкреатических клеток, что необходимо для регенерации в случае повреждения органа [5]. Нарушения регуляции дифференцировки протоковых клеток могут привести к их опухолевой трансформации и развитию ПАКПЖ. Дифференцировка клеток ПЖ контролируется рядом тканеспецифических транскрипционных факторов (ТФ), наиболее значимыми из которых являются PDX1, PTF1A и белки группы гепатоцитарных ядерных факторов (HNF), состоящей из пяти семейств: HNF1, FOXA, HNF4, ONECUT и C/EBP [1; 14]. Эти ТФ способны к взаимной регуляции, в результате чего образуется комплексная сеть, контролирующая транскрипцию тканеспецифических генов. Фактор HNF4α является одним из центральных регуляторов этой сети. В норме он контролирует развитие и дифференцировку печени, поджелудочной железы и кишечника; его экспрессия характерна также для эпителия почки, желудка и семенников [1; 12]. Транскрипция гена HNF4A контролируется независимо регулируемыми промоторами P1 и P2, определяющими экспрессию двух групп изоформ (HNF4αP1 – изоформы α1-α6, HNF4αP2 – изоформы α7-α12) [1; 13]. Эти группы обладают разными трансактивационными свойствами, а спектры их экспрессии характеризуются тканеспецифичностью. В нормальной поджелудочной железе преобладает экспрессия изоформ HNF4αP2 [12].
В большинстве тканей, для которых характерна экспрессия HNF4α, он играет роль опухолевого супрессора. Подавление экспрессии HNF4α является ключевым событием в прогрессии гепатоцеллюлярной карциномы, а его экзогенная реэкспрессия приводит к реверсии злокачественного фенотипа этой опухоли [9]. HNF4α оказывает антипролиферативное действие на эпителиальные клетки кишечника и почки [6; 10]. Общий уровень экспрессии HNF4α повышен в панкреатических неоплазиях (предопухолевых образованиях ПЖ) и падает в ткани низкодифференцированной ПАКПЖ [8], однако изменения экспрессии изоформ HNF4α в ПАКПЖ и его влияние на свойства и прогрессию этого типа опухолей на сегодняшний день практически не изучены. Ранее нами было показано, что экзогенная экспрессия HNF4α вызывает частичную редифференцировку низкодифференцированных клеток ПАКПЖ и снижает их злокачественный потенциал, в то время как подавление его синтеза в высокодифференцированных клетках приводит к усилению выраженности злокачественного фенотипа [3; 4]. Эти результаты позволили нам выдвинуть предположение о том, что HNF4α в клетках ПАКПЖ является опухолевым супрессором.
В данной работе исследовались эффекты, вызванные подавлением экспрессии HNF4α в умереннодифференцированных клетках ПАКПЖ AsPC1. Мы продемонстрировали, что такое подавление может приводить к разнонаправленным изменениям, свидетельствующим о наличии у HNF4α как опухолесупрессорных, так и не описанных ранее проопухолевых функций.
Материалы и методы
Клеточные линии
В работе использовали линию протоковой аденокарциномы поджелудочной железы человека AsPC1 (Российская коллекция клеточных культур позвоночных НИИ Цитологии РАН, Россия). Для упаковки лентивирусных конструкций была использована линия пакующих клеток HEK293Т (Invitrogen, США).
Клетки обеих линий культивировали в среде RPMI-1640 (Gibco, США) с добавлением 10% фетальной телячьей сыворотки (Biological Industries, Израиль), 300 мг/л глутамина («ПанЭко», Россия) и 10 мг/л антибиотика ципрофлоксацина. Культивирование проводили в атмосфере 5% СО2 при температуре 37 °С. Приблизительно раз в 3-5 дней клетки обрабатывали трипсином и пересевали.
Плазмидные векторы
В работе был использован набор из пяти плазмид на основе лентивирусного вектора pLKO-1 серии «MISSION shRNA Plasmid DNA» SHDNA-NM_000457, а также контрольный вектор pLKO-1 (Sigma, США). Векторы MISSION кодировали пять вариантов малых шпилечных РНК (мшРНК), комплементарных последовательности мРНК HNF4α. Все использованные плазмиды экспрессировали ген устойчивости к пуромицину. Для упаковки вирусных частиц использовали систему ViraPower (Invitrogen, США), включающую векторы pLP1, pLP2 и pCMV-VSVg.
Лентивирусная инфекция клеток
Трансфекцию клеток HEK293T векторами pLP1, pLP2, pCMV-VSVg и одним из векторов MISSION проводили при помощи стандартного кальций-фосфатного метода. Собранную на третий день культуральную среду с вирусом фильтровали через 0,45-мкм фильтр и инкубировали в ней клетки AsPC1. Через 48 часов в культуральную среду добавляли антибиотик пуромицин (2 мкг/мл) и проводили селекцию в течение 8 дней.
ОТ-ПЦР-анализ уровней экспрессии генов
Суммарную РНК выделяли из клеток при помощи набора RNeasy Plus Mini Kit (Qiagen, Германия) согласно протоколу производителя. Обратную транскрипцию проводили с использованием случайных гексамерных олигонуклеотидов («Синтол», Россия) и обратной транскриптазы MMLV-RT (Promega, США).
Для определения уровней экспрессии генов применяли методы полуколичественного и количественного ПЦР. Список исследованных генов, последовательности использованных для ПЦР праймеров («Синтол», Россия) и оптимизированные температуры отжига праймеров приведены в таблице. Для нормализации результатов ПЦР-анализа использовали уровень экспрессии гена циклофилина А (PPIA). Для полуколичественного ПЦР-анализа использовали набор реактивов для ПЦР («Силекс», Россия) и амплификатор T3 Thermocycler (Biometra, Германия), ПЦР-продукты анализировали с помощью электрофореза в 2%-ном агарозном геле, для детекции результатов электрофореза использовали систему фотодокументации гелей Doc-It LS Imaging System (UVP, Германия). Для количественного ПЦР-анализа использовали набор реагентов для ПЦР-РВ в присутствии красителя SYBR Green I («Синтол», Россия) и амплификатор Bio-Rad IQ5 (Bio-Rad Laboratories, США). Расчет уровней экспрессии производили с помощью метода градуировочного графика.
Олигонуклеотидные праймеры, использованные в работе
|
Ген |
Последовательность прямого праймера |
Последовательность обратного праймера |
Температура отжига,°C |
|
PPIA |
ACGGGTCCTGGCATCTTGTC |
TGCTGGTCTTGCCATTCCTG |
65 |
|
HNF4ATOT |
ACACGTCCCCATCTGAAG |
CTTCCTTCTTCATGCCAG |
65 |
|
HNF4AP1 |
ATGTGCAGGTGTTGACGATG |
CTCGAGGCACCGTAGTGTTT |
62 |
|
HNF4AP2 |
GGCCATGGTCAGAGTGAA |
CTCGAGGCACCGTAGTGTTT |
62 |
|
PDX1 |
AAAGCTCACGCGTGGAAAGG |
CGGCGGTTTTGGAACCAGAT |
65 |
|
PTF1A |
ctcgtgcctggcctaccc |
ggcgtcgttgatggactgc |
65 |
|
HNF1A |
TCTAAGCTGAGCCAGCTGCAGACG |
GCTGAGGTTCTCCGGCTCTTTCAG |
65 |
|
HNF1B |
gaaagcaacgggagatcctccgac |
cctccactaaggcctccctctcttcc |
65 |
|
FOXA1 |
ggcctactcctctgtccctgtcag |
gccgcagtcatgctgttcat |
65 |
|
FOXA2 |
agccccaacaagatgctgacg |
gggtgcagggtccagaaggag |
67 |
|
ONECUT1 |
caggggaccctctcggacct |
gggctttttgggtgtgttgcctc |
65 |
|
ONECUT2 |
atgccggtctcaggggactctc |
tgcatgctgccaggcgtaag |
68 |
|
HNF4G |
ccgcaacagctgtgaagttg |
tcctccaaaccgatctgcac |
65 |
|
AMY2A |
tggggagaaggttggggttt |
cagacccagtcattgccacaa |
65 |
|
CELA2A |
tggctggagccctcagttgt |
gaccctccgcaggtgtggta |
65 |
|
CDH1 |
CGGAGGAGAGCGGTGGTC |
GGCAGGGCGGGGAAGATA |
65 |
|
CDH2 |
ACCCAGGAAAGGTGGCAGGT |
GCGGGATGACCCAGTCTCT |
65 |
|
CDKN1A |
GCTGTCCCTCCCCCTTGTCT |
TGTTCCGCTGCTAATCAAAAG |
60 |
Иммуноблоттинг
Лизаты клеточных культур получали с помощью буфера RIPA (Roche, Швейцария). Белки разделяли электрофорезом в 10%-ном полиакриаламидном геле и переносили на PVDF-мембрану. Неспецифические сайты связывания блокировали в течение 1 часа 5%-ным раствором обезжиренного сухого молока на PBST. Далее мембрану инкубировали с антителами мыши к глицеральдегидфосфатдегидрогеназе (GAPDH) (ZG003, Invitrogen, США, разведение 1:2000), HNF4αTOT (H1415, R&D Systems, США, разведение 1:4000), HNF4αP1 (K9218, R&D Systems, США, разведение 1:2000) или HNF4αP2 (H6939, R&D Systems, США, разведение 1:700) в течение 1 ч и со вторыми антителами козы к гамма-глобулину мыши (Jackson ImmunoResearch Laboratories Inc., США, разведение 1:3000), конъюгированными с пероксидазой хрена, в течение 1 часа. Для оценки связывания антител с белком использовали систему детекции «ECL+ Plus Western blotting detection system» (Amersham Pharmacia Biotech, США). Интенсивность сигнала детектировали на приборе Chemycapt 3000 (Vilber-Lourmat, Германия) при помощи программы Chemycapt 3000. Интенсивность свечения полос оценивали с помощью программы Total Lab 2.01 (TotalLab Ltd., Великобритания).
Иммунофлюоресцентная окраска клеток
Клетки фиксировали в метаноле при -20 °С в течение 20 минут, инкубировали в растворе антител к HNF4αTOT (H1415, R&D Systems, США, разведение 1:200) на PBS 30 мин, в растворе вторых антител козы к гамма-глобулину мыши, конъюгированных с флюоресцентной меткой AlexaFluor 488 (Invitrogen, США, разведение 1:200) на PBS с добавлением 3мкМ DAPI (Sigma, США) 30 мин, после чего заключали под покровное стекло с помощью эльванола. Для детектирования окрашенных клеток использовали флуоресцентный микроскоп Axioplan 2 и программу Axio vision 4.0 (Carl Zeiss, США).
Определение кинетики роста клеточных культур
В лунки 96-луночного планшета вносили по 1000 клеток и культивировали в течение 4, 24, 48, 72 и 96 ч. Подсчет клеток осуществляли на приборе SpectraMax M5e (Molecular Devices, США) с использованием коммерческого набора CyQUANT NF Cell Proliferation Assay Kit (Invitrogen, США) согласно протоколу производителя. Изменение количества клеток рассчитывали как отношение сигнала после инкубации к сигналу, детектированному через 4 часа после посева клеток.
Оценка интенсивности синтеза ДНК
Для оценки ДНК-синтетической активности клеток использовали тест на включение 5-бромодезоксиуридина (5-BrdU) в ДНК клеток, находящихся в S-фазе клеточного цикла. Клетки в логарифмической фазе роста инкубировали в среде, содержащей 10 мМ 5-BrdU 2 часа. Затем клетки фиксировали метанолом и инкубировали в 1%-ном растворе Triton X-100 на PBS 3 минуты и в 4 н. растворе HCl 10 минут. Блокировку неспецифического связывания антител проводили 3%-ным раствором BSA на PBS, затем окрашивали клетки антителами к 5-BrdU (Zymo Research, США, разведение 1:100), как описано выше. Долю меченых 5-BrdU клеток подсчитывали в нескольких полях зрения, суммарное количество посчитанных клеток в препарате составляло не менее 1000.
Клоногенный тест
В чашки Петри диаметром 3 см вносили 1000 тщательно суспендированных клеток и культивировали 21 сутки. Образовавшиеся колонии фиксировали метанолом, окрашивали кристаллическим фиолетовым 5-10 минут и фотографировали. Для подсчета колоний использовали пакет программ Total Lab 2.01 (TotalLab Ltd., Великобритания).
Тест на направленную миграцию
В верхнее отделение модифицированной камеры-вставки Бойдена для 24-луночных планшетов «BD Falcon Cell Culture Insert» (BD Biosciences, США) с размером пор 8,0 мкм вносили по 10 000 клеток в 200-300 мкл бессывороточной среды RPMI-1640. В качестве хемоаттрактанта использовали 700 мкл среды RPMI-1640 с 5%-ной сывороткой в нижнем отделении камеры. Через 16 ч. клетки с верхней стороны мембраны удаляли, а клетки на нижней стороне окрашивали 2%-ным раствором кристаллического фиолетового в воде и подсчитывали при помощи микроскопа.
Статистическая обработка данных
Все данные были получены не менее чем в трех независимых экспериментах. Для обработки данных использовали программные пакеты Microsoft Office Excel 2003 (Microsoft Corporation, США), Origin Pro 9.0 (OriginLab Corporation, США) и GraphPad Prism 6 (GraphPad Software, USA). Для определения погрешностей вычислений находили стандартное отклонение от среднего значения обрабатываемой величины. Для выявления ошибки определения величин находили стандартное отклонение от среднего значения обрабатываемой величины. Достоверность отличий проверяли с помощью U-теста Манна-Уитни. Достоверными считали изменения, для которых показатель p<0,05.
Результаты
В настоящей работе в качестве модельной системы была использована культура умереннодифференцированных клеток ПАКПЖ AsPC1 [4]. ОТ-ПЦР-анализ показал, что в клетках AsPC1 снижаются уровни экспрессии некоторых регуляторов дифференцировки ПЖ (PDX1, PTF1A, HNF1A, FOXA2) по сравнению с нормальной тканью ПЖ. В то же время экспрессия генов, кодирующих ТФ HNF1B и ONECUT1 и секретируемые ферменты α-амилазу (AMY2A) и эластазу-2А (CELA2A), которые характерны для высокодифференцированных протоковых клеток, в клетках AsPC1 полностью подавлена, что говорит о начавшемся процессе дедифференцировки. В соответствии с ранее опубликованными данными [4], в клетках AsPC1 детектируется экспрессия не только группы изоформ HNF4αP2, но и нехарактерных для нормальной ПЖ изоформ HNF4αP1 (рис. 1А).
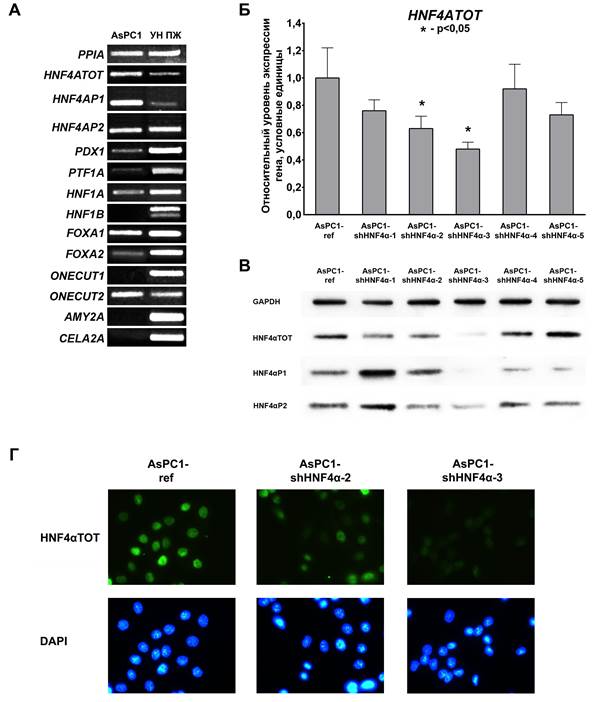
Рис. 1. Подавление синтеза фактора HNF4α в клетках линии AsPC1 с помощью мшРНК
А. Спектр экспрессии панкреаспецифических генов в клетках AsPC1 и условно нормальной ткани ПЖ (УН ПЖ), полуколичественный ОТ-ПЦР-анализ. Б. Уровни экспрессии HNF4α в культурах AsPC1-shHNF4α, количественный ОТ-ПЦР-анализ. В. Уровни синтеза белка HNF4α и групп его изоформ в культурах AsPC1-shHNF4α, иммуноблоттинг. Г. Интенсивность синтеза и локализация белка HNF4α в культурах AsPC1-shHNF4α, экспрессирующих мшРНК к HNF4α, иммунофлюоресцентное окрашивание, увеличение 40х
Для исследования эффектов, вызываемых подавлением экспрессии HNF4α, методом лентивирусной трансдукции были получены 5 культур клеток AsPC1, стабильно экспрессирующих различные варианты мшРНК, комплементарные последовательности мРНК HNF4α (далее AsPC1-shHNF4α). В качестве референсной культуры были использованы клетки AsPC1, трансдуцированные вектором pLKO-1, несущим только ген устойчивости к пуромицину (далее AsPC1-ref). Эффективность подавления экспрессии HNF4α оценивали методом количественного ОТ-ПЦР-анализа с праймерами, амплифицирующими все изоформы HNF4α (HNF4ATOT, рис. 1Б) и методом иммуноблоттинга с антителами, специфичными как ко всем изоформам (HNF4αTOT), так и к отдельным группам изоформ (HNF4αP1 и HNF4αP2, рис. 1В). Для дальнейших экспериментов были использованы контрольная культура AsPC1-ref и культуры AsPC1-shHNF4α-2 и AsPC1-shHNF4α-3, в которых эффективность подавления HNF4α была максимальной. При этом в культуре AsPC1-shHNF4α-2 подавление HNF4α произошло преимущественно за счет снижения уровня изоформ группы HNF4αP2, а в культуре AsPC1-shHNF4α-3 подавлен синтез обеих групп изоформ HNF4α (рис. 1В). Подавление синтеза HNF4α в выбранных культурах было дополнительно подтверждено методом иммунофлюоресцентного окрашивания клеток антителами HNF4αTOT (рис. 1Г).
Чтобы исследовать влияние подавления экспрессии HNF4α на биологические характеристики клеток AsPC1, определяющие их злокачественный потенциал, в экспериментах in vitro были проанализированы скорость роста, ДНК-синтетическая активность, колониеобразующая и миграционная способности выбранных клеточных культур (рис. 2). Основываясь на ранее полученных нами и описанных в литературе данных [3; 4; 6; 9; 10], мы ожидали, что подавление синтеза HNF4α в клетках AsPC1 приведет к приобретению ими более выраженного злокачественного фенотипа. В соответствии с этим предположением клетки AsPC1-shHNF4α демонстрировали существенно большую способностью к направленной миграции, чем контрольная культура AsPC1-ref (рис. 2А). Однако одновременно с повышением миграционного потенциала подавление синтеза HNF4α вызвало значительное снижение скорости роста культур AsPC1-shHNF4α по сравнению с контрольной культурой (рис. 2Б). Доля клеток, находящихся в S-фазе клеточного цикла и активно синтезирующих ДНК, в клетках AsPC1-shHNF4α-2 и AsPC1-shHNF4α-3 снизилась почти вдвое по сравнению с референсной культурой (рис. 2В). Этот результат позволяет предположить, что замедление роста культур AsPC1-shHNF4α вызвано ослаблением пролиферативной активности, связанной с арестом клеточного цикла в фазе G1. Снижение пролиферативной активности клеток AsPC1 при подавлении HNF4α сопровождалось также достоверным ослаблением их способности к формированию колоний в условиях высокого разведения (рис. 2Г). Таким образом, наблюдаемый комплекс эффектов, вызванных подавлением HNF4α, не может быть истолкован как однозначное повышение или понижение злокачественного потенциала клеток, поскольку включает в себя выраженные изменения клеточных свойств, характерные для обоих процессов.
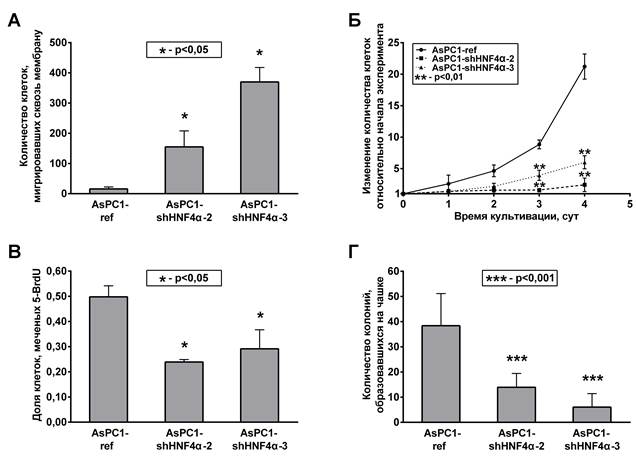
Рис. 2. Изменение биологических характеристик клеток AsPC1 при подавлении синтеза HNF4α
А. Количество клеток, мигрировавших сквозь мембрану камеры Бойдена по градиенту хемоаттрактанта. Б. Кинетические кривые роста клеточных культур в условиях in vitro. В. Доля активно синтезирующих ДНК и включающих 5-BrdU-метку клеток. Г. Количество колоний, образованных клетками в условиях высокого разведения (1000 клеток на чашку Петри диаметром 3 см)
Для того чтобы понять, какие изменения экспрессии генов могут быть связаны с наблюдаемыми изменениями клеточных свойств, в исследуемых культурах методом полуколичественной ОТ-ПЦР были проанализированы уровни экспрессии основных регуляторов дифференцировки ПЖ, генов, активность которых характерна для нормального панкреатического эпителия, и гена CDKN1A, который кодирует регулятор клеточного цикла p21CIP1/WAF1 и является прямой транскрипционной мишенью HNF4α [7]. Подавление синтеза HNF4α в клетках AsPC1 не оказало однонаправленного воздействия на спектр экспрессии панкреаспецифических ТФ, контролирующих дифференцировку клеток. Так, экспрессия генов PDX1, PTF1A и FOXA1 в клетках AsPC1-shHNF4α не изменилась, экспрессия генов HNF1A и HNF4G – снизилась, а гена ONECUT2 – повысилась по сравнению с контрольной культурой. Влияние подавления HNF4α на активность гена FOXA2 в исследованных культурах отличалось – в клетках AsPC1-shHNF4α-2 его экспрессия снизилась, а в клетках AsPC1-shHNF4α-3 – усилилась. Активации генов HNF1B и ONECUT1, экспрессия которых характерна для дифференцированных протоковых клеток ПЖ и полностью подавлена в клетках AsPC1, в культурах AsPC1-shHNF4α не наблюдалось (рис. 3А). Подавление синтеза HNF4α индуцировало экспрессию панкреатической α-амилазы (AMY2A), но не эластазы-2А (CELA2A), в то время как в нормальной панкреатической ткани экспрессируются оба этих фермента (рис. 1А, 3Б). В клетках AsPC1-shHNF4α выявлено снижение экспрессии основного белка адгезионных контактов E-кадгерина (CDH1) и одновременная активация экспрессии N-кадгерина (CDH2). Помимо этого, подавление синтеза HNF4α сопровождалось повышением уровня экспрессии гена CDKN1A (рис. 3Б). Таким образом, подавление HNF4α в клетках AsPC1 не вызвало значительных изменений их дифференцировочного статуса, но индуцировало «переключение» экспрессии с E-кадгерина на N-кадгерин, что может быть связано с изменениями клеточной подвижности, и стимулировало экспрессию белка p21CIP1/WAF1, являющегося важным регулятором клеточного цикла.
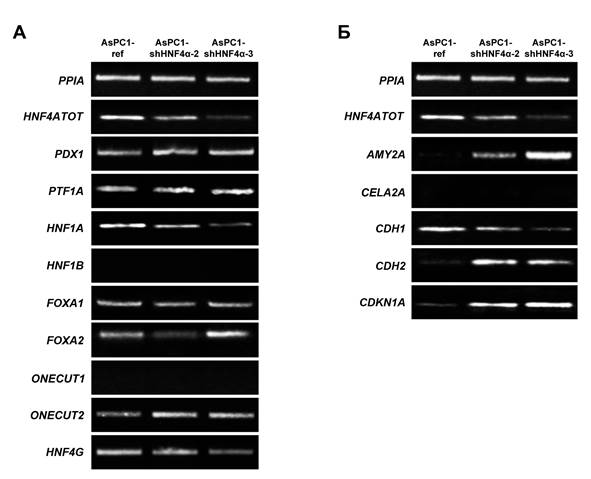
Рис. 3. Влияние подавления синтеза HNF4α на экспрессию генов в клетках AsPC1
А. Уровни экспрессии основных генов-регуляторов дифференцировки ПЖ, полуколичественный ОТ-ПЦР-анализ. Б. Уровни экспрессии функциональных генов ПЖ, связанных с дифференцировкой и контролем биологических характеристик, полуколичественный ОТ-ПЦР-анализ
Обсуждение
Инактивация опухолевых супрессоров – одно из ключевых событий в прогрессии опухолей. Функциями опухолевых супрессоров могут обладать как белки, напрямую контролирующие биологические свойства клеток (пролиферацию, миграцию, апоптоз), так и факторы, регулирующие клеточную дифференцировку, в частности тканеспецифические ТФ. Так как один «ключевой» ТФ может одновременно регулировать экспрессию большого количества генов-мишеней, связанных с различными системами клетки, нарушения функций ключевых ТФ при канцерогенезе часто приводят к более комплексным изменениям, чем нарушения функций отдельных эффекторов [1]. В клетках ПЖ такими критичными факторами являются белки PDX1, PTF1α и факторы семейства HNF, в частности – HNF4α [1; 14].
Ранее нами было показано, что HNF4α также может обладать функциями опухолевого супрессора в клетках ПАКПЖ, при этом опухолесупрессорное действие было описано не только для панкреаспецифических изоформ группы HNF4αP2, но и для нехарактерной для ПЖ изоформы HNF4α1 [3; 4]. Однако на фоне этих результатов оставалась неисследованной возможная роль гиперэкспрессии изоформ HNF4αP1, которая наблюдается в культуре AsPC1 (рис. 1А) [4]. Повышение общего уровня синтеза HNF4α выявлено также Kim и соавторами в пренеопластических образованиях ПЖ и на самых ранних стадиях развития ПАКПЖ, однако в этой работе изменения экспрессии отдельных изоформ HNF4α не изучались [8]. Мы предположили, что гиперэкспрессия HNF4α, и в частности активация изоформ группы HNF4αP1, может играть важную роль на ранних стадиях прогрессии ПАКПЖ, и поэтому исследовали эффекты, вызываемые подавлением синтеза HNF4α в клетках AsPC1.
Значительное повышение способности клеток AsPC1 к направленной миграции при подавлении HNF4α согласуется с гипотезой об опухолесупрессорной функции HNF4α и с результатами, полученными ранее при исследовании высокодифференцированной культуры клеток ПАКПЖ Capan2 [3]. Однако резкое снижение пролиферативной и колониеобразующей способности клеток AsPC1-shHNF4α свидетельствует о том, что сохранение экспрессии HNF4α может быть необходимо для поддержания клеток ПАКПЖ в состоянии активной пролиферации. Таким образом, HNF4α может обладать не описанными ранее проопухолевыми функциями.
Следует отметить, что хотя в культуре AsPC1-shHNF4α-2 действие мшРНК затронуло только изоформы группы HNF4αP2, а в культуре AsPC1-shHNF4α-3 был подавлен синтез обеих групп изоформ, мы не выявили принципиальных отличий в биологических свойствах между культурами AsPC1-shHNF4α-2 и AsPC1-shHNF4α-3 (рис. 1Б). Группы изоформ HNF4αP1 и HNF4αP2 обладают разным трансактивационным потенциалом и могут по-разному влиять на экспрессию одних и тех же генов в зависимости от набора кофакторов, с которыми они взаимодействуют [13]. По всей видимости, изоформы группы HNF4αP2 являются более значимыми регуляторами биологических свойств клеток ПАКПЖ, чем HNF4αP1; однако подавление синтеза HNF4αP2 в клетках Capan2 сопровождается повышением, а не понижением пролиферативной активности [3]. Возможно, изоформы группы HNF4αP1, активно экспрессирующиеся в клетках AsPC1, способны связываться с изоформами HNF4αP2, формировать димерный комплекс и таким образом модулировать активность HNF4αP2, придавая последнему проопухолевые функции, однако эта гипотеза на сегодняшний день не исследована.
Описанный комплекс изменений (повышение миграционного потенциала и снижение пролиферативной активности) ведет к приобретению клетками так называемого миграторного фенотипа, который характерен для высокометастатических субпопуляций опухолевых клеток. В клетках с таким фенотипом наблюдаются изменения, характерные для процессов дедифференцировки и эпителиально-мезенхимального перехода (ЭМП). В то время как подавление экспрессии HNF4α не оказало однонаправленного влияния на экспрессию основных регуляторов дифференцировки ПЖ (рис. 3А), активация экспрессии панкреатической α-амилазы в клетках AsPC1-shHNF4α указывает на их частичную редифференцировку. С одной стороны, реактивация гена AMY2A может говорить о том, что в клетках AsPC1-shHNF4α действуют регуляторные пути, характерные для ацинарных клеток. С другой стороны, сам факт того, что подавление синтеза HNF4α может стимулировать редифференцировку клеток, еще раз подтверждает наличие у HNF4α неохарактеризованных функций, так как ранее в литературе было описано только продифференцировочное действие HNF4α [1; 6; 9].
Наблюдаемые в клетках AsPC1-shHNF4α изменения экспрессии E- и N-кадгеринов характерны для клеток, претерпевающих ЭМП. Замена стабильных E-кадгериновых адгезионных контактов на более лабильные N-кадгериновые является одним из механизмов, обеспечивающих повышение клеточной подвижности. Однако клетки исходной культуры AsPC1 характеризуются очень слабой способностью к формированию межклеточных контактов, поэтому маловероятно, что изменение экспрессии кадгеринов в клетках AsPC1-shHNF4α может быть основной причиной повышения их миграционного потенциала.
Важным регулятором клеточных свойств, экспрессия которого повышается в клетках AsPC1 при подавлении синтеза HNF4α, является белок p21CIP1/WAF1, кодируемый геном CDKN1A. Этот белок обладает как анти-, так и проопухолевыми функциями: локализуясь в ядре, он ингибирует клеточную пролиферацию и стимулирует репарацию ДНК, в то время как в цитоплазме он подавляет апоптоз и стимулирует перестройку актина, повышая подвижность клеток [11]. В свете этих фактов повышение экспрессии CDKN1A в клетках AsPC1-shHNF4α хорошо согласуется с наблюдаемым ослаблением их пролиферативной активности и повышением миграционного потенциала. Более того, ген CDKN1A является прямой транскрипционной мишенью HNF4α, вследствие чего регуляция экспрессии p21CIP1/WAF1 рассматривается как наиболее вероятный механизм влияния HNF4α на пролиферативную активность клеток [7]. Однако изоформы HNF4αP1 описаны как активаторы, а не ингибиторы активности гена CDKN1A, что противоречит наблюдаемой нами активации CDKN1A при подавлении HNF4α (рис. 3Б). По всей видимости, механизм HNF4α-зависимой регуляции экспрессии p21CIP1/WAF1 необходимо исследовать детальнее, чтобы учесть возможные различия в действии изоформ HNF4αP1 и HNF4αP2 на активность гена CDKN1A.
Заключение
В данной работе впервые продемонстрировано, что фактор HNF4α в клетках ПАКПЖ может не только выполнять роль опухолевого супрессора, но и проявлять проопухолевые функции. Подавление его синтеза в умереннодифференцированных клетках ПАКПЖ вызывает изменения их свойств, ассоциированные как с усилением, так и с ослаблением злокачественного потенциала. Вероятным механизмом проопухолевого действия HNF4α на клетки ПАКПЖ является его гиперэкспрессия, связанная с активацией синтеза нехарактерной для нормальной ткани ПЖ группы изоформ HNF4αP1. Мы предполагаем, что спектр экспрессии изоформ HNF4α является ключевым параметром, определяющим общее влияние изменения экспрессии HNF4α на биологические свойства клеток ПАКПЖ.
Библиографическая ссылка
Горев А.Д., Чесноков М.С., Лазаревич Н.Л. ПОДАВЛЕНИЕ СИНТЕЗА ТРАНСКРИПЦИОННОГО ФАКТОРА HNF4Α В КЛЕТКАХ ПРОТОКОВОЙ АДЕНОКАРЦИНОМЫ ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ ВЫЗЫВАЕТ РАЗНОНАПРАВЛЕННЫЕ ИЗМЕНЕНИЯ ИХ ЗЛОКАЧЕСТВЕННОГО ПОТЕНЦИАЛА // Современные проблемы науки и образования. 2016. № 6. ;URL: https://science-education.ru/ru/article/view?id=25526 (дата обращения: 06.02.2026).



