Современная фармакология предлагает широкий спектр цитостатиков для химиотерапии опухолей различной природы и локализации (рубомицин, актиномицин Д, циклофосфан, винбластин и др.) [3]. Однако эти препараты не обладают высокой избирательностью действия и, как следствие, оказывают токсический эффект как по отношению к опухолевым, так и здоровым клеткам. Такая химиотерапия приводит к тяжелым осложнениям, связанным с развитием функциональной недостаточности большинства органов и систем. В связи с этим возникает необходимость в использовании веществ-транспортеров цитостатиков, которые бы селективно доставляли лекарственные препараты в опухолевые клетки. В Институте биохимии на примере винбластина и актиномицина Д было показано, что человеческий аполипопротеин А-I (апоА-I) способен связывать цитостатики и доставлять их в клетки [1, 2]. Изучение применения апоА-I для подавления опухолевого роста в лабораторных условиях показал, что при использовании апоА-I для транспорта цитостатиков можно подобрать такие концентрации цитостатиков, при которых подавляется рост опухолевых клеток, при этом токсическое действие на окружающие ткани резко снижается [1]. В связи с этим апоА-I представляет интерес для изучения его транспортной функции в качестве средства доставки цитостатиков и других биологически активных веществ в клетки. Классические методы получения апоА-I в качестве источника белка используют сыворотку крови человека [5, 6], однако по этическим причинам этот ресурс не может быть широко использован. Это обстоятельство сдерживает применение апоА-I в широкой практике. С развитием технологии рекомбинантных ДНК появилась возможность получать человеческие белки в различных организмах, например, в бактериях в достаточно больших количествах и сравнительно менее трудоемкими способами. Однако известно, что рекомбинантные белки могут отличаться по биохимическим свойствам от своих природных аналогов. Таким образом, целью нашего исследования являлось получение рекомбинантного апоА-I человека в клетках E.coli и исследование его способности связывать лиганды различной биохимической природы в сравнении с нативной формой белка.
Материалы и методы
Выделение и очистка апоА-I. Для получения рекомбинантного апоА-I использовали продуцент на основе E.coli шт. BL21(DE3), полученный ранее в нашей лаборатории [7]. Белок выделяли из клеток E.coli в денатурирующих условиях (6М мочевина) путем разрушения клеток ультразвуком с последующим выделением белка из клеточного лизата аффинной хроматографией на сорбенте Ni-NTA сефарозе («Qiagen», США) согласно работе [8]. Выделение и очистку нативного апоА-I из плазмы крови человека проводили по методике, описанной в работе [5]. Сначала методом изоплотностного центрифугирования в растворе бромида калия выделяли фракцию липопротеинов высокой плотности (ЛПВП), затем в денатурирующих условиях из фракции ЛПВП выделяли апоА-I методом гель-фильтрации на Сефарозе 6B-CL («Pharmacia», Швеция). На заключительных этапах белки переводили в физиологичные условия путем диализа против стандартного фосфатно-солевого буфера с рН 7,4. Качественный анализ белков проводили в 12 % полиакриламидном геле по Лэммли. Готовые белки хранили при 4 0С.
Измерение концентрации белков. Измерение концентрации белков проводили спектрофотометрически в ЦКП «Спектрометрические измерения» на базе НИИ биохимии, г. Новосибирск (спектрофотометр Evolution 300 («Thermo Scientific», США). При λ=280 нм 1 о.е./мл принимали за концентрацию белка 1 мг/мл.
Исследуемые лиганды. Актиномицин Д («AppliChem», Германия), доксорубицин («AppliChem», Германия), олигомицин («Sigma-Aldrich», США), ампициллин – бензилпенициллина натриевая соль (ОАО «Синтез», Россия) и эстриол («Sigma-Aldrich», США).
Определение констант связывания. Константы связывания лигандов с белками рассчитывали методом тушения триптофановой флуоресценции [5]. Измерения проводили в термостатируемой кювете при 37º С в фосфатно-солевом буфере на спектрофлюориметре RF-530 («Shimadzu», Япония) при длине волны возбуждения 285 нм и эмиссии в диапазоне от 300 до 400 нм. Титрование проводили добавлением аликвот по 20 мкл стоковых растворов лигандов с концентрацией 1 мг/мл к 2 мл раствора апоА-I с концентрацией 100 мкг/мл. После добавления цитостатиков к белкам образцы инкубировали не менее 3 мин, после чего проводили замеры. Каждая проба лиганда исследовалась не менее трех раз. Расчет константы связывания осуществляли по методу Аттала и Лата [10].
Статистическая обработка результатов производилась с помощью программы «StatPlus 2009 Professional». Данные представлены как среднее значение величины ± ошибка средней величины, n – количество опытов.
Результаты исследования и их обсуждение
В результате выделения белка из клеток-продуцентов был получен полипептид с молекулярной массой ~ 33,4 кДа. Полученный полипептид представлял из себя слитый белок апоА-I человека с синтетической лидерной последовательностью из 43 аминокислотных остатков (а.о.) на N-конце белка. Выход химерного рекомбинантного апоА-I составил 182±23 мг из одного литра культуры клеток (n=14), что значительно превышает почти на 80 % результаты, представленные в работе [13], в которой использовался оптимизированный ген для экспрессии в клетках E.coli и аналогичная экспрессирующая система (клетки E.coli шт. BL21(DE3) и ген апоА-I под контролем промотора гена 10 бактериофага Т7). Вариант этой химерной формы белка (апоА-I.Х) использовался для изучения способности связывать исследуемые лиганды. Кроме того, данный химер использовался для последующего превращения в белок зрелой формы. Синтетическая лидерная последовательность содержала лабильный фрагмент Asp-Pro, что позволяло отщеплять лидерную последовательность от основного белка апоА-I с помощью кислотного гидролиза. Кислотный гидролиз и последующее очищение белка проводили согласно процедуре, описанной в работе [8]. Полученный белок без лидерной последовательности (апоА-I.З) имел молекулярную массу порядка 28 кДа и не имел двух а.о. с N-конца (аспарагиновая и глутаминовая кислоты), в остальном по первичной структуре он был идентичен белку зрелой формы апоА-I человека (апоА-I.Н). Выход очищенного белка апоА-I.З составлял 61 мг из одного литра культуры клеток (n=5) или 34 мг из 100 мг исходного химерного рекомбинантного апоА-I.Х.
Ранее сотрудниками Института биохимии методом тушения флуоресценции триптофана было показано взаимодействие нативного апоА-I человека с тетрагидрокортизолом [4], а также с цитостатиками – винбластином и актиномицином Д [1, 2]. Поэтому мы предположили, что данный метод может быть использован для подтверждения функциональных свойств полученных нами рекомбинантных форм апоА-I (с лидером и без) в сравнении с нативной формой белка, а в качестве лигандов могут быть использованы антибиотики, в том числе антибиотики противоопухолевого действия, включая уже описанный актиномицин Д [2], а также гормон стероидной природы – эстриол [9]. В результате для исследования были выбраны актиномицин Д, доксорубицин, олигомицин, ампициллин и эстриол.
Изучение связывания проводили методом тушения триптофановой флуоресценции [5]. Метод основан на взаимодействии белка с лигандом, в результате такого взаимодействия происходит экранирование триптофаниловых остатков белка и уменьшение флуоресценции (тушение) в зависимости от количества связанного лиганда. Типичный пример снижения флуоресценции при образовании комплексов представлен на рисунке. На рисунке кривая с максимальным пиком (кривая 1) соответствует флуоресценции чистого белка (принимается за 100 %), далее идет снижение флуоресценции по мере увеличения количества связанного лиганда в растворе белка (кривые 2). Кривая с минимальным значением флуоресценции соответствует максимальной концентрации олигомицина в растворе без белка (кривая 3).
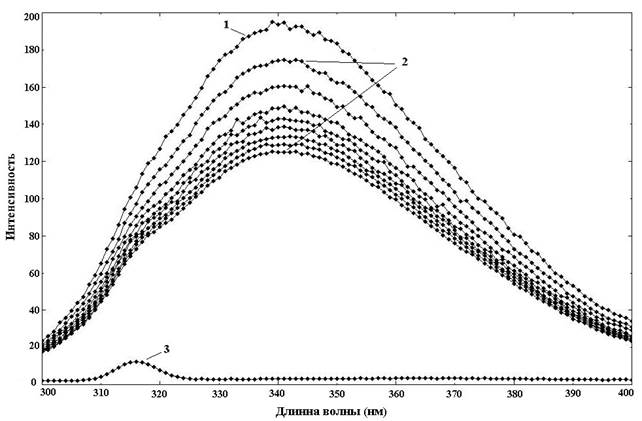
Спектры тушения триптофановой флуоресценции рекомбинантного апоА-I.З при взаимодействии с олигомицином. По оси абсцисс представлена длина волны эмиссии, по оси ординат – относительные единицы флуоресценции
В исследовании использовали три формы белка: апоА-I.Х – рекомбинантный полипептид апоА-I с лидерной последовательностью из 43 чужеродных а.о.; апоА-I.З – зрелая форма белка апоА-I человека, полученная из предшественника апоА-I.Х путем кислотного гидролиза; апоА-I.Н – человеческий белок апоА-I зрелой формы (нативная форма), выделенный из плазмы крови.
На основании кривых тушения флуоресценции были рассчитаны константы связывания полученных форм белка апоА-I человека с лигандами (таблица).
Константы связывания полученных форм белка апоА-I с лигандами (1 х 105 М-1)
|
Белок |
Лиганды |
||||
|
Актиномицин Д |
Доксорубицин |
Олигомицин |
Ампициллин |
Эстриол |
|
|
АпоА-I.Х |
1,1±0,4 |
4,8±0,4 |
9,8±0,8 |
0,5±0,1 |
2,5±0,3 |
|
АпоА-I.З |
1,9±0,4 |
5,0±0,6 |
11,0±1,1 |
0,5±0,1 |
2,4±0,2 |
|
АпоА-I.Н |
1,7±0,3 |
3,8±0,8 |
10,3±0,9 |
0,6±0,2 |
1,9±0,3 |
Следует отметить, что полученная нами константа связывания для актиномицина Д 1,7±0,3 х 105 М-1 совпадает с ранее опубликованными данными для нативного человеческого апоА-I, 1,4 х 105 М-1 [2], так же как и в случае с эстриолом 1,9±0,3 х 105 М-1 в настоящем эксперименте и 2,1 х 105 М-1 в работе [9]. Эти результаты свидетельствуют о корректности постановки метода исследования. В целом, полученные результаты показывают, что величины констант связывания перечисленных лигандов с различными исследуемыми формами белка апоА-I лежат в пределах 0,5 -11,0 х 105 М-1, что указывает на определенную специфичность взаимодействия апоА-I с данными лигандами.
Из таблицы видно, что полученные значения констант связывания для каждого лиганда при взаимодействии с тремя различными формами апоА-I не имели достоверных отличий. Это подтверждает функциональное сходство полученного рекомбинантного апоА-I из клеток E.coli с нативным апоА-I из плазмы крови человека и дает нам основание предполагать, что полученный рекомбинантный белок может быть использован в качестве переносчика в клетку обладающих противоопухолевым действием актиномицина Д, доксорубицина и олигомицина.
Близкие значения констант связывания апоА-I.Х с другими формами белков позволяют сделать предположение о том, что «хвост» в виде лидерной последовательности из 43 а.о. на N-конце апоА-I не мешал взаимодействию белка с лигандами. Вероятно, это обусловлено тем, что N-конец белка не вовлечен в эти взаимодействия. Это предположение согласуется с литературными данными, в которых предполагается, что N-концевая область (1-43 а.о.) имеет умеренное связывание с фосфолипидами и является необходимой для стабилизации свободной от липидов структуры апоА-I [12, 14]. Центральный же домен белка апоА-I (100-186 а.о.) отвечает за активацию лецитин-холестерин ацилтрансферазы, участвует в регуляции взаимодействия с фосфолипидами и отвечает за пластичность молекулы [11]. C-концевой участок (185-243 а.о.) в основном не имеет определенной структуры и отвечает за инициирование связывания с липидами, агрегацию, в обратном транспорте холестерина, а также имеет самый высокий аффинитет к фосфолипидам [14].
Таким образом, полученные нами результаты подтверждают предположение о том, что N-концевой участок апоА-I не участвует в активном взаимодействии с биохимическими лигандами. Данное понимание структуры белка может быть использовано при конструировании химерных полипептидов на основе апоА-I с целью сохранения его функциональной активности в качестве переносчика различных биологически активных веществ в клетку.
Выводы
На примере пяти лигандов различной биохимической природы показа способность рекомбинантного и нативного апоА-I образовывать комплексы с данными веществами, константа связывания таких комплексов лежит в пределах 0,5-11,0 х 105 М-1. Близкие значения констант связывания нативного и рекомбинантного апоА-I с лигандами подтверждает схожесть биологических свойств двух полученных форм рекомбинантного апоА-I с нативным апоА-I-белком плазмы крови человека. На примере актиномицина Д, доксорубицина и олигомицина показана способность полученного рекомбинантного апоА-I образовывать комплексы с противоопухолевыми препаратами, что позволяет рассматривать рекомбинантный апоА-I в качестве перспективного носителя этих лекарственных средств.
Библиографическая ссылка
Рябченко А.В., Котова М.В., Поляков Л.М. ПОЛУЧЕНИЕ РЕКОМБИНАНТНОГО АПОЛИПОПРОТЕИНА А-I ЧЕЛОВЕКА И ИССЛЕДОВАНИЕ ЕГО ВЗАИМОДЕЙСТВИЯ С ЛИГАНДАМИ РАЗЛИЧНОЙ БИОХИМИЧЕСКОЙ ПРИРОДЫ // Современные проблемы науки и образования. 2016. № 5. ;URL: https://science-education.ru/ru/article/view?id=25448 (дата обращения: 14.02.2026).



