В большей части операций, выполняемых в современной хирургии, врач сталкивается с необходимостью на том или ином этапе выполнять соединение тканей, именно от качества которого зачастую зависит успешность и конечный результат оперативного вмешательства. Наиболее широко распространённым был и остаётся метод шовной технологии [1]. Причиной этому служат его простота, относительная дешевизна, эффективность. В настоящее время существуют нити, обладающие комплексным действием [4; 5]. Одним из таких современных шовных материалов является Тверан-ХЦГ. Данная нить была разработана во ВНИИСВ в тесном сотрудничестве с кафедрой общей хирургии ТГМУ. Тверан-ХЦГ (далее по тексту - тверан) – является комплексной нитью и имеет следующее строение: основу нити составляет поликапроамидное волокно (ПН), с полимерным покрытием из 2%-ного высокомолекулярного хитозана (ВХ), содержащим 4%-ный антибактериальный препарат ципрофлоксацин (ЦФ) и 1%-ный препарат из группы германийорганических соединений (ГОС) – астрагерм (АГ). Тверан обладает антибактериальным эффектом и за счёт содержащегося в его составе АГ - способностью ускорять течение воспалительной реакции, сокращать время заживления ран, что было подтверждено исследованиями на экспериментальных животных [2]. Данная нить была положена в основу работы по изучению эффективности её применения в общехирургической практике.
Цель исследования
Изучение динамики местных тканевых изменений при использовании нити Тверан; улучшения результатов лечения больных с общехирургической патологией; изучение эффективности клинического применения нового шовного материала тверан-ХЦГ.
Материалы и методы исследования
Материалом для исследования послужили результаты обследования 276 больных, в возрасте от 12 до 86 лет, перенёсших хирургическое вмешательство по различным общехирургическим патологиям. Больные были разбиты на 3 группы в зависимости от шовного материала, использованного для соединения тканей: 1 группа – 87 пациентов (45 мужчин, 42 женщины), использовалась нить Капрон (далее по тексту - капрон); 2 группа – 95 пациентов (52 мужчины, 43 женщины), использовалась нить Никант (далее по тексту - никант); 3 группа – 94 пациента (46 мужчин, 48 женщин), использовалась нить тверан. Сравнение групп по возрастному и половому составу различий не выявило. Больным в установленные сроки проводился необходимый набор исследований. С помощью определённой балльной шкалы на 1, 3 и 5-е сутки оценивались выраженность болевого синдрома (от 0 до 4 баллов). В те же сроки значениями от 0 до 3 баллов оценивались симптомы местных проявлений воспалительной реакции: гиперемии, отека, инфильтрации, экссудации, расхождения краёв раны (от 0 до 2). Ежедневно с 1-х по 5-е сутки изучалась местная температура тела и рассчитывался, по следующей формуле, температурный индекс кровообращения (ТИК):![]() , где tk – температура кожи исследуемого участка, tв – температура окружающего воздуха, tп – температура в подмышечной впадине. С помощью цитологического исследования в 8, 16 и 24 часа изучалось количество нейтрофилов, макрофагов раневого экссудата.
, где tk – температура кожи исследуемого участка, tв – температура окружающего воздуха, tп – температура в подмышечной впадине. С помощью цитологического исследования в 8, 16 и 24 часа изучалось количество нейтрофилов, макрофагов раневого экссудата.
Результаты исследования и обсуждение
По данным изучения динамики болевого синдрома выяснилось, что происходит достоверное уменьшение боли у пациентов всех групп. Различия эффектов использованных нитей не оказались в необходимой степени достаточными для получения достоверной разницы в интенсивности болевых ощущений.
Результаты анализа отёчного синдрома выявили следующие особенности (таблица 1).
Таблица 1
Оценка выраженности отёка в области послеоперационной раны (M±S)
|
Группа |
1-е сутки |
3-и сутки |
5-е сутки |
|
1 |
0,63±0,57 |
1,32±0,47 |
0,18±0,54 |
|
2 |
0,13±0,33*+ |
0,89±0,43* |
0,42±0,82* |
|
3 |
0,01±0,1*+ |
0,78±0,61* |
0,25±0,59 |
*- достоверность различий в сравнении с контролем p<0.05
+- достоверность различий между группами 2, 3 p<0.05
В соответствии с полученными результатами отёчность тканей на 1-е сутки была во 2-й и 3-й группах достоверно ниже, чем в первой, с наименьшим показателем при использовании тверана. На 3-и сутки отёчность в области тканей возрастала во всех случаях, при этом сохранялась достоверность отличий показателей в сравнении с капроном. На 5-е сутки отёк тканей уменьшался во всех трёх случаях, при этом в группе никанта этот показатель был выше, чем в контроле. По результатам анализа можно видеть, что выраженность отёка в целом, а следовательно и воспалительной реакции, была ниже в группе тверана.
Изучение местной реакции по показателю инфильтрации выявило следующие изменения (таблица 2).
Таблица 2
Оценка выраженности инфильтрации в области послеоперационной раны (M±S)
|
Группа |
1-е сутки |
3-и сутки |
5-е сутки |
|
1 |
0,31±0,47 |
1,12±0,64 |
0,39±0,49 |
|
2 |
0,01±0,1* |
0,64±0,48*+ |
0,27±0,45 |
|
3 |
0* |
0,33±0,47*+ |
0,17±0,38* |
*- достоверность различий в сравнении с контролем p<0.05
+- достоверность различий между группами 2, 3 p<0.05
Наибольшая инфильтрация тканей наблюдалась в 1-й группе, где полученные значения достоверно превышали аналогичные в других группах на 1-е и 3-и сутки, и значение в 3-й группе на 5-е сутки. Кроме того, определялось различие (p<0.05) в отношении выраженности инфильтрации на 3-и сутки при использования никанта, в сравнении с твераном. По результатам анализа данного симптома видно, что, как и в предыдущем случае, наименьшую местную воспалительную реакцию вызывают никант и тверан, с преимуществом нити тверан.
Результаты исследования выраженности гиперемии представлены в таблице 3.
Таблица 3
Оценка выраженности гиперемии в области послеоперационной раны (M±S)
|
Группа |
1-е сутки |
3-и сутки |
5-е сутки |
|
1 |
0,95±0,3 |
2,24±0,59 |
1,00±0 |
|
2 |
0,8±0,43* |
1,77±0,54*+ |
1,01±1,01+ |
|
3 |
0,77±0,43* |
1,59±0,59*+ |
1,13±0,34*+ |
*- достоверность различий в сравнении с контролем p<0.05
+- достоверность различий между группами 2, 3 p<0.05
Достоверность различий между полученными значениями контрольной и остальными группами определялась во все сроки. Наименьший показатель оказался при использовании тверана, за исключением 5-х суток. В данный срок значение неожиданно оказалось завышенным и отличным (p<0.05) от аналогичных цифр, полученных при использовании капрона и никанта. Тем не менее по представленным данным, тверан сохраняет свою характеристику материала, способного вызывать меньшую по сравнению с другими нитями воспалительную реакцию. В соответствии с данными таблицы 3, значения гиперемии на 3-и и 1-е сутки оказались наименьшими в группе 3.
Оценка выраженности местной экссудативной реакции обнаружила следующие изменения (таблица 4).
Таблица 4
Оценка выраженности экссудации в области послеоперационной раны (M±S)
|
Группа |
1-е сутки |
3-и сутки |
5-е сутки |
|
1 |
1,00±0 |
0,26±0,54 |
0,09±0,29 |
|
2 |
0,86±0,35*+ |
0,43±0,59*+ |
0,23±0,42*+ |
|
3 |
0,98±0,15+ |
0,09±0,29*+ |
0,08±0,26+ |
*- достоверность различий в сравнении с контролем p<0.05
+- достоверность различий между группами 2, 3 p<0.05
Значение, описывающее степень экссудации при использовании никанта, оказалось достоверно ниже, чем в других группах на 1-е сутки, и выше аналогичных на 3-и и 5-е сутки. Тверан по полученным значениям был достоверно выше никанта на 1-е сутки, ниже капрона и никанта на 3-и и ниже никанта на 5-е. Наиболее раннее снижение показателя экссудации получено в группе 3 на 3-и сутки, что говорит о более раннем разрешении явлений экссудации и соответственно стихании воспалительной реакции при использовании нити тверан.
Для объективной оценки местного состояния тканей использовался температурный метод кровообращения ТИК. Полученные значения представлены в таблице 5, кроме того, для наглядности результаты были изображены в виде графика (рисунок 1).
Таблица 5
Результаты оценки динамики ТИК в области п/о раны (M±S)
|
Группа |
1-е сутки |
2-е сутки |
3-и сутки |
4-е сутки |
5-е сутки |
|
1 |
5,58±0,39 |
6,86±0,18 |
9,51±0,45 |
8,08±0,3 |
6,29±0,16 |
|
2 |
6,1±3,25 |
7,06±3,15 |
8,84±2,93* |
7,05±3,11* |
6,22±3,19 |
|
3 |
5,79±0,16* |
6,63±0,25* |
8,47±0,32* |
6,77±0,17* |
5,78±0,26* |
*- достоверность различий в сравнении с контролем p<0.05
+- достоверность различий между группами 2, 3 p<0.05

Рис. 1. Динамика температурного индекса кровообращения
В соответствии с представленными данными значения группы 3 достоверно отличались, в меньшую сторону, от контроля за весь период наблюдения. В группе никанта различия с контролем (p<0.05) определялись только на 3-и и 4-е сутки. Полученные результаты более наглядно можно оценить на графике, на котором самое нижнее положение занимают значения ТИК. При этом пик роста, характеризующий состояние тканей, приходится на 3-и сутки. Исходя из результатов анализа ТИК, можно заключить, что использование тверана и никанта ведёт к менее выраженной местной воспалительной реакции.
По результатам изучения динамики местного состояния тканей можно с уверенностью утверждать, что тверан в сравнении с исследованными нитями: обладает способностью влиять на интенсивность воспалительной реакции, уменьшая её выраженность; способен влиять на выраженность экссудации, ускоряя её разрешение, и, как следствие, сокращать продолжительность 1-й фазы воспаления.
Показатели динамики нейтрофилов раневого экссудата представлены в таблице 6.
Таблица 6
Динамика числа сегментоядерных нейтрофилов раневого экссудата (M±S)
|
Группа |
8 часов |
16 часов |
24 часа |
|
1 |
91,94±1,65 |
80,83±0,92 |
64,59±2,43 |
|
2 |
93,82±3,41*+ |
91,17±1,27*+ |
72,44±1,66*+ |
|
3 |
91,13±0,88*+ |
85,39±2,68*+ |
83,49±2,52*+ |
*- достоверность различий в сравнении с контролем p<0.05
+- достоверность различий между группами 2, 3 p<0.05
Во всех группах в динамике происходило убывание числа клеток в мазке. При этом показатели групп 2 и 3 были достоверно отличимы от контроля и друг от друга. Количество клеток при применении никанта и тверана было выше, чем в случае капрона, во все сроки, кроме 8-часового анализа. В этот период этот показатель был наименьшим в 3-й группе. Число клеток при применении никанта преобладало над твераном, за исключением 24-часовой точки, где наблюдалось обратное соотношение. Представленные данные демонстрируют достаточно быстрое уменьшение, с течением времени, интенсивности миграции нейтрофилов в область послеоперационной раны, кроме группы тверана. Разность между значениями средних 8-часового и 24-часового анализов для 1-й группы составила 27 единиц, для второй - 21 единицу, и для третьей - 8 единиц. По результатам приведённого анализа можно утверждать, что тверан обладает способностью стимулировать миграцию нейтрофилов в область раны.
Для макрофагов наблюдалось несколько иное количественное соотношение в мазках (таблица 7).
Таблица 7
Динамика числа макрофагов раневого экссудата (M±S)
|
Группа |
8 часов |
16 часов |
24 часа |
|
1 |
0 |
0,64±0,48 |
1,59±0,98 |
|
2 |
0 |
0,75±0,68+ |
1,47±0,56+ |
|
3 |
0 |
1,13±0,34*+ |
3,62±0,64*+ |
*- достоверность различий в сравнении с контролем p<0.05
+- достоверность различий между группами 2, 3 p<0.05
В соответствии с представленными данными, в 8-часовом мазке макрофагов не определялось. Появление этих клеток, с динамикой к росту количества, отмечалось во втором и третьем анализах в 16 и 24 часа во всех группах. Наибольшее число макрофагов, во всех исследованиях, определялось у пациентов, для закрытия ран которых применялся тверан, различие в сравнении с другими нитями было достоверным. Прирост числа клеток в динамике, при сравнении 16- и 24-часового анализов, также преобладал в третьей группе – трёхкратный, в сравнении с двукратным во второй и первой группах. Данную особенность клеточных изменений можно объяснить как стимулирующим эффектом ГОС, входящих в состав тверана, на миграцию макрофагов, так и воздействием этого вещества на активность макрофагов и нейтрофилов. Как известно, от активности нейтрофилов зависит интенсивность миграции макрофагов в ткани. В случае нейтропении моноциты не появляются в очаге воспаления в течение 16 ч, в то время как в естественных условиях воспаления они обнаруживаются уже через 4 ч, а введение в очаг воспаления лейкопеническим животным нейтрофилов восстанавливает обычную аккумуляцию мононуклеаров [3].
В соответствии с результатами анализа раневого экссудата тверан в сравнении с другими исследованными нитями способен: стимулировать наибольшую миграцию макрофагов в область раны; стимулировать пролонгированную миграцию нейтрофилов в область раны.
Для подтверждения эффекта усиления активности нейтрофилов под действием ГОС, входящих в состав нити тверан, был проведён дополнительный анализ результатов цитологического исследования раневого экссудата.
Особенности местной клеточной реакции (таблицы 6 и 7) были изображены графически на рисунках 2 и 3 соответственно.
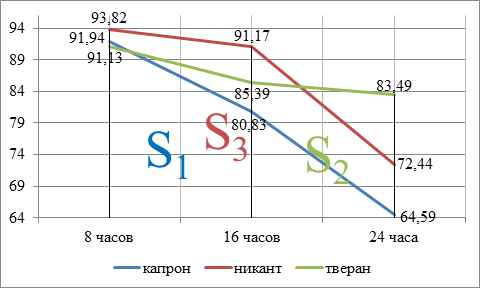
Рис. 2. Динамика изменения числа нейтрофилов в раневом экссудате
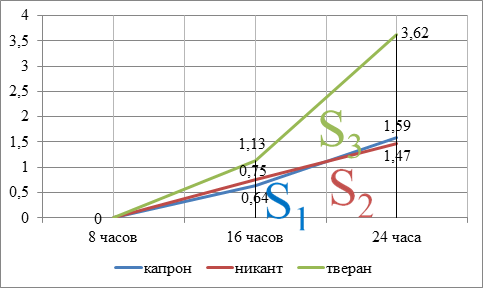
Рис. 3. Динамика изменения числа макрофагов в раневом экссудате
Оценим активность нейтрофилов исходя из представленных графиков, на которых видно, что число нейтрофилов в динамике уменьшалось, а число макрофагов увеличивалось, при этом наибольшее количество макрофагов определялось в группе тверана. Для возможности сравнения активности нейтрофилов применим условный коэффициент, который легко рассчитать по следующей пропорции:
активирующая способность 1 нейтрофила = X число мигрировавших макрофагов
активирующая способность известного = известное число мигрировавших
числа нейтрофилов (таблица 6) макрофагов (таблица 7)
В результате:
X=![]()
Суть представленного коэффициента в следующем, чем меньше нейтрофилов необходимо для привлечения макрофагов, тем больше хемотаксическая и активирующая нейтрофилы способность нити. Так как количество клеток в мазках менялось в динамике, от анализа к анализу (рисунки 2 и 3), для полноты картины возьмем не отдельные значения, а площади, образованные под кривыми. Для этого из точек графиков опустим проекции на ось Х. Между линиями, описывающими изменения числа клеток в динамике, и осью абсцисс образовались многоугольники для каждой из исследуемых нитей. Для всех фигур были рассчитаны площади:
1) для числа нейтрофилов (рисунок 2) S1, S2, S3 – площади под кривыми для капрона, никанта, тверана соответственно;
2) для числа макрофагов (рисунок 3) S1, S2, S3 – площади под кривыми для капрона, никанта, тверана соответственно.
Рассчитанные площади условно назовем нейтрофильная и макрофагальная нагрузка на ткани, а рассчитанные по формуле значения - активирующая способность нейтрофилов для определённой нити. Полученные значения представлены в таблице 8.
Таблица 8
Интегральные показатели нейтрофильной, макрофагальной нагрузки и активирующей способности нейтрофилов
|
Показатель |
Капрон |
Никант |
Тверан |
|
Макрофагальная нагрузка |
2,87 |
2,97+ |
5,88*+ |
|
Нейтрофильная нагрузка |
318,19 |
348,6* |
345,4* |
|
Активирующая способность х10000 |
90,19 |
85,19+ |
170,24*+ |
*- достоверность различий в сравнении с контролем p<0.05
+- достоверность различий между группами 2, 3 p<0.05
В соответствии с представленными данными наибольшая нейтрофильная нагрузка определялась при использовании тверана и никанта, разница с контролем была достоверна. Значение макрофагальной нагрузки было наибольшим в группе 3 и отличалось от групп 1 и 2 (p<0.05). Для удобства восприятия малых значений активирующая способность рассчитывалась на 10 000 клеток, оказалась наибольшей в группе тверана и отличалась от контроля и от никанта (p<0.05). Достоверной разницы между группами 1 и 2 по этому показателю получено не было.
Примечательным является следующий факт – нейтрофильные нагрузки для никанта и тверана не различались (p>0.05) – 348,6 и 345,4 клетки, несмотря на длительно сохраняющуюся в группе 3 тенденцию нейтрофилов к миграции в ткани (таблица 6). Тем не менее значения, описывающие макрофагальную нагрузку, и активирующая способность при использовании тверана были в 2 раза выше аналогичных никанта, что позволяет говорить о высокой активности нейтрофилов в группе 3.
Представленные данные доказывают, что использование нити тверан способно усиливать активность фагоцитирующих клеток и, как следствие, ускорять очищение раны от некротических тканей. Транспонируя этот факт на график изменения ТИК в динамике (рисунок 1), мы видим, что на 1-е сутки воспалительная реакция при применении тверана выше, чем при применении капрона, что, скорее всего, связано с более выраженными, в случае тверана, процессами экссудации и миграцией фагоцитов. «Перекрест» между этими нитями происходит где-то на середине 2-х суток (36 часов). Из чего следует, что быстрое очищение раны действительно ведёт к сравнительно более раннему переходу в следующую фазу и менее интенсивному дальнейшему течению воспалительного процесса.
На основании проведённого анализа можно с уверенностью утверждать, что использование тверана позволяет ускорять и сокращать продолжительность фаз раневого процесса. Сокращение любой из фаз раневого процесса неизбежно отразится на его продолжительности в целом.
Дальнейший ход исследования ставил себе целью изучить воздействие полученных эффектов при использовании нити тверан на сроки лечения.
Представленные группы из-за различия патологий имели значительную разнородность по срокам лечения, отклонения от средней составляли до 20 дней и более, при опухолевых заболеваниях. Естественно, данный фактор может существенно исказить средние сроки лечения и нивелировать эффект воздействия нити на скорость заживления ран. Для исключения этого из основного состава пациентов были созданы новые равные по размеру, возрастному и половому составу группы, включающие одинаковые нозологии в эквивалентных количествах. После чего были изучены средние сроки лечения пациентов при использовании различных шовных материалов в стандартных и вновь сформированных группах. В соответствии с полученными данными наименьшая продолжительность лечения в стандартных группах определялась при использовании тверана, достоверных различий с контролем получено не было, но рассчитанный показатель p=0.08 продемонстрировал существующую тенденцию сокращения сроков лечения при использовании этой нити.
Во вновь сформированных группах наименьшее значение сроков лечения было в группе тверан – 8,53±1,31 дня, при этом имелось достоверное отличие от группы контроля – 9,34±1,74 дня и группы никант – 9,37±2,25 дня (p<0.05). Других статистически значимых различий по данному показателю найдено не было.
Разница в сроках лечения при использовании тверана в сравнении с контролем для основных групп составила 1,03±4,05 дня (p=0.08), для вновь сформированных групп составила 0,81±1,53 дня (p<0.05).
Выводы:
1. Использование шовного материала Тверан-ХЦГ позволяет усиливать активность и миграцию фагоцитирующих клеток из сосудистого русла в область раны.
2. ГОС, входящее в состав нити Тверан-ХЦГ, при воздействии на ткани раны способствует сокращению продолжительности первой фазы раневого процесса.
3. Применение нити Тверан-ХЦГ для закрытия послеоперационных ран снижает интенсивность течения местной воспалительной реакции.
4. Нить Тверан-ХЦГ обладает более высокой клинической эффективностью по сравнению с традиционными шовными материалами, что подтверждается сокращением сроков лечения пациентов при её применении на 0,81±1,53 дня.
Библиографическая ссылка
Мохов Е.М., Сергеев А.Н., Кадыков В.А., Аскеров Э.М., Армасов А.Р., Любский И.В., Серов Е.В., Сахаров А.А., Сухов А.Д. ИСПОЛЬЗОВАНИЕ НОВОГО БИОЛОГИЧЕСКИ АКТИВНОГО ХИРУРГИЧЕСКОГО ШОВНОГО МАТЕРИАЛА В КЛИНИЧЕСКОЙ ПРАКТИКЕ // Современные проблемы науки и образования. 2016. № 5. ;URL: https://science-education.ru/ru/article/view?id=25434 (дата обращения: 17.10.2025).



