Посттравматическая регенерация мышечной ткани является актуальной проблемой в медицине. В течение жизни человек подвергается разным повреждающим факторам, действующим на мышцы, таким как ранения, действие токсинов, растяжения, перенапряжение мышц и другие. Действие этих факторов приводит к различным последствиям: от временного снижения работоспособности мышц до необратимых повреждений и полной потери сократительной функции.
В настоящее время считают, что миосателлиты, впервые описанные AlexMauro в 1961 году, – главный источник постнатального мышечного роста и репарации мышц [1, 5, 9, 14].
Раскрытие клеточных и молекулярных механизмов репаративных процессов в мышечной ткани поможет создавать условия для более эффективной и быстрой регенерации мышц, а также для предотвращения их фиброза. Изучение сигнальных каскадов, привязка их активности к определенным стадиям жизненного цикла миосателлитов – их пролиферации и дифференцировки – поможет найти точки и сроки применения фармакологических препаратов, регулирующих пролиферацию и дифференцировку стволовых клеток мышечной ткани.
В запуске миогенной дифференцировки клеток важнейшую роль играют внутриклеточные сигнальные каскады, в частности система митогенактивируемых протеинкиназ (МАРК) [2]. Например, MAPK группы ERK индуцируют передачу сигналов к дифференцировке [6].
Ключевым игроком в реализации эпигенетических программ миогенной дифференцировки является р38 МАРК. Активация р38 МАРК необходима для инициации миогенной дифференцировки миобластов в период эмбриогенеза [3, 6]. В постнатальный период его роль изучена значительно меньше. Из четырех изоформ р38 (p38alpha, p38beta, p38gamma и p38delta), обнаруженных в клетках млекопитающих, p38alpha и p38gamma наиболее выраженно экспрессируются в скелетных мышцах в постнатальный период. Установлено, что регенерация и рост мышечного волокна у взрослых мышей протекает с одинаковой эффективностью как у мышей, лишенных p38beta, p38gamma и p38delta, как у контрольных мышей дикого типа. Поэтому считают, что влияние на миогенез в постнатальный период оказывает именно p38alpha изоформа [10].
Считают, что активация р38 МАРК в миогенных клетках-предшественниках является ключевым сигналом для их выхода из клеточного цикла и перехода пролиферирующих миосателлитных клеток к терминальной дифференцировке с экспрессией мышечноспецифичных генов: у данных клеток наблюдается снижение экспрессии Pax7, активация миогенных факторов транскрипции MyoD и Mef2. Таким образом, идентификация сигнального механизма, который активирует p38 МАРК во время этого процесса имеет важное значение для понимания механизма регуляции регенерации мышц [4, 7, 8, 13].
Целью работы является изучение динамики активности сигнальных каскадов MAPK в процессе регенерации поперечнополосатых скелетных мышц.
Материал и методы
Моделирование травматического повреждения. Крысам самцам линии Wistar в асептических условиях в условиях операционной под кетаминовым наркозом (кетамин – 50 мг/кг, дроперидол – 0.5 мг/кг, атропин – 0.15 мг/кг) выполняли травматическое повреждение четырехглавой мышцы бедра (m. quadratusfemoris) путем ее продольного рассечения, длиной 2 см. Осуществляли тщательный гемостаз. Эксперимент выполнялся в соответствии с нормами гуманного обращения с животными, которые регламентированы «Правилами проведения работ с использованием экспериментальных животных» (Приложение к приказу Министерства здравоохранения СССР от 12.08.1977 г. № 755) согласно протоколу, одобренному Комитетом по этике ФГБНУ ИНЦХТ. Всего в экспериментах использовано 30 животных. Выведение животных из эксперимента осуществляли на 3, 5, 9, 14, 21 и 35 сутки декапитацией после введения кетамина внутрибрюшинно.
Для исследования забирали фрагмент мышечной ткани из зоны травматического повреждения, для гистологического исследования материал фиксировали раствором FineFix (Milestone, Италия), заливали в парафиновые блоки, изготавливали серийные срезы толщиной 5 мкм. Оценку гистологической картины проводили методом световой микроскопии с использованием стандартных окрасок гематоксилин-эозином. Проводили фотодокументирование изображений. Морфометрию проводили с использованием программы Image J Национального института здоровья (США) с набором модулей для медицинской морфометрии от Wayne Rasband. Применяли планиметрический метод в модификации с использованием подсчёта элементов на 1 микрофотографии. Подсчёт морфологических элементов производили с использованием плагина «Cellscounter» для «Image J» на микрофотографии, полученной при регистрации изображения через объектив 40х и фоторегистрирующую систему Nikon с 5 МПикс сенсором размером 2/3''.
Проводили иммуногистохимическое окрашивание [11, 12] срезов. В качестве первичных антител применяли p44 MAPK (Erk1) (MAPK3) RabbitMonoclonalAntibody (Epitomics, CloneID :EP4967, Cat. N 3739-1, Lot YH111626), JNK1Phospho (pT183) / JNK2 Phospho (pT183) / JNK3 Phospho (pT221) (MAPK10) Rabbit Monoclonal Antibody (Epitomics, Clone ID : EPR5693, Cat. N 3893-1, Lot YH122306C), p53 Phospho (pS392) (TP53) Rabbit Monoclonal Antibody (Epitomics, Clone ID : EP1554, Cat. N 1644-1, Lot YD051702R), Stat-3 Phospho (pY705) (STAT3) Rabbit Monoclonal Antibody (Epitomics, Clone ID : EP2147Y, Cat. N 2236-1, Lot YI042808D), p38 MAPK Phospho (pT180/pY182) (MAPK14) Rabbit Monoclonal Antibody (Epitomics, Clone ID : E229, Cat. N 1229-1, LotYH080601C).
Для оценки динамики регенераторного процесса использовалось непараметрическое множественное сравнение групп с использованием критерия Манна – Уитни. Различия считались значимыми при p<0.05.
Результаты
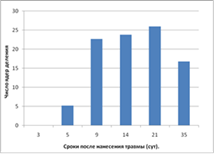
Нами установлено, что посттравматическая регенерация мышцы начиналась на 5 сутки после нанесения повреждения. Интенсивность пролиферации миосателлитов была максимальной с 9 по 21 сутки (рис. 1). В последний срок наблюдения процесс активность регенерации снижалась.
|
|
Рис.1. Интенсивность пролиферации миосателлитов. |
|
|
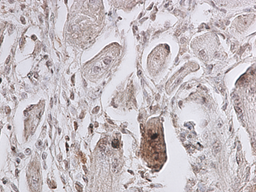
Рис. 2. 3 сутки эксперимента. Экспрессия p38 MAPK Phospho в области травматического повреждения мышцы, ув. 400 х. |
|
|
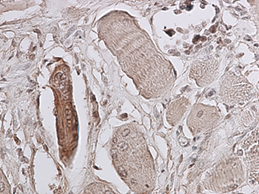
Рис. 3. 9 сутки эксперимента. Экспрессия p38 MAPK Phospho в области травматического повреждения мышцы, окраска миосателлитов, ув. 400 х. |
|
|
Рис. 4. 5 сутки эксперимента. Экспрессия JNK Phospho в области травматического повреждения мышцы, яркое окрашивание растущих мышечных почек, ув. 400 х. |
|
|
Рис. 5. 9 сутки эксперимента. Экспрессия JNK Phospho в области травматического повреждения мышцы, яркое окрашивание вновь образованных мышечных почек, отсутствие окраски более зрелых мышечных почек, ув. 400 х.
|
Нами изучена экспрессия активности МАР-киназных каскадов при заживлении мышечной раны. Исследованы каскады р38 (активная фосфорилированная часть каскада – маркер – p38 MAPKPhospho (pT180/pY182) (MAPK14) RabbitMonoclonalAntibody (Epitomics)), активная фосфорилированная часть каскада JNK (маркер - JNK1 Phospho (pT183) / JNK2 Phospho (pT183) / JNK3 Phospho (pT221) (MAPK10) RabbitMonoclonalAntibody (Epitomics)), ERK каскад (маркер - p44 MAPK (Erk1) (MAPK3) RabbitMonoclonalAntibody (Epitomics)), а также активные формы сигнальных белков, участвующих в передаче сигналов в ядро клетки – p53 Phospho (pS392) (TP53) и Stat-3 Phospho (pY705) (STAT3).
Поскольку экспрессия данных маркеров тесно связана с функциональной активностью клеток, логично ожидать ее изменение в динамике репаративного процесса.
Установлено, что активность p38 MAPK каскада, регистрируемая по фосфорилированной его форме, повышается с первого срока, включенного в исследование (3 суток). Причём положительную окраску на p38-phospho имеют единичные миосателлиты в зоне травматического повреждения мышцы. В интактной мышце специфическое окрашивание не регистрируется. На 5 и 9 сутки также положительно окрашивались единичные миосателлиты в зоне, непосредственно прилегающей к месту травматического повреждения (рис. 2 и 3). В более поздние сроки наблюдения специфическая окраска мышцы в зоне травматического повреждения не зафиксирована.
Изучение активации JNK каскада показало, что его активная фосфорилированная форма в зоне травматического повреждения мышцы выявлялась с 3 по 9 сутки после травмы. На 3 сутки ярко окрашивалась цитоплазма части мышечных волокон в области повреждения. На 5 сутки JNK-phospho в значительных количествах определяется в растущих мышечных почках. На 9 сутки окрашивались только вновь образованные мышечные почки, в то время как более «зрелые» не демонстрировали положительной иммуногистохимической окраски (рис. 4 и 5). В последующие сроки специфическая окраска на JNK-phospho не зарегистрирована.
Активация ERK каскада, оцененная по экспрессии p44 MAPK (Erk1) (MAPK3), в зоне травматического повреждения мышцы отмечена только на 5 сутки после травмы – в этот срок специфично окрашивались единичные миосателлиты в зоне, прилегающей к месту повреждения и вновь образованные мышечные почки. В последующие сроки специфической окраски мышечной ткани не зафиксировано.
Окраска на p53 Phospho (pS392) (TP53), Stat?3 Phospho (pY705) (STAT3) не выявила специфического окрашивания мышечной ткани во все сроки наблюдения.
Таким образом, установлены сроки активации МАР-киназных каскадов при травматическом повреждении мышечной ткани. Определен дополнительный маркер активированных миосателлитов, вступающих в фазу пролиферации – р38phospho.
Установлено, что посттравматическая регенерация мышц начинается на 5 сутки после нанесения повреждения с максимальной интенсивностью пролиферации миосателлитов с 9 по 21 сутки. Определено, что фосфорилированная форма p38 МАРК присутствует в единичных миосателлитах на с 3 по 9 сутки после травмы, что соответствует периоду активации и пролиферации миосателлитов.
Экспрессия фосфорилированной формы JNK в мышечных волокнах вблизи места повреждения отмечена на 3 сутки, на 5 сутки обнаружена активация данного каскада в мышечных почках, что позволяет предположить участие фосфорилированной формы JNK в активации и пролиферации миосателлитов.
Выводы:
1. Посттравматической регенерации мышц начинается на 5 сутки после нанесения повреждения с максимальной интенсивностью пролиферации миосателлитов с 9 по 21 сутки.
2. Фосфорилированная форма p38 МАРК присутствует в единичных миосателлитах на с 3 по 9 сутки после травмы, что соответствует периоду активации и пролиферации миосателлитов. В мышечных почках экспрессия фосфорилированной формы p38 не наблюдалась.
3. Экспрессия фосфорилированной формы JNK в мышечных волокнах вблизи места повреждения отмечена на 3 сутки, на 5 сутки обнаружена активация данного каскада в мышечных почках, что позволяет предположить участие фосфорилированной формы JNK в активации и пролиферации миосателлитов.
4. Активация сигнального каскада p44 наблюдалась только на пятые сутки после нанесения травмы.
5. Активация p53 и STAT3 не была зафиксирована нами в ходе эксперимента.
Библиографическая ссылка
Шурыгина И.А., Дремина Н.Н., Шаульская Е.С., Шурыгин М.Г. АКТИВНОСТЬ МИТОГЕНАКТИВИРУЕМЫХ СИГНАЛЬНЫХ КАСКАДОВ ПРИ ТРАВМЕ ПОПЕРЕЧНОПОЛОСАТОЙ МЫШЦЫ // Современные проблемы науки и образования. 2016. № 5. ;URL: https://science-education.ru/ru/article/view?id=25406 (дата обращения: 14.02.2026).