Окислительный стресс является базовым патофизиологическим механизмом повреждения головного мозга [8]. Гиперпродукция реакционно-активных свободных радикалов кислорода (РФК) сопровождается нарушением работы важных редокс-чувствительных ферментных систем, ДНК, мембранных рецепторов, ионных каналов, фосфолипидов мембран, а также активации каспазного механизма апоптоза [4,10]. Исходя из существенной роли оксилительного стресса в патогенезе повреждения головного мозга, важным защитным механизмом от окислительного повреждения является активация эндогенной антиоксидантной защиты [4–12]. Системы антиоксидантной защиты клетки могут быть классифицированы на ферментативные и неферментативные. Существует несколько ферментативных антиоксидантов, которые преобразуют РФК (О2.*-, *ОН) в менее токсичные соединения. Примерами таких систем могут служить: супероксиддисмутаза (СОД), глутатионпероксидаза (ГП), каталаза. В совокупности эти ферменты обеспечивают первую линию обороны от действия О2.*-и *ОН [7].
Медь-цинк зависимая супероксиддисмутаза (CuZn-СОД, СОД1) обеспечивает систему защиты от окислительного стресса путем усиления дисмутации О2.*- в О2 и Н2О2. Литературные данные показывают, что гипреэкспрессия СОД1 предотвращает нейрональную гибель в области CA1 гиппокампа. Однако чрезвычайно короткий период полураспада СОД1 в циркулирующей крови затрудняет использование ферментной терапии при повреждениях головного мозга [5,7].
Глутатионпероксидаза – еще один важный фермент эндогенной антиоксидантной защиты. В некоторых исследованиях показано, что ГП обеспечивает большую защиту от окислительного стресса, чем СОД. Экспрессия ГП, так же как и СОД, обеспечивает нейропротекторный эффект [11,12].
Каталаза, мембраносвязанный фермент, является важным элементом поддержания внутриклеточной концентрации восстановленного глутатиона и играет решающую роль в нейтрализации свободных радикалов [9]. Данные об изменении активности каталазы при повреждениях головного мозга носят противоречивый характер. С одной стороны, отмечается снижение уровня каталазы, а с другой, ее повышение [4,12].
Таким образом, исходя из высокой роли ферментов эндогенной антиоксидантной защиты в нейропротекции, применение средств, повышающих их активность, можно считать одной из основных стратегий фармакотерапии заболеваний, сопряженных с нейродефицитарным синдромом [5]. Одной из таких групп препаратов являются антиоксиданты – производные 3-оксипиридина, среди которых выделяется отечественный препарат с поливалентным механизмом действия – мексидол [1]. Особое место мексидол занимает в терапии заболеваний, сопровождающихся нейродегенеративными изменениями в головном мозге, в частности при острых нарушениях мозгового кровообращения [1] и черепно-мозговой травме [2]. Поэтому целью данного исследования явилась сравнительная оценка антиоксидантной активности мексидола на фоне ишемии головного мозга и при черепно-мозговой травме.
Материалы и методы
Исследование выполнено на 60 крысах – самцах линии Wistar. Повреждение головного мозга воспроизводили на 2-х экспериментальных моделях. Первая модель – правосторонняя окклюзия средней мозговой артерии (ОПСМА) предполагает ишемическое повреждение мозговой ткани, по типу ишемического инсульта. Вторая – модель черепно-мозговой травмы (ЧМТ) опосредует травматическое повреждение головного мозга. Соответственно этому данное исследование было разделено на 2 серии экспериментов. В 1-й серии проводили оценку влияния мексидола на состояние про/антиоксидантного равновесия на модели ОПСМА. Во 2-й оценивали аналогичные 1-й серии параметры, но на модели ЧМТ. В каждой серии исследований были сформированы следующие экспериментальные группы (n=10 каждая группа) животных: ложнооперированная группа крыс (Л/О), группа животных негативного контроля (НК) и крысы, получавшие perosмексидол (ФАРМАСОФТ, Россия) в дозе 30 мг/кг [3]. ОПСМА воспроизводили под местом пересечения средней мозговой артерии с обонятельным трактом методом коагуляции. Оперативное вмешательство проводили под хлоралгидратной анестезией (350мг/кг). На предварительно депилированной коже (участок 2см2 ниже и правее глаза) делали надрез. Затем разделяли мышцы, удаляли отросток скуловой кости. Специально сконструированным бором делали трепанационное отверстие в черепной коробке над местом пересечения средней мозговой артерии с обонятельным трактом. Затем с использованием десмокоагулятора собственной конструкции осуществляли коагуляцию (пережигание) средней мозговой артерии, под местом ее пересечения с обонятельным трактом. ЧМТ моделировали методом свободного падения груза массой 150 г с высоты 50 см. По истечении 3-х суток при моделировании ОПСМА и 7-ми суток при моделировании ЧМТ животных декапитировали под хлоралгидратным наркозом (350 мг/кг), извлекали головной мозг. В гомогенате головного мозга определяли содержание диеновых конъюгатов – ДК [В.Б Гаврилов,1983] и малонового диальдегида – МДА [И.Д. Стальная, 1977]. В постъядерной фракции головного мозга крыс оценивали активность ферментов эндогенной антиоксидантной защиты (АОЗ): супероксиддисмутазы (СОД) [В.Н Чумаков,1977], глутатионпероксидазы (ГП) [Pierce, S,1978] и каталазы [М.А. Королюк, 1988].
Результаты опытов обрабатывали методом вариационной статистики с использованием пакета прикладных программ STATISTICA 6.0 (StatSoft, Inc., США для операционной системы Windows). Вычисляли среднее значение и стандартную ошибку среднего значения (M±m). Полученные данные проверяли на нормальность распределения с использованием критерия Шапиро – Уилка. В случае нормального распределения данных для сравнения средних использовали t-критерий Стьюдента. При ненормальном распределении результатов эксперимента дальнейшую статистическую обработку данных проводили с использованием U-критерия Манна – Уитни. Различия считались статистически значимыми при (p<0,05).
Результаты и обсуждение
При ишемическом повреждении головного мозга у крыс группы негативного контроля по сравнению с ложнооперированными животными отмечено повышение содержания МДА и ДК (рис. 1) на 163 % (p<0,05) и 165,5 % (p<0,05) соответственно. Также у НК группы крыс в результате ОПСМА снизилась активность ферментов эндогенной антиоксидантной защиты (рис. 2, рис.3): СОД – в 16,3 раза (p<0,05), ГП – в 6,5 раза (p<0,05), каталазы – в 5,8 раза (p<0,05).
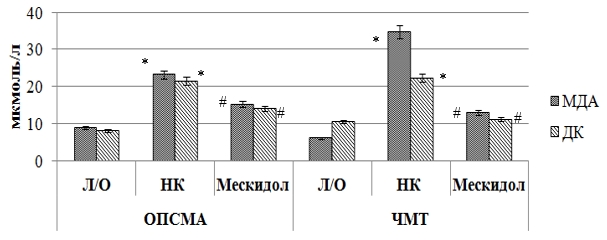
Рис. 1.Влияние мексидола на процесс накопления в ткани головного мозга крыс малонового диальдегида и диеновых конъюгатов при ОПСМА и ЧМТ
Примечание:
* – статистически значимо относительно группы ложнооперированных животных (p<0,05),
# – статистически значимо относительно группы крыс негативного контроля (p<0,05).
В условиях ишемии головного мозга применение мексидола способствовало восстановлению про/антиоксидантного баланса, что подтверждается снижением содержания МДА и ДК у крыс, получавших мексидол, по отношению к НК группе животных на 52,6 % (p<0,05) и 54 % (p<0,05) соответственно. Также на фоне применения мексидола у крыс с ОПСМА увеличилась (относительно группы крыс негативного контроля) активность СОД в 15,5 раза (p<0,05), ГП – в 4,2 (p<0,05) раза и каталазы – в 3,1 (p<0,05) раза.
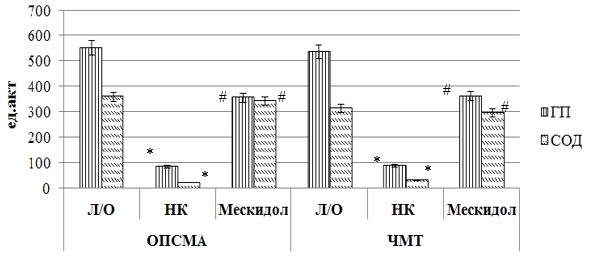
Рис. 2. Влияние мексидола на активность супероксиддисмутазы и глутатионпероксидазы в ткани головного мозга крыс при ОПСМА, и ЧМТ
Примечание:
* – статистически значимо относительно группы ложнооперированных животных (p<0,05),
# – статистически значимо относительно группы крыс негативного контроля (p<0,05).
Экспериментально смоделированная черепно-мозговая травма привела к развитию у крыс явления оксидативного стресса, что выражается в снижении активности ферментов эндогенной антиоксидантной защиты и повышении содержания МДА и ДК. у данной группы крыс относительно ложнооперированных животных. Так, у крыс с ЧМТ и без фармакологической поддержки концентрация МДА и ДК (рис.1) превысила аналогичные значения Л/О группы животных в 5,7(p<0,05) раза и 112,4 % (p<0,05) соответственно, активность ферментов СОД, ГП (рис. 2) и каталазы (рис. 3) у крыс НК группы была соответственно ниже, чем у ложнооперированных животных в 10,5 (p<0,05) раза, 6 (p<0,05) раз и 4,4 раза.
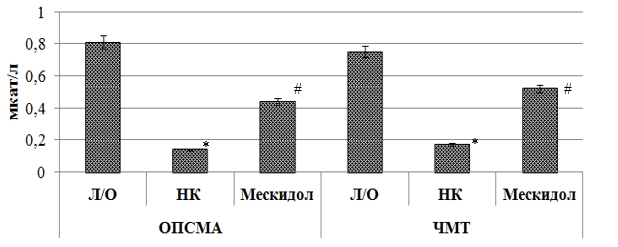
Рис. 3. Влияние мексидола на активность каталазы в ткани головного мозга крыс при ОПСМА и ЧМТ
Примечание:
* – статистически значимо относительно группы ложнооперированных животных (p<0,05),
# – статистически значимо относительно группы крыс негативного контроля (p<0,05).
Применение мексидола на фоне ЧМТ способствовало сохранению активности ферментов эндогенной АОЗ, что находит свое отражение в повышении относительно НК группы крыс активности СОД, ГП и каталазы в 9,9 (p<0,05) раза, 4,1 (p<0,05) раза и 3,1 (p<0,05) раза соответственно. Также при применении мексидола у крыс с ЧМТ наблюдалось снижение (по сравнению с группой крыс негативного контроля) содержания МДА и ДК на 169,7 % (p<0,05) и 101,1 % (p<0,05) соответственно. Полученные в ходе исследования результаты согласуются с ранее проведенными исследованиями, посвященных оценке антиоксидантных свойств мексидола [1].
Антиоксидантный эффект является одним из важных аспектов механизма действия мексидола. Именно наличие антиоксидантных свойств определяет возможность применения данного лекарственного препарата при нейродегенеративных заболеваниях, таких как: деменция, болезнь Альцгеймера, дискурляторная энцефалопатия, что немаловажно для неврологической практики [1].
Выводы
1. Экспериментально смоделированная ишемия головного мозга, как и экспериментально вызванная черепно-мозговая травма, вызывает у крыс смещение про/антиоксидантного баланса в сторону образования прооксидантов, что подтверждается повышением содержания продуктов (малоновый диальдегид и диеновые конъюгаты), характеризующих интенсификацию окислительных процессов. Также при данных состояниях отмечено снижение активности ферментов супероксиддисмутазы, каталазы и глутатионпероксидазы.
2. Применение мексидола в дозе 30 мг/кг в обоих случаях способствовало восстановлению баланса в системе прооксиданты/антиоксиданты. Данный факт повреждается увеличением (по сравнению с группой крыс, не получавших фармакологическую поддержку) активности ферментов СОД, ГП и каталазы на фоне ишемии головного мозга соответственно в 9,9 (p<0,05) раза, 4,1 (p<0,05) раза и 3,1 (p<0,05). На фоне черепно-мозговой травмы активность указанных ферментов также мела тенденцию к увеличению. Содержание прооксидантов (МДА и ДК) при применении мексидола снижалось в обоих случаях.
3. Мексидол в дозе 30 мг/кг в равной степени проявляет антиоксидантные свойства, как на фоне ишемии головного мозга, смоделированной постоянной окклюзией средней мозговой артерии, так и на фоне черепно-мозговой травмы, воспроизведенной методом свободного падения груза.
Библиографическая ссылка
Воронков А.В., Поздняков Д.И., Хури Е.И., Рыбалко А.Е. СРАВНЕНИЕ АНТИОКСИДАНТНОЙ АКТИВНОСТИ МЕКСИДОЛА ПРИ ПОВРЕЖДЕНИЯХ ГОЛОВНОГО МОЗГА РАЗЛИЧНОГО ГЕНЕЗА В ЭКСПЕРИМЕНТЕ // Современные проблемы науки и образования. 2016. № 6. ;URL: https://science-education.ru/ru/article/view?id=25392 (дата обращения: 06.01.2026).



