Несмотря на появление новых базисных материалов, основными для изготовления съемных зубных протезов являются пластмассы на основе различных производных акриловой и метакриловой кислот [3,4,6]. По данным отдельных авторов, при ортопедическом лечении пациентов съемными протезами от 72 до 80 % случаев используется акриловая мономерная пластмасса [1,2]. К сожалению, наряду с преимуществами акрилаты имеют целый ряд недостатков, связанных с явлениями непереносимости.
При использовании съемных протезов из мономерной акриловой пластмассы часто наблюдаются изменения слизистой оболочки протезного ложа воспалительного характера, связанные с воздействием микроорганизмов, содержащихся на поверхности базисов протезов, а также токсико-аллергическим воздействием материала базиса протеза. А.М. Сафаров (2010) отмечает, что до 55 % осложнений приходится на протезные стоматиты микробного генеза.
Поэтому разработка новых базисных материалов для изготовления съемных зубных протезов остается весьма актуальной.
Целью нашей работы явилось оценка биосовместимости традиционного базисного материала для изготовления съемных зубных протезов «Фторакс» и модифицированного нами базисного материла, содержащего наночастицы серебра на культуре дермальных фибробластов человека invitro.
Материал и методы исследования. Для обеспечения бактерицидных свойств съемного акрилового протеза мы использовали наночастицы серебра (патент РФ №103467).
Суть изготовления пластмассового съемного протеза, содержащего наночастицы серебра, состоит в следующем. Перед смешиванием мономера и полимера (порошка) проводят насыщение полимера наночастицами серебра. Для этого в необходимое количество полимера добавляют коллоидный раствор наночастиц серебра необходимой концентрации, например 20 мг/л. Объем раствора коллоидного наносеребра рассчитывается из необходимой концентрации серебра в полимере с учетом размеров его наночастиц. Далее полимер с коллоидным раствором наночастиц серебра перемешивают и помещают в эксикатор для сушки. Сушку проводят при температуре 50–60 ° под вакуумом до полного испарения воды. Затем сухой наполненный серебром полимер традиционным способом смешивают с мономером. Так получают пластмассовое тесто для изготовления съемных зубных протезов.
Для определения цитотоксичности по отношению к дермальным фибробластам в культуре проведено тестирование традиционного базисного материала для изготовления съемных зубных протезов «Фторакс» и модифицированного нами базисного материала, содержащего 0,2 % наночастиц серебра. Кроме этого, дополнительно было проведено тестирование 0,2 % коллоидного раствора наночастиц серебра.
Тестирование проведено на культуре дермальных фибробластов человека 7 пассажа методом прямого контакта. Фибробласты человека – это общепринятая стандартная культура для тестирования материалов и препаратов.
Все работы с культурой проводили в ламинарных боксах БАВп-01 «Ламинар-С» (ЗАО «Ламинарные системы», Миасс, РФ).
Поставлено 3 серии экспериментов: 1 – определение цитотоксичности исследуемых образцов на фибробластах, 2 – определение адгезивной способности фибробластов в присутствии исследуемых материалов, 3 – определение пролиферативной активности фибробластов в присутствии исследуемых образцов.
Определение цитотоксичности осуществляли при помощи ЛДГ-теста (лактатдегидрогеназа). Дермальные фибробласты высевали в лунки 12-луночных планшетов с плоским дном квалификации «для культур клеток» («Orange Scientific», Бельгия). Культивировали клетки при 37 ºС и постоянной влажности в условиях СО2-инкубатора (Sanyo – Incubator, MCO-18 A, Япония) с использованием полной ростовой среды (среда 199 с добавлением 10 % эмбриональной телячьей сыворотки – ООО «Биолот», Россия). Образцы исследуемых материалов помещали на монослой по достижении конфлуентности, после чего продолжали культивирование в течение 48 часов.
Активность ЛДГ определяли по убыли NADH в ходе реакции превращения пирувата в лактат:
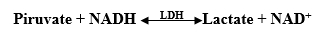
Количество поврежденных клеток (DC) определяли как отношение активности ЛДГ в среде к суммарной активности ЛДГ в лизате и в ростовой среде и выражали в процентах:
DC (%) = (LDHm / LDHl + LDHm) х 100.
В каждом эксперименте задействовано по 10 образцов каждого вида материала и 3 контрольных культуры. Достоверность полученных данных оценивалась по U-критерию.
Адгезивную способность фибробластов проводили с использованием специальных 4-камерных стекол для культур клеток (BDFalkon).
В каждую камеру помещали один образец исследуемого базисного материала размером 3х3х2 мм (объем 18 мм3) или одну дозу (18 мкл) 0,2 % коллоидного серебра (в соответствии с ГОСТ ISO 10993-1-2011). Выращенные в пластиковых флаконах фибробласты снимали со дна флаконов стандартным способом (при помощи 0,25% раствора трипсина и 0,02 % раствора Версена – ООО «БиолоТ», РФ) и пересевали на стекла. Посевная доза составляла 1х104кл./см2. Дальнейшее культивирование проводили в полной ростовой среде следующего состава: среда 199 – 90 %, эмбриональная телячья сыворотка – 10 % (среда и сыворотка – ООО «БиолоТ», РФ), гентамицин – 40 мкг мл. Через 24 часа клетки снимали со дна культурального пластика стандартным способом и считали при помощи ручного автоматического счетчика клеток Scepter (Millipore, США). Индекс адгезии (IA) рассчитывали по формуле и выражали в процентах (%):
IA = (Nt / N1) х 100
Определение пролиферативной активности фибробластов в присутствии исследуемых образцов также проводили с использованием 4-камерных стекол для культур клеток (BDFalkon). Посев фибробластов и их дальнейшее культивирование осуществляли аналогично опыта 2. Через 24 часа, после того как клетки равномерно адгезировались к стеклам и образовали контакты между собой, в камеры осторожно, чтобы не повредить монослой, помещали исследуемый материал. Длительность эксперимента с момента помещения материала на монослой – 4 суток.
Пролиферативную активность клеток характеризовали на основании следующих показателей: индекс пролиферации, время удвоения культуры и количество удвоений.
Культура дермальных фибробластов выращена из биоптата кожи донора и перед исследованием идентифицирована: с помощью морфологических и биохимических методов установлено, что клетки являются детерминированными и принадлежат к фибробластическому дифферону; кариотипирование показало, что клетки являются диплоидными и имеют 46 хромосом. Обследование методом ПЦР (полимеразная цепная реакция) показало отсутствие контаминации культуры инфекционными агентами, в том числе микоплазмами и ЦМВ (цитомегаловирус).
Статистическая обработка результатов ЛДГ-теста произведена с использованием U-критерия Манна – Уитни, морфометрических данных – по Стьюденту.
Результаты и обсуждения. Биохимическое определение активности ЛДГ в составляющих тестовой системы (фибробластах монослоя и культуральной среде) показало, что суммарная активность этого фермента при культивировании клеток в присутствии исследуемых базисных материалов практически не отличалась от контроля. Воздействие 0,2 % коллоидного раствора наночастиц серебра (18 мкл) приводит к достоверному уменьшению этого показателя (суммарная ЛДГ культуры ниже, чем в контроле, в среднем в 1,69 раза). Количественные данные приведены в таблице 1.
Таблица 1
Активность ЛДГ в культуре фибробластов в присутствии тестируемых материалов (нМ/мин)
|
Статистические показатели |
Контрольная культура |
Культура с традиционным базисным материалом «Фторакс» |
Культура с разработанным базисным материалом, содержащим наночастицы серебра |
Культура с коллоидным раствором наночастиц серебра |
|
Среднее |
9,29 |
7,85 |
8,68 |
5,49 |
|
n |
5 |
5 |
5 |
5 |
|
р |
>0,05 |
>0,05 |
<0,05 |
Процентное содержание поврежденных клеток в тестовой системе, определенное как процент активности ЛДГ в культуральной среде от общей активности, отражено в таблице 2. Как видно из нее, этот показатель в присутствии как традиционного базисного материала, так и разработанного нами базисного материала, содержащего наночастицы серебра, не отличается достоверно от такового в контрольной культуре, тогда как под действием 0,2 % коллоидного раствора наночастиц серебра (18 мкл) он значительно возрастает.
Таблица 2
Процентное содержание поврежденных клеток в монослое
|
Статистические показатели |
Контрольная культура |
Культура с традиционным базисным материалом «Фторакс» |
Культура с разработанным базисным материалом, содержащим наночастицы серебра |
Культура с коллоидным раствором наночастиц серебра |
|
Среднее |
6,13 |
2,75 |
5,85 |
17,90 |
|
n |
5 |
5 |
5 |
5 |
|
р |
>0,05 |
>0,05 |
<0,05 |
Полученные результаты ЛДГ-теста свидетельствуют об угнетении роста культуры дермальных фибробластов 0,2 % коллоидного раствора наночастиц серебра. Традиционный базисный материал для изготовления съемных зубных протезов «Фторакс» и модифицированный базисный материал, содержащий наночастицы серебра, не оказывают влияния на темпы роста культуры (результаты ЛДГ-теста недостоверно отличаются как от контроля, так и между собой).
Дермальные фибробласты человека в присутствии исследуемых образцов хорошо пристают ко дну культурального пластика. Индекс адгезии через 24 часа после посева клеток составляет: в контрольной культуре – 99 %; в присутствии традиционного базисного материала «Фторакс» – 84 %; в присутствии модифицированного нами базисного материала, содержащего наночастицы серебра – 69,8 %; в присутствии 0,2 % коллоидного раствора наночастиц серебра – 98,8 %. Вместе с тем в эксперименте с коллоидным серебром обращает внимание несколько большее количество отдельно расположенных, не контактирующих с другими клеток. Некоторые из них имеют неправильную форму, короткие отростки и грубозернистую цитоплазму.
Помещение исследуемых базисных материалов для изготовления съемных зубных протезов на сформировавшийся монослой фибробластов не приводит к достоверным изменениям пролиферативной активности этих клеток. На протяжении всего эксперимента клетки в основном сохраняют присущие дермальным фибробластам человека форму, размеры, характер роста, расположение и размеры ядер, структуру цитоплазмы (рис.1, 2).
Плотность монослоя в непосредственной близости от образцов не отличалась от таковой в отдаленных зонах. Вместе с тем к концу эксперимента с разработанным базисным материалом, содержащим наночастицы серебра, в монослое появляются отдельные мелкие участки, в которых нарушается взаимное расположение клеток и ослабляются контакты между ними (рисунок 1Б). На окрашенных препаратах это также проявляется в виде некоторого разрежения монослоя и разобщения клеток, однако цитоплазма фибробластов остается гомогенной, ядра сохраняют форму, размеры и структуру (рисунок 3).
 А
А 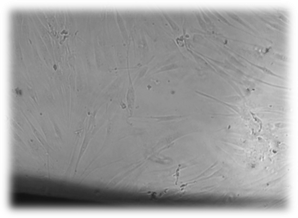 Б
Б
Рис. 1. Культивирование дермальных фибробластов в присутствии исследуемых материалов (А – базисного материала «Фторакс»; Б – модифицированный базисный материал, содержащий наночастицы серебра) 2 суток эксперимента. Нативный микропрепарат. Инвертированный микроскоп. Фазовый контраст. Об-в 10х, ок. 10х
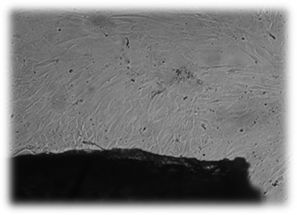 А
А 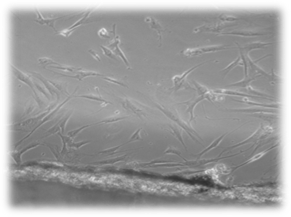 Б
Б
Рис. 2. Культивирование дермальных фибробластов в присутствии исследуемых материалов (А – базисного материала «Фторакс»; Б – модифицированный базисный материал, содержащий наночастицы серебра) 4 суток эксперимента. Нативный микропрепарат. Инвертированный микроскоп. Фазовый контраст. Об-в 10х, ок. 10х
То же самое можно сказать и о соотношении жизнеспособных (живых) и поврежденных клеток в монослое: этот показатель практически не отличается в экспериментах с тестированием базисных материалов (рисунок 4; таблица 3, 4).
Несколько иная картина наблюдается при тестировании коллоидного раствора наночастиц серебра. Уже в 1 сутки после совместного культивирования можно отметить незначительное разрежение монослоя. В культуральной появляются плавающие клетки, которые открепились со дна культурального пластика. В дальнейшие сутки отмечалось дальнейшее разрежение монослоя, клетки на дне находятся разрозненно друг от друга, не соединяются отростками между собой. Изменяется форма и размеры отдельных клеток (рисунок 5). На окрашенных препаратах вокруг ядер отдельных клеток видны кольцеобразно расположенные капли жира (в соответствии с рисунком 6А), что отражает развитие начальной стадии дистрофических процессов в клетках монослоя.
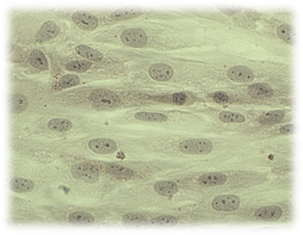 А
А 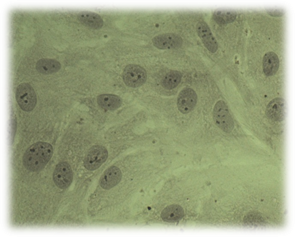 Б
Б
Рис. 3. Культивирование дермальных фибробластов в присутствии исследуемых материалов (А – базисного материала «Фторакс»; Б – модифицированный базисный материал, содержащий наночастицы серебра) 4 суток эксперимента. Окраска суданом IV и гематоксилином. Об-в 40х, ок. 10х
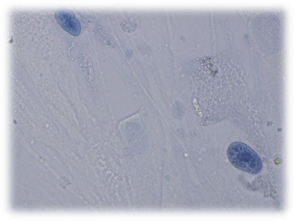 А
А 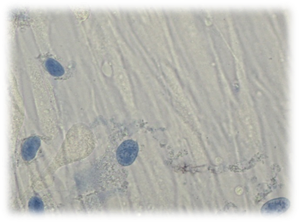 Б
Б
Рис. 4. Культивирование дермальных фибробластов в присутствии исследуемых материалов (А – базисного материала «Фторакс»; Б – модифицированный базисный материал, содержащий наночастицы серебра) 4 суток эксперимента. Окраска трипановым синим. Об-в 40х, ок. 10х
Об угнетении пролиферации свидетельствуют уменьшение пролиферативного индекса и увеличение времени удвоения (таблица 5.5). В монослое – большое количество поврежденных клеток (рисунок 6Б, таблица 5). В то же время в монослое присутствует достаточное количество жизнеспособных клеток на разных стадиях митоза.
Таблица 3
Характеристики культур фибробластов при совместном культивировании с традиционным базисным материалом «Фторакс»
|
Показатели |
Исходные данные |
1 сут эксперимента |
2 сутэксперимента |
3 сутэксперимента |
4 сутэксперимента |
||||
|
Контроль |
Опыт |
Контроль |
Опыт |
Контроль |
Опыт |
Контроль |
Опыт |
||
|
Плотность монослоя, кл/1мм2 |
97,05±0,7 |
200,5±0, 5 |
197,07±0,997 |
400±6,1 |
385,81± 4,2 |
708±1,6 |
703,28±0,95 |
1250,03±0,45 |
1193,78±0,4 |
|
Индекс пролиферации, отн. ед. |
2,06 |
2,02±0,1 |
2,0 ±0,3 |
1,95±0,02 |
1,77±0,2 |
1,814±0,02 |
1,77 ±0,1 |
1,69±0,004 |
|
|
Время удвоения, ч |
22,9±1,1 |
23,46±1,4 |
24,1±0,5 |
24,89±0,5 |
27,4±0,6 |
27,66±0,2 |
29,3±0,2 |
31,39±0,5 |
|
|
Живые//поврежденные клетки, % |
96,4±0,5// 3,6±0,5 |
91,6±1,0// 8,4±1,2 |
97,2±0,8// 2,8 ±0,8 |
89,0±0,8// 11,0±0,8 |
95,6±0,8// 4,4±0,8 |
92,2±1,4// 7,8±1,4 |
95,9±0,8// 4,1±0,9 |
90,2±0,8// 9,8 ±1,0 |
|
Таблица 4
Характеристики культур фибробластов при совместном культивировании с модифицированным базисным материалом, содержащим наночастицы серебра
|
Показатели |
Исходные данные |
1 сут эксперимента |
2 сут эксперимента |
3 сут эксперимента |
4 сут эксперимента |
||||
|
Контроль |
Опыт |
Контроль |
Опыт |
Контроль |
Опыт |
Контроль |
Опыт |
||
|
Плотность монослоя, кл/1 мм2 |
97,05±0,7 |
200,5±0, 5 |
198,07± 0,3 |
400±6,1 |
392± 4,2 |
708±1,6 |
701,4 ±0,5 |
1250,03±0,45 |
1150±0,4 |
|
Индекс пролиферации,отн.ед. |
2,06 |
2,04±0,1 |
2,0 ±0,3 |
1,98±0,02 |
1,77±0,2 |
1,78 ±0,02* |
1,77 ±0,1 |
1,64±0,02 |
|
|
Время удвоения, ч |
22,9±1,1 |
23,4±0,6 |
24,1±0,5 |
24,8±0,2 |
27,4±0,6 |
28,8±0,2 |
29,3±0,2 |
34,4±0,5 |
|
|
Живые// поврежденные клетки, % |
96,4±0,5 // 3,6±0,5 |
93,6±1,0// 5,4±1 |
97,2±0,8// 2,8 ±0,8 |
87,0±1// 12,0±1 |
95,6±0,8// 4,4±0,8 |
95,2±1,4// 2,8±1,6 |
95,9±0,8// 4,1±0,9 |
89,2±0,8// 9,4 ±0,6 |
|
Таблица 5
Характеристики культур фибробластов при совместном культивировании с коллоидным раствором наночастиц серебра
|
Показатели |
Исходные данные |
1 сут эксперимента |
2 сут эксперимента |
3 сут эксперимента |
4сут эксперимента |
||||
|
Контроль |
Опыт |
Контроль |
Опыт |
Контроль |
Опыт |
Контроль |
Опыт |
||
|
Плотность монослоя, кл/1мм2 |
97,05±0,7 |
200,5±0, 5 |
195±0,9 |
400±6,1 |
291± 2** |
708±1,6 |
340±0,95** |
1250,03±0,45 |
580±0,4 |
|
Индекс пролиферации, отн. ед. |
2,06±0,4 |
2,0±0,1 |
2,0 ±0,3 |
1,4 ±0, 2* |
1,77±0,2 |
1,1±0,02* |
1,77 ±0,1 |
1,7±0,04** |
|
|
Время удвоения, ч |
22,9±1,1 |
23,46±1,4 |
24,1±0,5 |
41,49±0,5*** |
27,4±0,6 |
103±0,2** |
29,3±0,2 |
31,4±0,5*** |
|
|
Живые// поврежденные клетки, % |
95,4±0,5// 3,6±0,5 |
91,6±0,8// 7,4±1,2 |
96,2±0,8// 2,8 ±0,2 |
60±0,8// 38,8 ±0,2 |
95,6±0,4// 3,4±0,6 |
40,8±1,2// 59,2±0,8 |
95,9±0,8// 3,1±0,1 |
40,8±0,2 // 58,2±0,8 |
|
Примечание: различия достоверны по сравнению с соответствующими значениями в контрольной группе при: * – р<0,05; ** – р<0,01; *** – р<0,001.
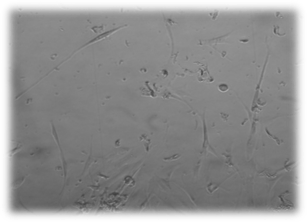 А
А 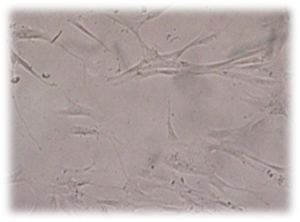 Б
Б
Рис. 5. Культивирование дермальных фибробластов в присутствии коллоидного раствора наночастиц серебра. (А – 2 суток; Б – 4 суток эксперимента). Нативный микропрепарат. Инвертированный микроскоп. Фазовый контраст. Об-в 10х, ок. 10х
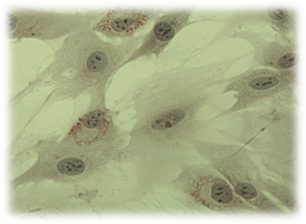 А
А 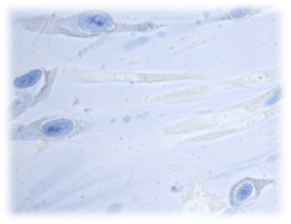 Б
Б
Рис. 6. Культивирование дермальных фибробластов в присутствии коллоидного раствора наночастиц серебра. 4 суток эксперимента. (А – Окраска суданом IV и гематоксилином; Б – Окраска трипановым синим). Об-в 40х, ок. 10х
Заключение. Таким образом, проведенные исследования по изучению взаимодействия базисных материалов для изготовления съемных зубных протезов на культуре дермальных фибробластов человека позволили сделать заключение, что традиционный базисный материал «Фторакс» для изготовления съемных зубных протезов и модифицированный нами базисный материал, содержащий наночастицы серебра, не являются цитотоксичными по отношению к дермальным фибробластам человека в культуре. Коллоидный раствор наночастиц серебра в указанной дозировке (0,2 %) оказывает слабое токсическое действие, которое, по-видимому, отражает бактерицидное действие препарата.
Библиографическая ссылка
Трунин Д.А., Садыков М.И., Волова Л.Т., Нестеров А.М., Россинская В.В., Болтовская В.В., Чистякова М.С. ОЦЕНКА БИОСОВМЕСТИМОСТИ БАЗИСНЫХ МАТЕРИАЛОВ ДЛЯ ИЗГОТОВЛЕНИЯ СЪЕМНЫХ ЗУБНЫХ ПРОТЕЗОВ НА КУЛЬТУРЕ ДЕРМАЛЬНЫХ ФИБРОБЛАСТОВ ЧЕЛОВЕКА IN VITRO // Современные проблемы науки и образования. 2016. № 5. ;URL: https://science-education.ru/ru/article/view?id=25390 (дата обращения: 14.02.2026).



