Среди дегенеративно-дистрофических заболеваний опорно-двигательного аппарата диспластический коксартроз занимает одно из ведущих мест. В основе данного заболевания лежит врожденное недоразвитие компонентов тазобедренного сустава, влекущее за собой значительный функциональный дефицит, ограничивающий как повседневную жизнь, так и трудовую деятельность [1]. По этой причине разработка современных технологий хирургической профилактики диспластического коксартроза имеет не только важное медицинское значение, но и социально-экономическое [2; 3].
В Саратовском научно-исследовательском институте травматологии и ортопедии ведутся на протяжении более двух десятков лет исследования, направленные на поиски новых конструктивных форм эндопротезов по принципу их биомеханической адекватности, способствующих улучшению исходов хирургического лечения диспластического коксартроза тазобедренного сустава на разных стадиях заболевания [4-7]. Разработанные при этом новый коррекционный протез тела безымянной кости с продольными пазами и способ внесуставной ацетабулопластики позволили перейти на новый уровень и качество лечения больных с дисплазией тазобедренного сустава за счет возмещения костного дефицита надацетабулярной области и реконструкции крыши вертлужной впадины при эндопротезировании тела подвздошной кости в сочетании с дополнительной костной аутопластикой. Этим достигается повышение прочности первичной фиксации эндопротеза в костном ложе и физиологичность коррекции крыши вертлужной впадины, а также стимуляция репаративной регенерации [8; 9].
Цель
Экспериментально обосновать применение коррекционного эндопротеза из никелида титана в сочетании с костной пластикой при хирургической профилактике диспластического коксартроза.
Материалы и методы
В работе использовали следующие методы исследования: экспериментальный, клинический, рентгенологический, морфологический, биохимический, статистический.
Эксперимент проводился на 20 беспородных собаках в возрасте от 10 месяцев до 2 лет. Животные были разделены на 4 группы по 5 особей по срокам вывода из эксперимента через 1, 3, 6 и 12 месяцев. У каждого животного хирургическим путем была сформирована гипоплазия передне-верхнего края вертлужной впадины одного из тазобедренных суставов по оригинальной технологии (пат. РФ № 2258960). Через месяц им было выполнено хирургическое вмешательство по поводу коррекции смоделированной диспластической вертлужной впадины под общим наркозом Sol. Ketamini 5% - 6 мл внутримышечно. В положении собаки на боку операционное поле трижды обрабатывали йодонатом. Производили разрез в проекции большого вертела длиной 5 см, послойно обнажая тазобедренный сустав. Отсекали передне-нижнюю ость подвздошной кости с прикрепляющимися к ней мышцами. Отступя от края вертлужной впадины на 5 мм проводили внесуставную полукружную остеотомию над вертлужной впадиной между местом прикрепления суставной капсулы и крылом подвздошной кости радиусом, равным радиусу эндопротеза, продолжая вдоль заднего края впадины до уровня середины большой седалищной вырезки, вдоль переднего края до основания подвздошно-гребешкового возвышения на глубину внутреннего края суставного хряща. Затем передне-верхний отдел вертлужной впадины отводили вниз и кнаружи, а в образовавшуюся щель помещали эндопротез тела безымянной кости из пористого никелида титана в форме продольно-поперечно-изогнутого клиновидного тела с продольными пазами со стороны расширенного конца. При этом устраняли ранее смоделированный дефицит покрытия головки бедренной кости и восстанавливали асферическую форму вертлужной впадины. После чего из подвздошной кости над пазами установленного эндопротеза формировали несвободные костные ауотрансплантаты, соответствующие по размерам и форме пазам эндопротеза в поперечном сечении, с длиной, превышающей толщину эндопротеза. Аутотрансплантаты отгибали книзу и помещали в пазы в распор между сторонами костного распила. Образованные на месте перемещенных аутотрансплантатов щели заполняли остеозамещающим материалом. Отсеченную передне-нижнюю ость подвздошной кости с прикрепляющимися к ней мышцами возвращали на ее прежнее место и фиксировали капроновыми швами. После чего рану ушивали наглухо.
В послеоперационном периоде проводили оценку общего состояния экспериментальных животных, особое внимание обращали на опороспособность конечностей, наличие болезненности при пальпации опытного сустава, окружность оперированных конечностей. Эвтаназию животных осуществляли путем внутримышечного введения 5%-ного раствора кетамина в дозировке, превышающей допустимую в 4 раза. На трупах животных измеряли угломером амплитуду движений в обоих тазобедренных суставах: сгибание, разгибание, отведение. Эксперименты на животных осуществляли в соответствии с правилами проведения работ с использованием экспериментальных животных (Приложение к приказу МЗ СССР от 12.08.1977 № 755, «Европейская конвенция о защите позвоночных животных, используемых для экспериментов или в научных целях» от 18.03.1986).
Состояние костных структур тазобедренных суставов животных изучали путем выполнения рентгенограмм костей таза в передне-задней проекции под углом укладки 45º.
Для проведения гистологических исследований после вывода животных из эксперимента единым блоком брали фрагменты тазовых костей, составляющих вертлужную впадину, головку бедренной кости и ткань капсулы сустава. Из полученных целлоидиновых блоков готовили микропрепараты толщиной 10 мкм, которые окрашивали гематоксилин-эозином и пикрофуксином по Ван Гизону. Исследования проводили на световом микроскопе Amplyval (Германия).
Для биохимического анализа кровь получали из бедренной вены. Биохимические методы исследования включали определение общего содержания гликозаминогликанов (ГАГ), ионизированного кальция с помощью ион-селективного электрода, неорганического фосфора (Ph FS Diasys) и щелочной фосфатазы (ALP FS Diasys). За нормальные показатели последних принимали значения, полученные при исследовании биоматериалов животных в период, предшествующий хирургическому моделированию гипоплазии вертлужной впадины тазобедренного сустава.
С целью определения достоверности полученных результатов проводили их статистическую обработку параметрическим вариационным методом с вычислением t-критерия Стьюдента. Значимыми считали различия при показателе достоверности р<0,05.
Результаты исследований
По результатам клинического обследования животных оптимум опороспособности конечности достигался к 14-м суткам, что характеризовалось исчезновением хромоты при передвижении. К 1-му месяцу наблюдения за экспериментальными животными движения в оперированном тазобедренном суставе восстанавливались, объем их достигал при сгибании 155°, разгибании – 25°, отведении – 65°. Данный объем движений сохранялся во все последующие контрольные точки исследования. Атрофия мышц и видимая деформация оперированных тазобедренных суставов отсутствовали во все сроки наблюдения.
По данным рентгенологических исследований, в период с 1-го по 3-й месяцы отмечали восстановление нормальных анатомических взаимоотношений в оперированном тазобедренном суставе, что характеризовалось устранением дефицита покрытия головки бедра, восстановлением конгруэнтности тазобедренного сустава при сохранении одинаковой ширины суставной щели и достижении величины угла глубины вертлужной впадины 90°. Аналогичная картина прослеживалась и в более поздние сроки и дополнялась к 6-му месяцу полным восстановлением покрытия бедренной кости, появлением стабильной коррекции опороспособности, четкостью контуров суставной поверхности. Через 9 и 12 месяцев вторичных смещений эндопротезов не было, признаков прогрессирования коксартроза не отмечалось.
При морфологическом исследовании препаратов тканевых изменений, свидетельствующих о неблагоприятном воздействии эндопротеза на суставные поверхности и параартикулярные структуры, обнаружено не было. Поверхность головки бедренной кости во все периоды исследования была покрыта гиалиновым хрящом на всем её протяжении в сочетании с утолщением субхондральной костной пластинки, имеющей компактную структуру. В препаратах визуализировался сохраненный костный мозг, децентрированный к периферии, к центру обнаруживались расширенные межбалочные пространства, заполненные жёлтым костным мозгом. Суставной хрящ вертлужной впадины был интактен на всей поверхности и имел участки пролиферации, субхондральная пластинка была не нарушена, костный мозг сохранён. Через 1 месяц по периферии эндопротеза отмечали появление остеобластов и соединительнотканных волокон, ориентированных перпендикулярно к его поверхности. Через 3 месяца остеобласты вокруг эндопротеза активно синтезировали костный матрикс, зоны резорбции отсутствовали. Костная ткань, прилежащая к эндопротезу, была хорошо организована и имела пластинчатый характер. Через 6 месяцев признаки костной интеграции становились отчетливыми, сращение кости и эндопротеза было полным. Аналогичная морфологическая картина имелась и к 12-ти месяцам наблюдения (рисунок).
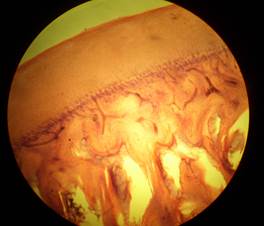 а)
а) 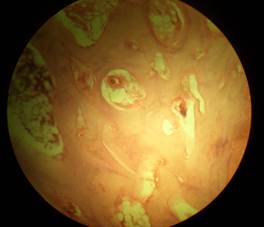 б)
б)
Микропрепараты вертлужной впадины собаки через 12 месяцев после коррекции эндопротезом из пористого никелида титана с продольными пазами (а – зона суставной поверхности; б – костная ткань в пазах эндопротеза)
По данным биохимических исследований, содержание ГАГ в крови собак к 1-му месяцу после операции достоверно увеличивалось в 2,4 раза относительно показателей здоровых животных с последующим постепенным снижением в сроки с 3-го по 12-й месяцы, достигающим показателей здоровых животных (таблица 1).
Таблица 1
Показатели гликозаминогликанов после эндопротезирования (М±m)
|
Показатели |
Гликозаминогликаны, х 10 -2 г у.к./л |
|
Здоровые |
2,94±0,15 |
|
Через 1 месяц после операции |
6,21±0,04* |
|
Через 3 месяца |
5,86±0,16* |
|
Через 6 месяцев |
4,35±0,07* |
|
Через 9 месяцев |
3,97±0,14* |
|
Через 12 месяцев |
2,92±0,18 |
Примечание: * – статистически достоверная разница показателей между прооперированными животными и здоровыми (р<0,05).
Таблица 2
Показатели минерального обмена экспериментальных животных после костной пластики и эндопротезирования (М±m)
|
Сроки после операции |
Ионизированный кальций, ммоль/л |
Неорганический фосфор, ммоль/л |
Щелочная фосфатаза, Е/л |
|
Здоровые |
0,98±0,02 |
7,44±0,04 |
81,11±2,71 |
|
1 мес. |
1,01±0,06 |
7,51±0,15 |
85,74±2,56 |
|
3 мес. |
1,011±0,02 |
7,55±0,09 |
88,07±3,13 |
|
6 мес. |
1,01±0,02 |
7,50±0,16 |
84,17±4,78 |
|
9 мес. |
1,008±0,03 |
7,52±0,15 |
82,56±2,28 |
|
12 мес. |
1,009±0,01 |
7,40±0,17 |
80,61±1,78 |
При исследовании показателей минерального обмена статистически достоверной разницы не отмечалось (таблица 2), что свидетельствовало об отсутствии влияния хирургической коррекции смоделированной диспластической вертлужной впадины на показатели ремоделирования костной ткани.
Обсуждение полученных результатов
На основании полученных результатов установлено, что выполнение эндопротезирования тела безымянной кости с помощью имплантата из пористого никелида титана с продольно ориентированными пазами, дополненное элементами костной аутопластики, стимулирует репаративную регенерацию путем создания контакта «кость-кость» между сторонами костного распила при внедрении в пазы эндопротеза аутотрансплантатов и использовании остеозамещающего материала, которым заполняют щели, образованные в местах формирования аутотрансплантатов. Это соответствует литературным данным о том, что повышение прочности фиксации при первичном креплении эндопротеза достигается установкой в его пазы аутотрансплантатов, что обеспечивает его заклинивание в костном ложе [10].
По данным [11; 12], стабильность позиции эндопротеза создает оптимальные условия для формирования крыши вертлужной впадины, конгруэнтной головке бедренной кости. Стабильность разработанного нами эндопротеза в месте имплантации и его пористая структура обусловливают быстрое установление прочной связи с костным ложем, не оставляя места для аккумуляции волокнистой ткани. Заполнение пазов эндопротеза костными аутотрансплантатами позволяет интраоперационно создать дополнительные очаги остеогенеза, увеличив тем самым в надацетабулярной области количество вновь образуемой костной ткани. Трансплантаты в пазах трансформируются в костные столбики над наиболее нагружаемыми отделами свода вертлужной впадины, при этом за счёт них улучшается трофика находящегося под вогнутой поверхностью эндопротеза костно-хрящевого лоскута, снижается давление на поверхности раздела кость-имплантат и, следовательно, формируется более функциональный конгруэнтный навес крыши вертлужной впадины.
Таким образом, суммируя вышеизложенное, можно отметить, что проведённые нами исследования выявили положительные изменения изучаемых параметров у собак со сформированным артрозом после проведённых операций.
Библиографическая ссылка
Норкин И.А., Петров А.Б., Дохов М.М., Щуковский В.В. ЭКСПЕРИМЕНТАЛЬНОЕ ОБОСНОВАНИЕ ПРИМЕНЕНИЯ КОРРЕКЦИИ КРЫШИ ВЕРТЛУЖНОЙ ВПАДИНЫ ТИТАНОВЫМ ПРОТЕЗОМ В СОЧЕТАНИИ С КОСТНОЙ ПЛАСТИКОЙ ПРИ ХИРУРГИЧЕСКОЙ ПРОФИЛАКТИКЕ ДИСПЛАСТИЧЕСКОГО КОКСАРТРОЗА // Современные проблемы науки и образования. 2016. № 5. ;URL: https://science-education.ru/ru/article/view?id=25323 (дата обращения: 14.02.2026).



