Хирургическая герниология, несмотря на достаточно длительный период развития, и до сих пор остается актуальной проблемой [4]. По сводной статистике в России ежегодно выполняются более 200000 грыжесечений [4]. К сожалению, следует констатировать, что результаты оперативных вмешательств при грыжах различной локализации нельзя признать удовлетворительными. При классических грыжесечениях частота рецидивов колеблется от 20 % до 46 % [7]. Устойчивая позитивная тенденция появилась при внедрении в клиническую практику новых аллопластических материалов. Это значительно снизило остроту проблемы. По крайней мере, частота рецидивов по данным различных авторов уменьшилась более чем в 2–3 раза [7, 10]. Вместе с тем причины рецидивов грыж связаны не только с классическими вариантами герниопластик. За последнее время появились сведения о причастности дисплазии соединительной ткани как к развитию грыж, так и возможному ее рецидиву [8]. Патогенетически обоснованная коррекция в данном направлении, по-видимому, будет способствовать дальнейшему улучшению хирургического лечения данного контингента больных. Изложенные моменты явились отправными для проведения настоящего исследования.
Цель исследования
Установить причины, приводящие к нарушению синтеза коллагена при грыжах наружной локализации, и определить пути его коррекции.
Материалы и методы
Основу работы составили клинические наблюдения и специально проведенные исследования у 497 больных с грыжами наружной локализации. Среди обследованных мужчин было 307 (61,8 %), женщин – 190 (38,2 %). Возраст колебался от 18 до 80 лет, средний возраст составил 56,3±10,1 лет. Паховые грыжи наблюдались у 213 (42,9 %), пупочные – у 82 (16,5 %), бедренные – у 6 (1,2 %), грыжи белой линии живота – у 23 (4,6 %), послеоперационные – у 103 (20,7 %), ущемленные – у 27 (5,4 %) пациентов. В 8,7 % (у 43 пациентов) случаев имели место рецидивные грыжи. Среди них доминировали послеоперационные и паховые. Принимая во внимание клиническую значимость степени выраженности дисплазии соединительной ткани на патогенез развития грыж, нами в этом направлении проведены специальные исследования. Степень соединительнотканной дисплазии у всех пациентов определяли в зависимости от количества и выраженности её внешних признаков, согласно критериям Т. Милковска-Дмитровой [6].
Статистическую обработку данных осуществляли при помощи программ MicrosoftExcel 2007 и Statistica (v10.0) на основании параметрических и непараметрических методов. Оценку достоверности результатов для количественных признаков осуществляли, используя при сравнении данных между сериями t-критерий Cтьюдента для несвязанных групп, а в случае определения значимости различий с контролем – t-критерий Cтьюдента для связанных групп. Сравнение порядковых данных осуществляли на основании критерия Манна – Уитни. С учетом множественных сравнений, использовали поправку Хольма –Бонферрони.
Результаты и обсуждение
При оценке полученных данных установлено, что при паховых грыжах частота дисплазии соединительной ткани составила 36 %, при бедренных – 50 %, при пупочных – 50 %, при грыжах белой линии живота – 52 %, при послеоперационных – 58 %, при ущемленных – 56 %. Максимальная частота выявлена при рецидивных грыжах (70 %). При этом легкая степень дисплазии наблюдалась в 70 %, умеренная – в 30 % случаях, в основном при рецидивных, послеоперационных и ущемленных грыжах. Полученные данные дают основание считать о значительном влиянии степени дисплазии на развитие грыж и частоту рецидивов.
Согласно существующим представлениям степень выраженности дисплазии соединительной ткани связана со степенью нарушения синтеза коллагена. Косвенным маркером гиперкатаболизма коллагена является повышенная концентрация в плазме крови гидроксипролина [5]. Уровень концентрации гидроксипролина в сыворотке крови определяли по методике П.Н. Шараева (1990) [9]. Проведенные исследования у 44 больных показали, что во всех случаях в плазме крови повышается уровень гидроксипролина в среднем на 31 % (р 0,05), что свидетельствует о нарушении синтеза коллагена [5]. При этом максимальные изменения отмечены при рецидивных грыжах и умеренной степени дисплазии.
По данным отдельных авторов отмечено, что синтез коллагена в определенной степени регулируется функциональным состоянием вегетативной нервной системы [3,5]. В этой связи у 100 больных проведен анализ вариационной пульсометрии (ВП). Для оценки тонуса различных отделов вегетативной нервной системы были использованы показатели (ВП) с анализом 100 кардиоинтервалов [2]: Мода (Мо, сек); Амплитуда моды (АМо, %); Вариационный размах (ΔХ, сек); Индекс напряжения (ИН) вычисляли по формуле - ИН = АМ0 / (2 ×М0×ΔХ).
При оценке показателей ВП установлено, что величины моды (Мо) и вариационного размаха (ΔХ) имеют тенденцию к снижению, а величина индекса напряжения (ИН) – к увеличению (р<0,05) по отношению к параметрам контроля. Данные показатели свидетельствуют о преобладании симпатической нервной системы (СНС) в вегетативной регуляции.
Превалирующее влияние симпатической активности отмечено у пациентов с грыжами белой линии живота (ИН - 677,0±58,4 у.е.) и рецидивными грыжами (ИН - 534,56 ±40,56 у.е.), что в 6,1 и в 4,8 раза соответственно выше (р<0,05) показателя ИН в группе контроля (111,6±8,0 у.е.). В зависимости от степени тяжести дисплазии основной показатель ВП – индекс напряжения, отражающий степень напряжения регуляторных механизмов организма, также имеет тенденцию к повышению. При легкой степени дисплазии соединительной ткани величина ИН составила – 438,8±28,6 у.е., при умеренной – 492,11±46,35 у.е. При отсутствии синдрома дисплазии, у больных с грыжами передней брюшной стенки показатель ИН в 1,5 раза ниже – 297,7±20,84 у.е. (р<0,05).
Представленные данные свидетельствуют, что при всех грыжах доминирует симпатическая активность вегетативной нервной системы. С нарастанием тяжести дисплазии она повышается. По-видимому, выявленные критерии могут выступать как предрасполагающие факторы при образовании грыж и в патогенезе ее рецидива.
Для более объективной доказательности полученных результатов нами проведен эксперимент на 30 лабораторных животных на предмет изучения синтеза коллагена в условиях ослабления или нивелирования симпатической активности.
Проведены 4 серии опытов:
I серия (5 животных): – под эфирным наркозом, у животных иссекался участок апоневроза передней брюшной стенки с образованием дефекта размерами 0,5 х 0,5 см, с последующим его естественным заживлением. Участок апоневроза иссекался во всех сериях. Ткань апоневроза выступала в качестве контроля во всех сериях животных.
II серия (7 животных): – скорость заживления дефекта в апоневрозе оценивалась после вшивания эндопротеза с коллагеновым покрытием.
III серия (8 животных): – в этой серии прослежено влияние прозерина на заживление раны. Всем животным 1 раз в сутки на протяжении 10 дней подкожно вводился раствор прозерина. Дозу прозерина (ДП) рассчитывали, исходя из веса животного (P), основываясь на клинических рекомендациях: ДП (мг) = 0,5 (мг)×P(гр)/70000(гр).
IV серия (10 животных): – на фоне аллопластики применялись инъекции прозерина в тех же дозах. Продолжительность эксперимента составила 30 суток.
Аутопсийный материал был подвергнут стандартной гистологической методике приготовления и обработке с последующей окраской по Массону на соединительную ткань.
По методике Г.Г. Автандилова (1990) [1] изучались следующие показатели: средняя толщина волокон коллагена (СТВ), удельная площадь волокон (УПВ), яркость окрашивания (ЯО), ориентация волокон (ОВ).
Результаты гистологического исследования аутоптатов передней брюшной стенки лабораторных животных представлены в таблице 1.
Таблица 1
Микроморфологические параметры соединительной ткани в эксперименте
|
Серии исследования |
СТВ, мкм |
УПВ, % |
ЯО, Ед |
ОВ, % |
|
Серия I (дефект) (n = 25) |
0,94±0,05* |
85,3±2,1* |
104,1±6,5* |
50±7,2 |
|
Серия II (сетка) (n = 35) |
0,93±0,03* |
89,9±3,3* |
104,4±9,8* |
50 ±7,6 |
|
Серия III (прозерин) (n = 40) |
0,92±0,09* |
90,6±3,8* |
98,6±4,7* |
63 ±8,5** |
|
Серия IV (сетка + прозерин) (n = 50) |
0,93±0,18* |
92,6±3,6* |
97,5±4,5* |
86 ±12,2** |
|
Контроль (n = 40) |
1,4±0,14 |
81,6±6,0 |
108,4±8,5 |
--- |
Примечание. Различия статистически значимы: * – с группой контроля (p<0,01); ** – между III и IV сериями эксперимента (p<0,01); n – количество препаратов.
Микропрепараты апоневроза лабораторных животных в эксперименте представлены на рисунках 1–5.

Рис. 1. Контроль. Сохранена волнистая структура и пространственная ориентация коллагеновых волокон
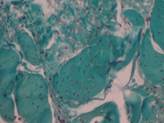
Рис. 2. Серия I. Усилена разветвленность сети волокон коллагена со снижением их пространственной ориентации на 50 %, что говорит об усилении его синтеза
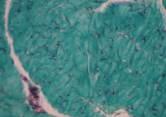
Рис. 3. Серия II. Как в серии I увеличена разветвленность сети коллагеновых волокон и снижена их пространственная ориентация на 50 %
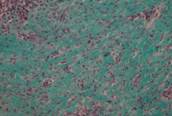
Рис. 4. Серия III. Большое количество сосудов и ядер клеток соединительной ткани в препарате говорит об усиленном синтезе коллагена

Рис. 5. Серия IV. В препарате большое количество вновь синтезированных волокон коллагена, на фоне сниженного числа зрелых клеточных ядер, что говорит о раннем завершении процесса ремоделирования ткани
Средняя толщина коллагеновых волокон в препаратах вновь сформированной соединительной ткани была меньше, чем в контрольной группе, на 67 %, при этом различий показателя в сериях I, II, III и IV не было (p>0,01), что говорит об усилении синтеза коллагена во всех сериях.
Удельная площадь волокон была наибольшей в сериях с вшиванием сетки и введением прозерина, меньшей при восстановлении дефекта без дополнительной стимуляции. При этом показатели во всех указанных сериях превышали данные контрольной группы. Различия между значениями признака всех серий были значимы (p<0,01), что свидетельствует об усилении процессов коллагенообразования во всех сериях эксперимента.
Самая низкая яркость окрашивания была в препаратах контрольной группы, что связано с минимальным сродством зрелых сухожильных волокон апоневроза к красителю. Чуть более выражено (p=0,08) окрашивались волокна в сериях без введения прозерина (серия I и серия II). После стимуляции прозерином (серия III и серия IV) волокна характеризовались наибольшим (p<0,01) сродством к кислым компонентам красителя, вероятно, пропорционально числу гидроксильных групп оксипролина в альфа-цепях, обеспечивающих прочность макромолекулы коллагена.
Более всего разветвленность сети коллагеновых волокон со снижением их пространственной ориентации была выражена в серии IV, на 36 % превышая значения в группе с заживлением дефекта естественным путём. Чуть менее (на 13 % выше серии II) – при введении прозерина без вшивания сетки, что также свидетельствует об усилении процессов коллагенообразования.
В результате установлено, что прослеживается определенная градация со стороны изучаемых показателей. Степень нормализации коллагенообразования – наиболее высокая под влиянием инъекций прозерина, а также при сочетании введения прозерина и вшивания аллотрансплантата. По сравнению с другими сериями эксперимента интенсивность синтеза коллагена в этих сериях возрастает на 13–36 %.
При оценке результатов хирургического лечения установлено, что при дисплазии соединительной ткани частота рецидивов возрастала в 2,5 раза (до 12,6 %). В общей группе больных в зависимости от варианта герниопластики частота рецидивов грыж была различной. При герниоаутопластике (155 больных) с дисплазией соединительной ткани частота рецидивов возрастала в 1,7 раза (26,6 %). При эндопротезировании полипропиленовой сеткой (266 пациентов) без дисплазии соединительной ткани рецидивов не отмечено, при дисплазии рецидивы наблюдались у 6,5 % больных. При лапароскопических грыжесечениях (76 больных), частота рецидивов составила 2,9 %, что в 9,2 раза ниже, чем при герниоаутопластике. У больных без дисплазии частота рецидива наблюдалась в 2,4 %, при легкой степени в 4 % случаев. При умеренной степени дисплазии соединительной ткани рецидивов не отмечено. Наибольшая частота рецидивов отмечена при герниоаутопластике с умеренной степенью дисплазии (до 45 %), а в зависимости от разновидности грыж – при послеоперационных и паховых. Период наблюдения колебался от 2 до 8 лет.
Выводы
Частота дисплазии наиболее значима при рецидивных, послеоперационных и ущемленных грыжах.
С нарастанием тяжести дисплазии повышается симпатическая активность и концентрация гидроксипролина в сыворотке крови.
При снижении симпатической активности введением раствора прозерина, в сочетании с аллотрансплантатом с коллагеновым покрытием, нормализация коллагенообразования более выражена.
Развивающаяся дисплазия соединительной ткани способствует повышению частоты рецидивных грыж. Оптимальным вариантом в этих случаях является лапароскопическое эндопротезирование.
Библиографическая ссылка
Рыбачков В.В., Садижов Н.М., Гужков О.Н., Тевяшов А.В., Шубин Л.Б., Соколов С.В. ХИРУРГИЧЕСКАЯ ТАКТИКА ПРИ ГРЫЖАХ ПЕРЕДНЕЙ БРЮШНОЙ СТЕНКИ С СИНДРОМОМ ДИСПЛАЗИИ СОЕДИНИТЕЛЬНОЙ ТКАНИ // Современные проблемы науки и образования. 2016. № 5. ;URL: https://science-education.ru/ru/article/view?id=25317 (дата обращения: 14.02.2026).



