Известно, что при патологических состояниях (в том числе и при персистирующих инфекциях) в организме ребенка накапливаются различные токсические метаболиты, вызывающие состояние эндотоксикоза и нарушения гомеостаза. Эндотоксикоз часто определяет клиническую картину и исходы заболевания. Происхождение синдрома эндотоксикоза многие связывают с накоплением веществ средней молекулярной массы (ВСММ), образующихся при распаде крупных молекул. Накапливаясь, ВСММ ослабляют сорбционные свойства эндогенного альбумина, затрудняя запуск механизмов физиологической детоксикации [1,7].
В связи с этим мы сосредоточили внимание на патогенетической роли эндогенной интоксикации в формировании дисгомеостаза у детей с поражением опорно-двигательного аппарата при инфекционном мононуклеозе (ИМ) на разных стадиях персистенции вируса, т.е. развития болезни.
Материал и методы
Для решения поставленной задачи мы обследовали 70 детей с поражением опорно-двигательного аппарата, перенесших ИМ. Дети наблюдались в Центре персистирующих инфекций и паразитарных инвазий Самарской области (ГБУЗ СО «Самарская городская больница № 5»; главный врач – доцент С.М. Китайчик).
Возраст детей – от 3 до 15 лет. Среди больных преобладали дети от 3 до 7 лет, что соответствует началу возрастного физиологического снижения неспецифической резистентности организма; мальчики составили 57,5 %.
К моменту начала инфекции все дети находились в стадии клинико-лабораторной ремиссии по основному заболеванию. Обследование проводилось в остром периоде мононуклеоза, через 3 месяца и через 2 года после клинического выздоровления. Во всех случаях диагноз ИМ был верифицирован.
Патология опорно-двигательного аппарата у наблюдавшихся детей оценивалась с учетом морфофункциональных данных и выделением фаз гомотоксикозов, предложенных Х.Х. Реккевегом [2,3] и усовершенствованных И.В. Тираспольским [5].
Оценивалась концентрация ВССМ как универсального критерия эндогенной интоксикации скрининговым методом в модификации М.И. Габрилович. Показатели концентрации веществ свыше 1,5 ОЕ считались повышенными, свыше 1,7 ОЕ указывали на выраженную интоксикацию, свыше 1,9 ОЕ – на тяжелую степень эндотоксикоза.
С целью оценки степени эндогенной интоксикации определяли показатели белкового обмена (общий белок сыворотки, белковые фракции, общую и эффективную концентрацию альбумина (ОКА, ЭКА), резерв связывания и индекс токсичности (РСА) и (ИТ)). Состояние альбумина сыворотки крови изучали методом флуоресцентных зондов при помощи зонда К-35. Оценивалась ЭКА, которая зависит как от концентрации альбумина, так и от структуры его связывающих центров. Показатели РСА и ИТ рассчитывали по формулам: РСА = (ЭКА /ОКА) * 100%, ИТ= (ОКА/ ЭКА) – 1. В контрольной группе функциональное состояние альбумина оценивалось у 25 здоровых детей в возрасте от 1 до 15 лет. Обследованные относились к I–2 группам здоровья и не переносили острых заболеваний в течение 2 месяцев перед обследованием.
Для целостного представления о роли эндотоксикоза в процессе формирования дисгомеостаза у обследованных детей нами проведен системный многофакторный анализ (СМА) полученных показателей и построены системные многофакторные модели.
Результаты исследования и их обсуждение
При распределении обследованных детей с поражением опорно-двигательного аппарата, перенесших ИМ, по фазам гомотоксикоза (таблица 1), было отмечено, что большинство детей находились в фазе воспаления, несколько меньше пациентов – в фазах экскреции и дегенерации.
Таблица 1
Распределение обследованных детей с поражением опорно-двигательного аппарата, перенесших ИМ, в зависимости от фазы гомотоксикоза
|
Фазы гомотоксикоза |
Абс. |
% |
|
Экскреции |
14 |
21,0 |
|
Воспаления |
33 |
45,5 |
|
Депонирования |
8 |
11,6 |
|
Импрегнации |
5 |
7,4 |
|
Биологический барьер |
||
|
Дегенерации |
10 |
14.5 |
|
Дедифференциации |
- |
- |
|
Всего |
70 |
100 |
Патологические изменения в опорно-двигательном были представлены: в 1-ой фазе болями в суставах, спине; во 2-ой – реактивными артритами, миалгиями, эпикондилитами; в 3-ей – экзостозами; в 4-ой – хроническими артритами; в 5-ой – спондилезами, остеопорозом, костными кистами, мышечной атрофией. Отсутствие наблюдений в 6-ой фазе гомотоксикоза говорит о достаточно высоком уровне компенсаторных процессов в детском организме, способных приостанавливать заболевание на более ранних стадиях.
В остром периоде инфекционного мононуклеоза мы наблюдали (таблица 2) выраженный эндотоксикоз.
Таблица 2
Показатели, характеризующие синдром эндотоксикоза, у детей с мононуклеозом в остром периоде болезни (n = 70, * – достоверная разность параметров с нормой при р = 0,05)
|
Наименование показателя |
Абсолютные значения |
|
ВСММ (е.о.п.) |
0,37±0,01* |
|
ОБ (г/л) |
67,95±2,8 |
|
ОКА (г/л) |
54,1±2,9 |
|
ЭКА (г/л) |
33,11±3,8* |
|
РС (%) |
71,32±3,5* |
|
ИТ (у.е.) |
0,75±0,11 |
Анализ данных, представленных в таблице 2, показывает достоверное увеличение уровня ВСММ, что характеризует инфекционный мононуклеоз, как патологический процесс, сопровождающийся высоким уровнем эндогенной интоксикации. Острый процесс характеризовался снижением ЭКА (33,11±3,8 г/л) и уменьшением РС до 71,32±3,5 %. Наличие интоксикации подтверждал высокий уровень ИТ.
Наши наблюдения показали, что после перенесенного ИМ у детей была нарушена работоспособность различных органов и систем. Так, у детей, находящихся до ИМ в первой фазе гомотоксикоза, длительно сохранялись симптомы интоксикации – (13–18,6 %). У детей, находившихся во второй фазе гомотоксикоза, наблюдались рецидивы ангин, частые ОРВИ, ларингиты, пневмонии, конъюнктивиты (31–44,3 %); в фазе депонирования – аденоидит, аллергия, стойкое увеличение лимфоузлов (7–10,0 %); в фазе импрегнации – рецидивирующие крапивницу и ларингиты (4–5,7 %); в дегенеративной фазе – анемия, парадонтоз, нарушение кишечного всасывания (15–2,4 %). Таким образом, перенесенный ИМ явился провоцирующим фактором развития нарушений соматического здоровья.
В целом, при угасании клинических проявлений болезни происходило уменьшение уровня ВСММ, однако, полной нормализации не наблюдалось у всех детей, независимо от фаз гомотоксикоза, в которых они находились до инфекционного заболевания. Повышенные показатели этих метаболитов сохранялись и в периоды поздней реконвалесценции, что подтверждает наличие персистенции возбудителя и сохраняющейся интоксикации.
Показатели белкового метаболизма соответствовали состоянию эндотоксикоза, выявленного нами при анализе динамики уровня ВСММ.
Известно [6,10], что характер интоксикации, ее интенсивность при той или иной патологии определяют скорость распада белковых структур. Динамика ЭКА показывала снижение уровня этого показателя во все периоды ИМ. Отсутствие полного восстановления ЭКА в стадию ремиссии позволяет предположить сохранение воздействия гомотоксина на печень в неактивную стадию ИМ. То есть в течение ИМ не представляется возможным говорить о полном выздоровлении, а только о чередовании периодов большей и меньшей активности персистенции (рис. 1).
Компенсаторные процессы в организме отражаются и динамикой такого показателя, как РС. Оставаясь более низким, чем в условиях нормы, уровень его выше в фазах матрикса и клеточных фазах. Это позволяет предположить синтез более полноценного альбумина, что имеет принципиальное значение в условиях постоянно поддерживающейся интоксикации. Более высокий РС обеспечивает реакции связывания гидрофобных лигандов не только за счет гидрофобных связей [8,9], водородных мостиков (вовлекают во взаимодействие алкоголи, слабые кислоты, амины), но и электростатических взаимодействий (связывают органические и неорганические электролиты). Этот механизм позволяет удерживать стабильный уровень эндогенного токсикоза и предотвратить развитие фазы дедифференциации у детей, перенесших ИМ (рис. 2).
Наличие эндотоксикоза подтверждает высокий уровень ИТ, определяющийся во все периоды болезни. Этот показатель связан с уровнем ЭКА прямой зависимостью и отражает динамику последнего. Наиболее высокий ИТ наблюдался у детей с исходной фазой воспаления (0,75±0,11 у.е.), что отражает попытку организма вывести токсины в едином «экскреторном ударе». Последующее снижение ИТ у детей с предшествующими фазами депонирования (0,16±0,03 у.е) и импрегнации (0,18±0,5 у.е.) отражает затруднение выведения токсинов и начало их депонирования сначала в межклеточном матриксе (рыхлая соединительная ткань), а затем и внутри клеток. В процессе развития воспалительной реакции на фоне ИМ организм вновь пытается вывести токсины для предотвращения развития фазы дедифференциации, что объясняет повышение ИТ у детей, находившихся в фазе дегенерации (0,25±0,04). Успешность такого механизма компенсации подтверждался отсутствием у детей патологии, характерной для последней фазы (рис. 3).
Для более полного представления о формировании эндотоксикоза у детей с поражением опорно-двигательного аппарата в различные периоды персистенции вируса Эбштейна – Барр мы провели системный многофакторный анализ (СМА) показателей, характеризующих это состояние. Многофакторные модели формирования эндотоксикоза основывались на анализе следующих параметров: уровень веществ средней молекулярной массы в крови, общий белок крови, уровень альбумина, показатели функционального состояния альбумина (таблица 3; рис. 4).
Таблица 3
Результаты системного многофакторного анализа формирования синдрома эндотоксикоза, у детей с ИМ в зависимости от фазы гомотоксикоза
(MB взвешенное среднее, интегральный показатель)
|
Фазы гомотоксикоза |
Экскреции |
Воспа-ления |
Депонирования |
ББ |
Импрегнации |
Дегенерации |
Дедиффернциации |
|
МВ |
-0,07 |
-0,12 |
-0,001 |
-0,9 |
-0,1 |
- |
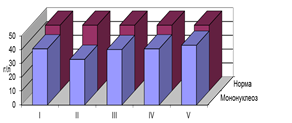
Рис. 1. Динамика ЭКА у детей с поражением опорно-двигательного аппарата, находившихся в разных фазах гомотоксикоза, перенесших ИМ
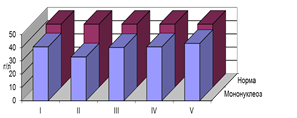
Рис. 2. Динамика РС у детей с поражением опорно-двигательного аппарата, находившихся в разных фазах гомотоксикоза, перенесших ИМ
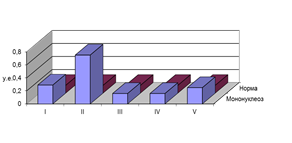
Рис. 3. Динамика ИТ у детей с поражением опорно-двигательного аппарата, находившихся в разных фазах гомотоксикоза, перенесших ИМ
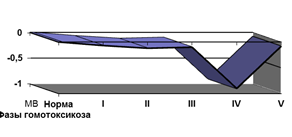
Рис. 4. Графическое изображение многофакторной модели формирования эндотоксикоза у детей с поражением опорно-двигательного аппарата в разные периоды ИМ зависимости от фазы гомотоксикоза
Результаты СМА показателей, характеризующих эндотоксикоз, свидетельствовали, что хроническая персистенция возбудителя сопровождается признаками токсикоза на всех этапах болезни [4]. Степень выраженности эндотоксикоза зависела от фазы гомотоксикоза, в которой находились дети с поражением опорно-двигательного аппарата. Накопление и циркуляция токсинов различного происхождения приводили к усилению отрицательных воздействий, что отражала математическая модель эндотоксикоза. Интегральные показатели носили отрицательные значения, и моделирование происходило в отрицательной зоне.
Симптомы эндотоксикоза появлялись уже в остром периоде ИМ. В этой ситуации интегральный показатель снижался умеренно (МВ=-0,08).
После завершения острого периода ИМ у наблюдавшихся пациентов сформировалась различные патологические процессы, которые позволили дифференцированно оценить состояние здоровья пациентов, осуществляя гмотоксикологический поход.
У детей, исходно находившихся в первой фазе гомотоксикоза, степень выраженности эндотоксикоза оказалась незначительно меньшей, чем находившихся в фазе воспаления (МВ=-0,07).
Уровень эндотоксикоза в периоде реконвалесценции превышал этот показатель в остром периоде в полтора раза (МВ=-0,121), если больные исходно были в фазе воспаления.
У детей, находившихся в фазе депонирования, мы наблюдали уменьшение уровня эндотоксикоза. Интегральный показатель приближался к норме (МВ=-0,001). У части детей, находившихся до ИМ в фазе импрегнации, были отмечены более низкие компенсаторные возможности организма, что сопровождалось максимально выраженным эндотоксикозом (МВ=-0,9). На формирование гомотоксикоза в этой фазе наиболее влияли резерв связывания альбумина (Pi=-288,0), а также общая и эффективная концентрация белка (Pi=107,0; Pi=270,75). Происходили как количественные, так и качественные изменения альбумина [2]. При возобновившемся массивном поступлении токсинов в кровь формируется нехватка транспортных емкостей альбумина для обеспечения адекватной дезинтоксикации.
У пациентов с исходной фазой дегенерации уменьшался уровень эндотоксикоза (МВ=-0,1). В этой ситуации организм пытается поддерживать свою жизнедеятельность путем перманентного образования новых органических структур, не способных к выбросу скопившихся в них токсинов на фоне ослабленных иммунологических реакций, что приводило к уменьшению уровня токсических лигандов в кровяном русле и отражалось на многофакторной модели [2].
Выводы:
1. Соматическая патология у детей с поражением опорно-двигательного аппарата, перенесших ИМ, зависит от фазы патологического процесса.
2. Многофакторное моделирование показало, что во всех фазах развития патологического процесса присутствует эндотоксикоз, сопровождающийся катаболическим преобразованием белкового обмена и поддерживающий токсемию.
3. Выделение морфологического уровня поражения (фазы гомотоксикоза) может способствовать индивидуальному подбору антигомотоксических препаратов с целью предотвращения обострения основного заболевания.
Библиографическая ссылка
Стадлер Е.Р., Санталова Г.В., Гасилина Е.С., Борисова О.В., Бочкарева Н.М., Франк А.А. ЭНДОТОКСИКОЗ КАК ПОКАЗАТЕЛЬ ДИСГОМЕОСТАЗА У ДЕТЕЙ С ПОРАЖЕНИЕМ ОПОРНО-ДВИГАТЕЛЬНОГО АППАРАТА ПРИ ИНФЕКЦИОННОМ МОНОНУКЛЕОЗЕ (ГОМОТОКСИКОЛОГИЧЕСКИЙ ПОДХОД) // Современные проблемы науки и образования. 2016. № 5. ;URL: https://science-education.ru/ru/article/view?id=25271 (дата обращения: 14.02.2026).



