Известно, что при острой церебральной ишемии происходят последовательные процессы микроциркуляторного клеточного каскада, на определенных стадиях которого эндотелий претерпевает ряд существенных структурных и функциональных изменений: происходит повреждение базальной сосудистой мембраны, межэндотелиальных контактов и самой эндотелиальной выстилки церебральных сосудов [2; 4]. Эндотелий играет важную роль в регуляции сосудистого тонуса. Структурно-функциональные изменения эндотелия сосудов в результате ишемии могут нарушать ауторегуляцию мозгового кровотока и повышать вероятность возникновения повторных ишемических повреждений. В настоящее время внимание исследователей привлекает возможность комплексной оценки функционального состояния эндотелия с использованием биохимических, клеточных и функциональных методов определения дисфункции эндотелия. Исследование содержания молекул эндотелиального происхождения (метаболиты NO, воспалительные цитокины, молекулы адгезии, регуляторы тромбообразования, маркеры эндотелиального повреждения и репарации) в циркулирующей крови позволяет оценить функциональное состояние эндотелиальных клеток. Для определения целостности сосудистого эндотелия проводят измерение циркулирующих эндотелиальных клеток (ЦЭК) в периферической крови. Считается, что увеличение в крови числа зрелых ЦЭК является маркером системного прямого клеточного повреждения [9]. Оценка эндотелий-зависимой вазодилатации проводится с использованием методов, основанных на применении различных фармакологических веществ, в том числе и ацетилхолина (АЦХ), который может стимулировать выброс эндотелием окиси азота. Маркером эндотелиальной дисфункции в этих экспериментах является ослабление сосудорасширяющей реакции на введение ацетилхолина или ее извращение [8].
Несмотря на наличие большого количества работ, освещающих проблему острой цереброваскулярной ишемии, на сегодняшний день функциональное состояние эндотелия (его вазодилатационная функция) в период после ишемических нарушений мозгового кровообращения изучено недостаточно [1; 7], что и предопределило цель настоящего исследования. Целью работы являлась оценка функционального состояния эндотелия пиальных сосудов крыс до и в течение 21 дня после перенесенной ишемии головного мозга. В задачу исследования входило изучение реакций пиальных артериальных сосудов на орошение поверхности головного мозга раствором ацетилхолина и количества циркулирующих эндотелиальных клеток в периферической крови до и через 1 час и 2, 7, 14 и 21 день после однократной кратковременной транзиторной ишемии головного мозга.
Материалы и методы исследования
Эксперименты проведены на крысах линии Wistar массой 230-300 г. Для воспроизведения ишемии мозга использовали технику окклюзии двух сосудов с управляемой гипотензией [3]. У наркотизированных последовательным введением (в/бр.) золетила 50 (12,5 мг/кг массы) и домитора (0,02 мг/кг массы) крыс на 12 мин пережимались обе сонные артерии с одновременной управляемой гипотензией (снижение и строгое поддержание артериального давления (АД) на уровне 45±3 мм рт. ст. путем забора/реинфузии крови в гепаринизированный шприц). По окончании ишемии производили полную реинфузию забранной крови. После ушивания операционных ран и выхода из наркоза животных возвращали в клетки их обычного содержания.
реакции пиальных артериальных сосудов на 3-минутное орошение поверхности головного мозга раствором ацетилхолин хлорида (Sigma) в концентрации 10-5 М сравнивали в группе интактных и в пяти отдельных группах ишемизированных крыс: через 1 час и 2, 7, 14 и 21 день после ишемии. Крыс наркотизировали уретаном (внутрибрюшинно, 125 мг/100 г массы тела). Среднее артериальное давление у наркотизированных интактных крыс составляло 94.2±11.8 мм рт. ст., у перенесших ишемию – 92.5±10.9 мм рт. ст. методом прижизненной микрофотосъёмки (х470) [3] через трепанационное отверстие в черепной кости фиксировали фоновое изображение сосудов и их реакцию на ацетилхолин. Эксперименты проводили в отсутствии и на фоне блокады эндотелиальной NO-синтазы (eNOS). В качестве блокатора eNOS использовали 1%-ный раствор L-аргинин метилового эфира (L-NAME) (в/в, из расчета 1,5 мг/100 г массы тела, Sigma).
измерено 3115 участков сосудов. Рассматривали реакции сосудов 1-5-й генераций диаметром от 11 до 115 мкм [3]. В каждой генерации примерно в равной степени были представлены сосуды разного диаметра. Линейные размеры микрососудов с точностью до 2 мкм определяли с помощью стандартного объект-микрометра, калибровочных коэффициентов и программы Inspector Matrox. Измеряли ширину потока эритроцитов, соответствующую внутреннему диаметру сосуда. Оценивали число участков и изменение диаметра сосудов каждой генерации.
Количественные определения числа циркулирующих эндотелиальных клеток в периферической крови определяли по методу Hladovec J. в модификации Петрищева и соавт. [5]. Подсчет количества циркулирующих эндотелиальных клеток проводили в камере Горяева в 100 мкл плазмы крови, пересчитывая полученное число на 1 л плазмы.
Статистическую обработку результатов проводили с использованием t-критерия Стъюдента на двустороннем уровне значимости (p<0.05), для оценки силы связи между двумя переменными рассчитывали коэффициент ранговой корреляции Спирмена.
Результаты исследования и их обсуждение
Орошение поверхности головного мозга интактных крыс раствором ацетилхолина вызывало разнонаправленные реакции пиальных артериальных сосудов. Число расширившихся сосудов составило в среднем 54.4±6.5%, 33.5±8.8% сосудов сузилось, диаметр 24.6±5.7% артерий достоверно не изменялся (p<0.05). Количество расширившихся сосудов от 1-й к 5-й генерации увеличивалось (коэффициент корреляции 0.769), а не изменивших диаметр – снижалось (коэффициент корреляции –0.892). Число сузившихся артерий в группах всех генераций достоверно не отличалось (коэффициент корреляции -0.377).
У крыс, перенесших ишемию, по сравнению с интактными в течение 21 дня после ишемии было отмечено снижение числа дилататорных реакций пиальных артериальных сосудов на АЦХ и увеличение числа констрикторных (рис. 1). Число сосудов, не изменивших диаметр, составляло в среднем 30.78±1.5% (p<0.05). При сравнении реакций сосудов различных генераций у ишемизированных крыс установлено отсутствие функциональной топографической гетерогенности изменений их диаметра на ацетилхолин. Число расширившихся, сузившихся и не реагирующих сосудов в группах сосудов разных генераций достоверно не отличалось. Полученные результаты могут свидетельствовать о том, что перенесенная кратковременная ишемия мозга приводит к снижению функциональной активности эндотелия пиальных артериальных сосудов.
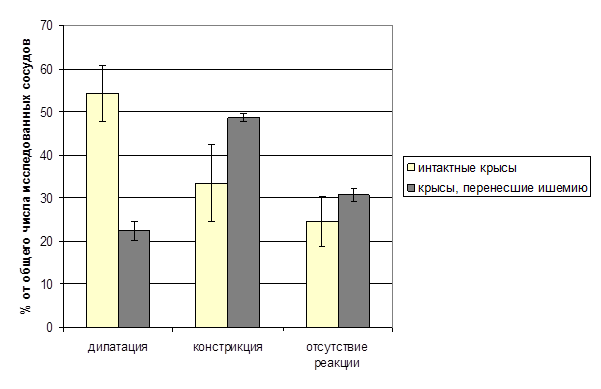
Рис. 1. Реакция пиальных артериальных сосудов крыс на ацетилхолин
*- достоверность между реакциями сосудов у интактных и перенесших ишемию крыс, р<0,05.
Изменение реакций сосудов на АЦХ в наших экспериментах отмечалось со 2-го дня после ишемии (таблица), и по мере увеличения времени, прошедшего после перенесенной ишемии, количество расширившихся и не изменивших диаметр сосудов достоверно уменьшалось, коэффициент корреляции составил соответственно -0.588 и -0.717, а число констрикций – увеличивалось (коэффициент корреляции 0.839). Максимальное изменение сосудистых реакций на АЦХ наблюдалось через 14 дней после ишемии (4.3±1.32% сосудов расширились, 76.16±4.91% - сузились, 21.26±5.25% - не изменяли диаметра, p<0.05) (таблица).
Реакции пиальных артериальных сосудов на ацетилхолин у интактных и перенесших ишемию крыс в отсутствии и на фоне блокады эндотелиальной NO-синтазы, относительно общего числа исследованных сосудов, %
|
Реакция сосудов |
Интактные крысы |
Крысы после ишемии |
|||||
|
1 час после ишемии |
2 дня после ишемии |
7 дней после ишемии |
14 дней после ишемии |
21 день после ишемии |
|||
|
Без блокады |
Дилатация |
54.4±3.8 |
40.6±5.9* |
23.5±5.6* |
15.3±4.4* |
4.3±1.1* |
20.4±3.2* |
|
Констрикция |
33.5±8.8 |
31.4±5.8 |
25.4±7.1 |
48.7±5.8* |
76.2±4.9* |
61.9±5.3* |
|
|
Отсутствие реакции |
24.6±5.7 |
27.9±3.9 |
51.1±4.3* |
35.9±3.8* |
21.3±5.3 |
17.7±4.7 |
|
|
На фоне блокады eNOS |
Дилатация |
30.3±9.7 |
50.7±10.5 |
48.5±5.5* |
27.1±4.9 |
16.4±5.1* |
30.4±8.3 |
|
Констрикция |
38.2±11.5 |
26.6±8.3 |
15.3±2.1* |
33.6±6.1 |
48.5±7.2 |
37.9±5.9 |
|
|
Отсутствие реакции |
31.5±5 |
22.7±6.6 |
36.2±7.5 |
30.4±8.3 |
37.9±5.9 |
31.7±8.1 |
|
*– р < 0,05 по отношению к интактным крысам.
Снижение эндотелий-зависимой вазодилатации может быть следствием изменения активности эндотелиальной NO-синтазы (eNOS), снижения синтеза оксида азота (NO) из L-аргинина и чувствительности гладкомышечных клеток к NO или усиления деградации NO за счет взаимодействия с активными формами кислорода и др. [6; 10]. Для оценки функционирования системы синтеза NO мы использовали блокатор эндотелиальной NO-синтазы метиловый эфир L-аргинина (L-NAME). Внутривенное введение L-NAME интактным крысам приводило к уменьшению числа дилататорных реакций пиальных артериальных сосудов на АЦХ в среднем на 44.22% (p<0.05). Число сузившихся и не изменивших диаметр сосудов при этом достоверно не изменялось (таблица). У крыс, перенесших ишемию, при введении L-NAME изменение дилататорной реакции на орошение раствором ацетилхолина отмечалось в период от 2 до 14 дней после ишемии. Увеличивалось число расширившихся на АЦХ сосудов и амплитуда сосудистой реакции (рис. 2). Наибольшие изменения дилататорной реакции на АЦХ наблюдались через 14 дней после перенесенной ишемии (таблица). Число констрикторных реакций на ацетилхолин на фоне введения L-NAME достоверно уменьшалось уже через 2 дня после перенесенной ишемии. Снижение числа сузившихся артерий сохранялось на протяжении всего исследованного постишемического периода (21 день) и составило в среднем 36.44±3.82% (p<0.05). Изменение числа сосудов, не реагирующих на орошение раствором АЦХ, на фоне L-NAME отмечалось только в группах крыс через 2, 14 и 21 день после перенесенной ишемии. На основе полученных данных можно предположить, что у крыс после перенесенной ишемии изменение вазомоторной функции эндотелия, вероятно, связано с нарушением продукции оксида азота на уровне ферментных систем.
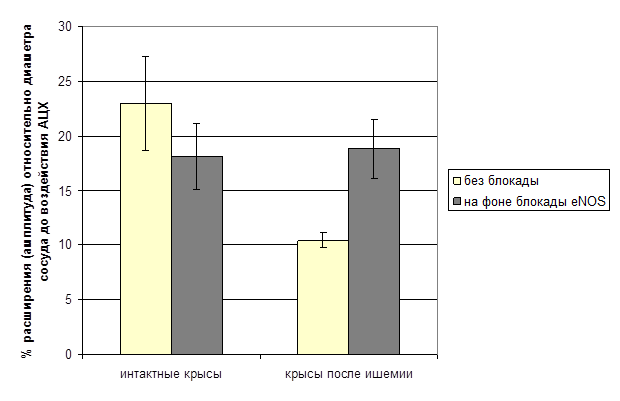
Рис. 2. Амплитуда дилататорной реакции пиальных артериальных сосудов на ацетилхолин у интактных и перенесших ишемию крыс
* - достоверность отличий между значениями до и после блокады eNOS, р < 0,05.
Изменение реакций на АЦХ также может быть связано с развитием структурных изменений эндотелиального слоя сосудистой стенки. Для проверки этого предположения нами была проведена серия экспериментов по определению количества циркулирующих эндотелиальных клеток в периферической крови. Исследования показали, что в плазме крови интактных крыс содержание эндотелиальных клеток составляло в среднем (9,06±1,72)х104 кл/л. Изменение числа циркулирующих эндотелиальных клеток в постишемическом периоде было обнаружено только через 7 дней после перенесенной ишемии (рис. 3). Отмечалось резкое, в среднем в 2 раза, увеличение содержания ЦЭК в крови, что может быть связано с усилением десквамации эндотелиальных клеток в результате повреждения эндотелия [5]. Нарушение целостности эндотелиального слоя с обнажением субэндотелиальных структур в этот отрезок постишемического периода может быть причиной наблюдавшегося нами в дальнейшем (через 14 дней после перенесенной ишемии) наиболее значительного изменения эндотелий-зависимых сосудистых реакций на АЦХ.
![]()
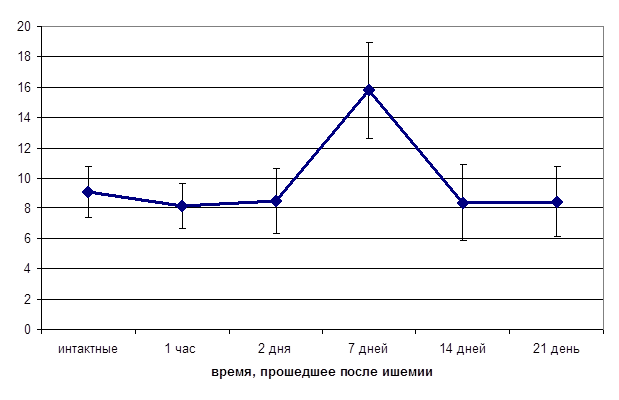
Рис. 3. Число циркулирующих десквамированных эндотелиальных клеток в 1 л плазмы крови
* - достоверность отличий, р < 0,05.
Заключение
Таким образом, нами было установлено, что однократная кратковременная транзиторная ишемия головного мозга приводит к угнетению эндотелий-зависимых вазодилататорных реакций пиальных артериальных сосудов на ацетилхолин, наблюдаемых в течение 21 дня после перенесенной ишемии. Снижение вазодилататорной активности эндотелия, вероятно, вызвано изменениями эндотелий-опосредованной продукции вазоактивных соединений, связанными с нарушением образования оксида азота на уровне ферментных систем, и структурными повреждениями сосудистого эндотелия.
Работа поддержана Программой Президиума РАН I.26П, проект 0134-2015-0002.
Библиографическая ссылка
Горшкова О.П., Шуваева В.Н., Ленцман М.В., Артемьева А.И. ПОСТИШЕМИЧЕСКИЕ ИЗМЕНЕНИЯ ВАЗОМОТОРНОЙ ФУНКЦИИ ЭНДОТЕЛИЯ // Современные проблемы науки и образования. 2016. № 5. ;URL: https://science-education.ru/ru/article/view?id=25270 (дата обращения: 23.01.2026).



