При облучении нерезистентного, мутантного штамма E. coliWP2 электромагнитным полем сверхвысокой частоты (ЭМП СВЧ) нетеплового уровня плотности потока мощности Г.В. Козьминым и Е.И. Егоровой было обнаружено снижение выживаемости мутантного штамма E. coliher’ ехг’. Использовались частоты от 8,82 ГГц до 10,4 ГГц и времена экспозиции от 30 до 150 мин. Максимальное снижение выживаемости 50 % на частоте 10,14 ГГц при максимальном времени экспозиции 150 мин. На диком штамме достоверного снижения выживаемости достичь не удалось, что авторы объясняют тем, что у не мутировавшего штамма системы репарации не нарушены, и под воздействием ЭМП СВЧ они активизируются, компенсация повреждений происходила за счет ускорения процессов метаболизма [4].
Для проверочного эксперимента бы выбран штамм 3-й – 4-й групп патогенности АТСС 25922.
Использовалась нетепловая плотность потока мощности. При анализе данных [4] было сделано предположение, что отрицательный результат на диком штамме был получен в виду недостаточного времени экспозиции.
Источник ЭМП СВЧ – генератор Г4-156 на диоде Ганна, обеспечивающий генерацию плоскопараллельных волн.
Время экспозиции, 180 мин., не менялось.
Пробирки изолировались черной бумагой с отсутствием тяжелых металлов в черной краске, чтобы не экранировать СВЧ ЭМП. При обработке данных изменения температуры не учитывались. Подробности, схема установки, методика подготовки культур даны в Приложениях 1, 2. Методика выполнения микробиологических работ проведена в соответствии с [6].
В [3] получены предварительные данные.
В трех сериях экспериментов были получены следующие результаты (табл.1, 2).
Таблица 1
Воздействие СВЧ
|
Частота, ГГц |
9,2 |
9,4 |
9,6 |
9,8 |
10,0 |
|
КОЕ/1 мл, от начального числа, % |
42,5 |
60,0 ± 74,4 |
34,5 ± 30,9 |
70,5 ± 95,3 |
110,5 ± 82,6 |
Таблица 2
Воздействие света и СВЧ
|
Частота, ГГц |
9,2 |
9,4 |
9,6 |
9,8 |
10,0 |
|
КОЕ/1 мл, от начального числа, % |
66,8 ± 22,4 |
187 ± 236 |
76,5 ± 6,4 |
170 ± 89 |
134 ± 45 |
Интервалы для математических ожиданий получены стандартным образом.Гауссово распределение данных укладывается в рассчитанные интервалы с вероятностью 95 %.
В [5] определена температурная зависимость выживаемости E. Coli. Однако коррекция по температуре не проводилась ввиду незначительного изменения температуры в течение одного эксперимента и удаленности от участка 36–37 градусов, где выживаемость меняется значительно.
Выводы:
1. Подтверждены результаты [4] (снижение выживаемости E. coli под воздействием СВЧ ЭМП).
2. Подтверждено предположение, что для преодоления сопротивляемости штамма нужно увеличить время экспозиции.
Снижение выживаемости под воздействием СВЧ ЭМП оказалось более значительно, более чем в два раза, чем в [4]. Авторы [4] объясняют снижение выживаемости микроорганизмов под воздействием ЭМП индуцированием синтеза колицина, ссылаясь на то, что при облучении колициногенного штамма E.coli C600 СВЧ ЭМП с плотностью потока мощности 5 мкВт/см2 при времени экспозиции 30 мин. наблюдали достоверное индуцирование синтеза колицина в 2–3 раза. Депрессия кол-фактора под воздействием СВЧ ЭМП, чья функциональная активность обычно репрессирована, приводит к синтезу колицина; клетка при этом погибает.
Авторы также считают, что волны миллиметрового диапазона влияют на генетический аппарат клетки.
Возможно также, что воздействие СВЧ ЭМП изменяет скорость фермент-субстратных реакций.
Более вероятным представляется – в виду порядка длины волны – что ЭМП не миллиметрового, а СВЧ-диапазона могут влиять на генетический материал клетки, и снижение выживаемости обусловлено действием ЭМП СВЧ именно на макромолекулы клетки E. coli.
3. Получен побочный результат – повышение выживаемости под воздействием дневного света. В отличие от [9], где выживаемость понижается под воздействием красного и синего света, в отличие от [7], где выживаемость немного повышается под действием красного света и не меняется под действием зеленого, в нашем эксперименте выявлено резкое повышение выживаемости. Снижение выживаемости на двух частотах может быть объяснено изменением потока света.
Не исключен вариант, что на двух частотах сыграло роль поглощение СВЧ ЭМП макромолекулами клетки.
Известно, что УФ с длиной волны 250–320 нм обладает наибольшей биологической активностью и может при низкой интенсивности повреждать субклеточные структуры. Изучено влияние УФ на репродуктивную гибель клеток, вызванную повреждением их ДНК. Ключевым моментом в повреждении клеточных мембран УФ излучением является процесс перекисного фотоокисления липидов, приводящий к изменению структуры мембраны и нарушению ее целостности в результате формирования гидрофильных пор. Поглощают УФ-излучение перекиси и гидроперекиси липидов. Красный свет в составе дневного света оказывает фотозащитное и фотореактивирующее действие при облучении УФ [8].
Кроме того, у клетки имеются собственные антиоксидантные системы.
Известно, что воздействие УФ инициирует перекисное окисления липидов.
Алифатическая цепь фосфолипидов клеточной мембраны может содержать 4 углеродные двойные связи, последовательное окисление которых дает достаточно устойчивые и хроматографически разрешимые продукты перекисного окисления липидов.
Возможно, именно последовательный разрыв двойных связей алифатических цепей фосфолипида, обладающих разной энергетической чувствительностью к кванту ультрафиолетового света в присутствии свободного кислорода, приводит к появлению четырех промежуточных продуктов перекисного окисления.
Присутствие собственных антиоксидантов меняет картину фотолиза. Они ингибируют перекисное окисление липидов за счет взаимодействия с перекисными и другими радикалами, инициирующими окисление [1].
Таким образом, разрушительное воздействие слабого УФ на мембраны может быть несущественным, что и показали наши эксперименты. Напротив, ультрафиолет может оказывать стимулирующее действие на митоз. Возможно, что эффект повышения выживаемости связан с резонансным поглощением системой ![]() -уровней ДНК (см. [2]) волн с частотой на границе ультрафиолета-А и ультрафиолета-В, не поглощаемых стеклом.
-уровней ДНК (см. [2]) волн с частотой на границе ультрафиолета-А и ультрафиолета-В, не поглощаемых стеклом.
Приложение 1
Методика выполнения работы
1. Стадия пробоподготовки: в эксперименте использовалась суточная бульонная культура E.coli АТСС 25922. Готовились десятикратные разведения культуры в изотоническом растворе натрия хлорида: рабочее разведение 1:100 (10-2) – контрольный и опытный образцы.
2. Рабочие разведения подвергались воздействию СВЧ-излучения низкой интенсивности.
3. Разведения культуры, подвергнутые СВЧ-воздействию (контрольные и опытные образцы), использовали для приготовления последовательных десятикратных разведений до 10-7
4. Осуществляли посев газоном на плотную питательную среду (питательный агар) 0,1 мл разведений 10-6 и 10-7 контрольных и опытных образцов в двух повторах. Чашки помещали в термостат на 24 ч при температуре 37°С.
5. Учет результатов осуществляли путем подсчета колоний в чашках (использовалось среднее арифметическое число, полученное при подсчете колоний на двух чашках соответствующего разведения), производился пересчет концентрации микроорганизмов в пробе (с учетом разведения и посевной дозы).
Приложение 2
Схема экспериментальной установки для облучения микроорганизмов
Схема экспериментальной установки для облучения микроорганизмов СВЧ-излучением низкой интенсивности представлена на рисунке. Источником СВЧ-излучения служил генератор AgilentTechnologiesE82570 1. Сигнал с выхода генератора через коаксиальный кабель 2, поступал на вход СВЧ-усилителя AgilentTechnologies 83020А. Усиленный до мощности 1 Вт СВЧ-сигнал через коаксиально-волноводный переход 4, ферритовый вентиль 5, согласующий трансформатор 7 и плавный переход с волновода прямоугольного сечения на волновод круглого сечения 7, поступал на вход ячейки Фарадея 9. Регулируя величину постоянного тока, протекающего через обмотку ячейки от источника 9, можно было изменять ориентацию вектора напряженности электрического поля ![]() . С выхода ячейки Фарадея СВЧ-излучение (волна Н11) через коническую рупорную антенну 10, диэлектрическую линзу 11 и СВЧ-зеркало 12 направлялось вдоль безэховой камеры 13 на пробирки с микроорганизмами 14, подвешенными на тонких хлопчатобумажных нитях к текстолитовой опоре 15. Для контроля ориентации вектора
. С выхода ячейки Фарадея СВЧ-излучение (волна Н11) через коническую рупорную антенну 10, диэлектрическую линзу 11 и СВЧ-зеркало 12 направлялось вдоль безэховой камеры 13 на пробирки с микроорганизмами 14, подвешенными на тонких хлопчатобумажных нитях к текстолитовой опоре 15. Для контроля ориентации вектора ![]() в безэховой камере использовалась пирамидальная рупорная антенна 16. Сигнал с ее выхода через ферритовый вентиль 18 поступал на СВЧ-детекторную секцию 19. Продетектированный сигнал контролировался цифровым осциллографом 20. Для повышения точности измерения положения вектора
в безэховой камере использовалась пирамидальная рупорная антенна 16. Сигнал с ее выхода через ферритовый вентиль 18 поступал на СВЧ-детекторную секцию 19. Продетектированный сигнал контролировался цифровым осциллографом 20. Для повышения точности измерения положения вектора ![]() рупорная антенна 16 вращалась вокруг своей оси до получения минимума сигнала на осциллографе, при этом направление вектора
рупорная антенна 16 вращалась вокруг своей оси до получения минимума сигнала на осциллографе, при этом направление вектора ![]() в безэховой камере 13 было перпендикулярно длинной стороне раскрыва антенны.
в безэховой камере 13 было перпендикулярно длинной стороне раскрыва антенны.
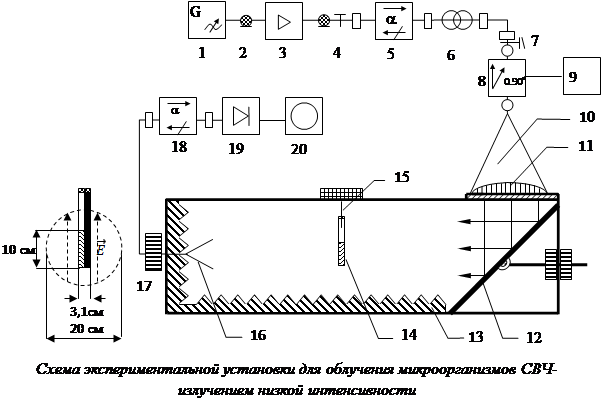
Эксперименты проводились при фиксированных частотах СВЧ-генератора: 9,0; 9,2; 9,4; 9,6; 9,8 и 10,0 ГГц. Мощность выходного сигнала СВЧ-генератора составляла 0 дБм (1 мВт), коэффициент усиления усилителя – +30 дБм, таким образом мощность сигнала на выходе усилителя была равна 1 Вт. Сечение СВЧ-пучка на уровне половинной мощности и проекция пробирок с микроорганизмами представлены в левой части рисунка.
На рисунке показана также ориентация вектора ![]() , которая во всех опытах была вертикальной, направленной вдоль осей пробирок. Суммарные потери энергии, включая потери в антенно-волноводном тракте, рассеяние за пределами сечения на уровне половинной мощности и отражение от облучаемых пробирок с микроорганизмами, составляли порядка 20 % генерируемой мощности. Площадь СВЧ-пучка внутри радиуса половинной мощности равнялась
, которая во всех опытах была вертикальной, направленной вдоль осей пробирок. Суммарные потери энергии, включая потери в антенно-волноводном тракте, рассеяние за пределами сечения на уровне половинной мощности и отражение от облучаемых пробирок с микроорганизмами, составляли порядка 20 % генерируемой мощности. Площадь СВЧ-пучка внутри радиуса половинной мощности равнялась ![]() . Таким образом, поток мощности СВЧ-излучения, воздействовавший на исследуемые микроорганизмы, составлял примерно
. Таким образом, поток мощности СВЧ-излучения, воздействовавший на исследуемые микроорганизмы, составлял примерно ![]() . Расстояние по оси СВЧ-пучка от диэлектрической линзы 11 до центра пробирок 14 составляло 130 см, что обеспечивало работу в дальней зоне СВЧ-излучения антенны с линзой.
. Расстояние по оси СВЧ-пучка от диэлектрической линзы 11 до центра пробирок 14 составляло 130 см, что обеспечивало работу в дальней зоне СВЧ-излучения антенны с линзой.
В опытах использовались стеклянные пробирки диаметром 15,5 мм с толщиной стенки 1 мм. Высота столба жидкости с микроорганизмами составляла 10 см. Собиралась батарея из двух пробирок, одна из которых была обмотана черной фотографической бумагой для защиты микроорганизмов от воздействия дневного света, а другая пробирка оставалась прозрачной. Для исследования влияния фотобумаги был проведен дополнительный опыт. Приемная антенна 17 ориентировалась по максимуму сигнала на осциллографе 20, затем в безэховой камере 13 размещался (на месте расположения пробирок 14) лист черной фотографической бумаги, при этом показания осциллографа изменялись менее чем на 5 %. Таким образом, поглощением СВЧ-излучения фотобумагой можно было пренебречь.
Облучение пробирок с микроорганизмами E.coli 25922ATCC (American type culture collection) СВЧ-излучением низкой интенсивности проводилось в течение 3 часов. Температура окружающей среды контролировалась термометром и изменялась при проведении каждого опыта не более чем на 0,5°С. В разные дни проведения экспериментов температура составляла от 19 до 24°С. Для контроля воздействия СВЧ-излучения на микроорганизмы две контрольные пробирки с микроорганизмами, одна закрытая фотобумагой, другая прозрачная, размещались в той же лаборатории за пределами безэховой камеры.
Библиографическая ссылка
Ихлов Б.Л., Ощепков А.Ю., Мельниченко А.В., Вольхин И.Л., Новикова В.В., Чиркова Л.А. О ВЛИЯНИИ ЭЛЕКТРОМАГНИТНОГО ПОЛЯ ВЫСОКОЙ ЧАСТОТЫ НА E. COLI // Современные проблемы науки и образования. 2016. № 5. ;URL: https://science-education.ru/ru/article/view?id=25259 (дата обращения: 23.12.2025).



