Важной и актуальной проблемой современной кардиологии и кардиоморфологии являются кардиотоксические эффекты, вызываемые лекарственными препаратами с противоопухолевой активностью. Такие эффекты обусловливают, как правило, развитие необратимой кардиомиопатии и сердечной недостаточности в течение длительных сроков после окончания лечения, что является серьезной медико-биологической проблемой [13]. В комбинированных схемах лечения неопластических процессов широко применяется циклофосфамид, обладающий, в том числе, и доказанными кардиотоксическими свойствами [11].
При его применении в терапевтических дозах у больных отмечаются обратимые нарушения систолической функции сердца, и может развиваться сердечная недостаточность [4, 7]. При введении препарата в дозах свыше 240 мг/кг происходит нарушение сердечной деятельности, которое сопровождается повреждением эндотелия и геморрагическим миокардитом [5]; примерно у 11 % пациентов, получавших высокую дозу циклофосфамида, развивается фатальная кардиомиопатия [14]. Считается, что основной вклад в развитие кардиомиопатии вносит акролеин (один из основных метаболитов циклофосфамида), вызывающий селективное повреждение миофиламентов путем химической модификации сократительных белков и белков цитоскелета [10].
К системным расстройствам при приеме циклофосфамида относится его иммуносупрессивное действие, влияние на репродуктивную функцию и риск вторичных лейкозов [9]. В комплексе с кардиомиопатией наблюдаются системная и легочная артериальная гипертензия, ухудшение функционирования печени и почек [8].
Несмотря на то, что некоторые дозозависимые кардиотоксические эффекты циклофосфамида установлены и описаны [15], механизмы, обусловливающие кардиочувствительность к препарату, и способы протекции миокарда до сих пор остаются не выясненными.
Необходимость купирования цитотоксических эффектов кардиотоксических агентов определяет значимость разработки новых цитопротекторных (кардиопротекторных) препаратов и тестирование существующих лекарственных форм с целью установления их новых биологических свойств. В частности, использование аспарагината при моделировании циклофосфановой кардиомиопатии может быть обусловлено тем, что он способствует проникновению ионов K+и Mg2+ во внутриклеточное пространство кардиомиоцитов, стимулирует синтез макроэргических соединений и может, тем самым, оказывать цитопротекторное действие.
Цель работы – изучить структурные основы ремоделирования миокарда при действии циклофосфамида и корректора ионного обмена K+и Mg2+.
Материал и методы исследования
В эксперименте использованы крысы-самцы линии WAG (n=26), которых содержали в стандартных условиях вивария на полноценном рационе, вода ad libitum. Эксперименты проводили с соблюдением всех правил и рекомендаций Европейской конвенции по защите позвоночных животных, используемых в экспериментальных работах.
Животные были разделены на 3 группы. Крысам 1-й группы (n=10) вводили циклофосфамид («Бакстер Онкология ГмбХ», Германия) в дозе 125 мг/кг в растворе 0,9 % NaCl внутрибрюшинно однократно. Крысам 2-й группы (n=10) однократно внутрибрюшинно вводили аспарагинат калия и магния (аспаркам-L, «Биосинтез», Россия) в дозе 125 мг/кг, через 30 мин – однократно внутрибрюшинно вводили циклофосфамид в той же дозе, что и крысам 1-й группы. Контрольная группа (6 крыс) – одновременно с подопытными крысами внутрибрюшинное однократное введение физиологического раствора в соответствующем их массе тела объеме. Забор материала производили через 1 и 3 сут. после введения препаратов.
Образцы стенки левого желудочка сердца фиксировали в 10 % нейтральном формалине для дальнейшего исследования методами световой микроскопии и в 4 % параформальдегиде для получения полутонких срезов.
Стереологический анализ миокарда крыс включал определение объемной плотности основных структурных компонентов – кардиомиоцитов, их ядер, капилляров, суммарно клеток, волокон и основного вещества соединительной ткани. Для этого на полутонких срезах при увеличении в 1000 раз определяли площадь сечения анализируемых объектов и относили ее к тестовой площади (9395,54 мкм2). Используя объемные плотности основных структур миокарда, вычисляли их объемные отношения. Диаметр и длину кардиомиоцитов измеряли в клетках с ядрами на срезах, используя компьютерную программу «Leica QWin3», после калибровки при увеличении в 400 раз. Объем выборки составлял не менее 50 неперекрывающихся полей зрения на одно животное.
Исследование срезов и стереологический анализ проводили в универсальном микроскопе «Leica DM 4000B», оснащенном цифровой фотокамерой «Leica DFC 320», с помощью компьютерной программы «Leica QWin3».
Статистический анализ количественных данных включал определение средних значений параметров и стандартных ошибок средних. Различия между группами определяли с помощью критерия Стьюдента при уровне значимости p=0,05.
Результаты исследования и их обсуждение
Однократное введение циклофосфамида (в дозе 125 мг/кг) не вызывало гибели животных, крысы сохраняли активность, количество съеденной пищи не отличалось от контроля. По данным массометрического анализа, масса тела животных снижалась незначительно, наиболее существенно (на 7 %) – на 3-и сутки после введения циклофосфамида и аспарагината калия и магния (таблица). Масса сердца также снижалась незначительно, что можно объяснить достаточно коротким сроком наблюдения.
Массометрический и тканевый стереологический анализ миокарда при введении циклофосфамида и аспарагината K+, Mg2+ (M±m)
|
Показатель |
Контроль |
Введение циклофосфамида (1-я группа) |
Введение циклофосфамида и аспарагината K+и Mg2+ (2-я группа) |
|||
|
1 сут. |
3 сут. |
1 сут. |
3 сут. |
|||
|
Масса тела, г |
333,2±9,4 |
315,0±12,0 |
310,2±12,4 |
315,2±22,6 |
309,5±7,8 |
|
|
Масса сердца, г |
1,05±0,04 |
0,94±0,04 |
0,95±0,07 |
0,98±0,07 |
0,94±0,03 |
|
|
Объемная плотность (%): |
||||||
|
кардиомиоцитов, |
86,66±0,91 |
82,48±0,36* |
77,72±1,86* |
80,40±1,68* |
76,54±1,20** |
|
|
в том числе с литическими повреждениями |
5,35±0,46 |
22,27±1,69*** |
30,87±0,43***,+ |
23,04±0,62*** |
17,89±1,46*** |
|
|
ядер кардиомиоцитов |
0,89±0,16 |
0,68±0,07 |
0,75±0,11 |
0,80±0,19 |
0,69±0,06 |
|
|
капилляров |
5,63±0,36 |
7,63±0,63* |
6,98±0,24* |
8,12±0,64* |
8,90±0,96* |
|
|
соединительной ткани |
7,71±0,92 |
9,89±0,98 |
15,30±1,73* |
11,48±2,13 |
14,56±1,17* |
|
|
Объемное отношение (число): |
||||||
|
капилляров к кардиомиоцитам |
0,065±0,004 |
0,092±0,007* |
0,090±0,005* |
0,101±0,007* |
0,117±0,013* |
|
|
соединительной ткани к кардиомиоцитам |
0,089±0,012 |
0,120±0,012 |
0,198±0,027* |
0,144±0,029 |
0,191±0,017* |
|
Примечание: * – p <0,05; ** – p <0,01, *** – p <0,001 при сравнении с контролем; + – p <0,05 при сравнении с более ранним сроком.
У большинства животных 1-й группы через 1 сут. после введения циклофосфамида сохранялась нормальная архитектоника миокарда, но наблюдалась мозаичность окрашивания кардиомиоцитов кислыми красителями, обусловленная присутствием клеток с неизмененными тинкториальными свойствами (таких было большинство), клеток с выраженными литическими изменениями саркоплазмы и клеток с контрактурными повреждениями (эозинофильные мышечные сегменты) (рис. 1, а). Объемная плотность кардиомиоцитов с литическими повреждениями была увеличена в 4,2 раза по сравнению с контрольными животными, что свидетельствовало о выраженном кардиотоксическом эффекте циклофосфамида [1, 2]. У всех животных наблюдались нарушения гемодинамики, прежде всего, венозное и капиллярное полнокровие, в некоторых случаях – периваскулярный и интерстициальный отек.
а 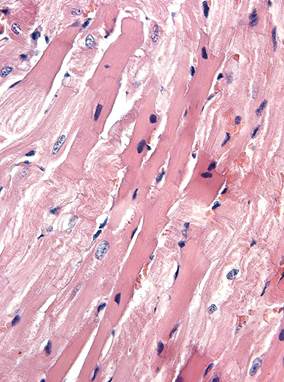 б
б 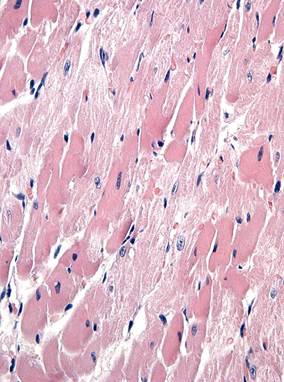
Рис. 1. Миокард крысы после введения циклофосфамида. Окраска гематоксилином и эозином. Ув. 400
а – через 1 сут.; кардиомиоциты с литическими повреждениями и околоядерными «опустошениями» саркоплазмы; «Малые» кардиомиоциты с близко расположенными ядрами; б – через 3 сут.; кардиомиоциты с выраженными литическими повреждениями и околоядерными «опустошениями» саркоплазмы.
Через 3 сут. после введения циклофосфамида возрастало количество кардиомиоцитов с околоядерными «опустошениями» саркоплазмы (рис. 1, б) и литическими повреждениями саркоплазмы (объемная плотность таких кардиомиоцитов возрастала в 5,8 раза по сравнению с контролем и на 38,6 % по сравнению с 1-ми сутками) (см. таблицу). Выявленные ранее нарушения гемодинамики через 3 сут. после введения цитостатика усиливались. В этот же срок появлялись мелкоочаговые некрозы миокарда и умеренная мононуклеарная инфильтрация стромы. Регистрировался умеренный интерстициальный и периваскулярный фиброз.
В миокарде крыс после введения циклофосфамида во все сроки эксперимента регистрировались «малые» кардиомиоциты (длина таких клеток составляла 38,91±1,76 и 45,02±1,13 мкм соответственно через 1 и 3 сут. эксперимента, а их диаметр – соответственно 13,32±0,42 и 16,84±0,56 мкм; средняя длина основной массы кардиомиоцитов составляла соответственно 114,11±5,08 и 110,94±2,33 мкм, а их диаметр – соответственно 16,32±0,53 и 16,42±0,62 мкм через 1 и 3 сут. эксперимента). Малые кардиомиоциты были, как правило, с интенсивно эозинофильной саркоплазмой и близко расположенными небольшими ядрами, также интенсивно окрашенными (см. рис. 1). Малые кардиомиоциты содержали часто по два близко расположенных (или не разошедшихся) ядра, что можно считать морфологическим эквивалентом прошедшего кариокинеза. Подобная картина соответствует также завершению телофазы и не свойственна зрелым кардиомиоцитам. Малые кардиомиоциты по ряду описанных выше морфологических признаков можно отнести к новообразованным и рассматривать в качестве одной из составляющих репликативного пула.
У крыс 2-й группы, получивших циклофосфамид и аспарагинат калия и магния, через 1 сут. большинство кардиомиоцитов сохраняло нормальные морфологические и тинкториальные свойства, в то же время регистрировались кардиомиоциты с контрактурными и литическими изменениями, небольшие очаги кардиосклероза (рис. 2, а). Объемная плотность кардиомиоцитов с литическими повреждениями была увеличена в 4,3 раза. Нарушения гемодинамики проявлялись в виде полнокровия сосудов, сладжа эритроцитов, умеренного интерстициального отека. Строма миокарда была незначительно инфильтрирована мононуклеарными клетками, преимущественно периваскулярно; артериолы находились в состоянии спазма или вторичного пареза.
а 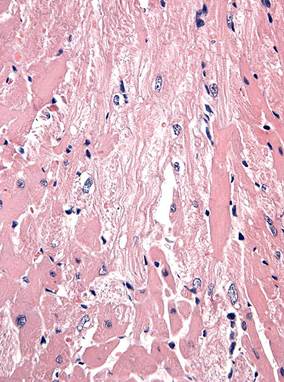 б
б 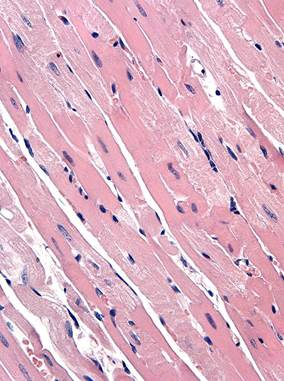
Рис. 2. Миокард крысы после введения циклофосфамида и аспарагината калия и магния. Окраска гематоксилином и эозином. Ув. 400
а – через 1 сут; выраженные литические повреждения кардиомиоцитов; б – через 3 сут; умеренные литические повреждения кардиомиоцитов.
Через 3 сут после воздействия в миокарде животных 2-й группы объемная плотность кардиомиоцитов с литическими изменениями была увеличена в 3,3 раза по сравнению с контрольными крысами, но снижена на 22 % по сравнению с предыдущим сроком (рис. 2, б). Ядра в таких клетках часто смещались в подсарколеммальную зону. Среди кардиомиоцитов с литическими повреждениями следует отметить увеличение числа клеток с околоядерными «опустошениями» саркоплазмы. Регистрировались гемодинамические нарушения, которые сопровождались умеренной инфильтрацией стромы миокарда мононуклеарами. В миокарде крыс 2-й группы также регистрировались «малые» кардиомиоциты с близко расположенными ядрами, что можно считать морфологическим эквивалентом прошедшего кариокинеза.
У животных обеих экспериментальных групп отмечалась тенденция к снижению объемной плотности кардиомиоцитов: на 1-е сутки эксперимента – на 4,8 и 7,2 % по сравнению с контролем (соответственно в 1-й и 2-й группах, p<0,05). К концу эксперимента снижение было еще более выражено – на 10,3 и 11,7 % (соответственно у крыс 1-й и 2-й групп по сравнению с контролем, p<0,01) (см. таблицу). Объемная плотность соединительной ткани, наоборот, достоверно возрастала к окончанию эксперимента – на 98,4 и 88,8 % по сравнению с контролем (соответственно у крыс 1-й и 2-й групп, p<0,05). В результате этих изменений происходило увеличение объемного отношения соединительной ткани к кардиомиоцитам – на 122,5 и 114,6 % на 3-и сутки эксперимента (соответственно у крыс 1-й и 2-й групп, p<0,05).
Относительный объем капилляров возрастал у крыс обеих групп, что объяснялось в значительной степени наблюдавшимся полнокровием сосудов. У крыс 1-й группы объемная плотность капилляров возрастала на 35,5 и 24 % соответственно через 1 и 3 сут эксперимента (p<0,05); у крыс 2-й группы – соответственно на 44 и 58 % через 1 и 3 сут эксперимента (p<0,05). В результате этих изменений объемное отношение капилляров к кардиомиоцитам также увеличивалось. У крыс 1-й группы наиболее значительно объемное отношение капилляров к кардиомиоцитам было увеличено через 1 сут эксперимента (на 41 %, p<0,05), у крыс 2-й группы – к концу эксперимента (на 80 %, p<0,05) (см. таблицу).
Циклофосфамид вызывает Са2+ -зависимые повреждения миокарда и печени, митохондрии теряют способность сохранять депо ионов Са2+ [12]. В миокарде при действии циклофосфамида усиливается экспрессия проапоптотических генов (p53, BAX) и подавляется экспрессия антиапоптотического гена BCL2 [3].
Ионы K+ и Mg2+ регулируют метаболические процессы, способствуют восстановлению электролитного баланса, оказывают антиаритмическое действие. K+ участвует как в проведении импульсов по нервным волокнам, так и в синаптической передаче, осуществлении мышечных сокращений, поддержании нормальной сердечной деятельности. В малых дозах K+ расширяет коронарные артерии, в больших – способствует их сужению; оказывает отрицательное хроно- и батмотропное действие, в высоких дозах – отрицательное ино- и дромотропное, а также умеренное диуретическое действие. Mg2+ является кофактором (в том числе для АТФ) и активатором около 800 известных ферментативных реакций [6].
Таким образом, циклофосфамид-индуцированная кардиомиопатия (при однократном введении циклофосфамида в дозе 125 мг/кг) развивается уже в течение 3 сут после введения препарата и характеризуется литическими изменениями кардиомиоцитов с появлением околоядерных зон «опустошений» саркоплазмы, развивающимися на фоне гемодинамических нарушений (венозного и капиллярного полнокровия, лимфостаза и отека). Ремоделирование миокарда при циклофосфамид-индуцированной кардиомиопатии определяется увеличением объемного отношения соединительной ткани к кардиомиоцитам (на 122 %) и увеличением объемного отношения капилляров к кардиомиоцитам (на 40 %). Предварительное применение аспарагината калия и магния не уменьшает степень ремоделирования миокарда: объемное отношение соединительной ткани к кардиомиоцитам возрастает на 114 %, а объемное отношение капилляров к кардиомиоцитам – на 44 %. В то же время следует отметить, что у крыс, получавших аспарагинат калия и магния, через 3 сут. происходило снижение объемной плотности кардиомиоцитов с литическими повреждениями саркоплазмы по сравнению с показателем через 1 сут. эксперимента. Эти данные могут свидетельствовать о том, что положительный эффект аспарагината калия и магния при его применении с циклофосфамидом может проявляться в более отдаленные сроки.
Библиографическая ссылка
Лушникова Е.Л., Клинникова М.Г., Никитюк Д.Б., Колдышева Е.В., Южик Е.И., Мжельская М.М. СТРУКТУРНЫЕ ОСНОВЫ РЕМОДЕЛИРОВАНИЯ МИОКАРДА ПРИ ДЕЙСТВИИ ЦИКЛОФОСФАМИДА И КОРРЕКТОРА K+, MG2+-ИОННОГО ОБМЕНА В КАРДИОМИОЦИТАХ // Современные проблемы науки и образования. 2016. № 5. ;URL: https://science-education.ru/ru/article/view?id=25208 (дата обращения: 14.02.2026).
DOI: https://doi.org/10.17513/spno.25208



