В современной абдоминальной хирургии как плановые, так и экстренные оперативные вмешательства на полых органах брюшной полости, количество которых не имеет тенденции к снижению, зачастую может привести к целому ряду послеоперационных осложнений. В раннем послеоперационном периоде их количество достигает 19–25 %, среди них 11 % относятся к несостоятельности кишечных швов, а в условиях инфицирования брюшной полости этот показатель достигает 30 % [1]. Подобные осложнения часто приводят к присоединению различных воспалительных процессов, таких как развитие перитонита, формирование абсцессов и свищей, которые усугубляют течение послеоперационного периода и тяжесть состояния больного. Уровень летальности при развитии такого рода осложнений достигает 60 %. К несостоятельности швов межкишечных анастомозов приводят ряд причин, таких как погрешности в технике наложения кишечных швов, несовершенство используемого шовного материала, ишемия сшиваемого участка кишечника за счет нарушения микроциркуляции тканей после формирования анастомоза. В позднем послеоперационном периоде у 80 % пациентов после проведения операций на органах брюшной полости развивается спаечный процесс брюшной полости (СПБП). В 60 % случаев у пациентов развивается абдоминальный фиброз, который приводит к деформации части органа и нарушению его нормального функционирования [4].
В современной клинической медицине до настоящего времени остается актуальным поиск способов лечения и профилактики вышеупомянутых осложнений. Среди таких направлений как совершенствование шовного материала и техники оперативных вмешательств, разработка лекарственных средств, использование аутотканей, не менее значимым является полимерная имплантология [2]. Помимо использования и изучения различных полимерных гелей, губок, порошков, клеевых средств в полимерной имплантологии интерес направлен и на разработку биодеградируемых мембран [3]. Изучение эффективности их использования при абдоминальных оперативных вмешательствах с целью снижения риска возможных осложнений и оптимизации технологии операций является актуальным.
Среди прочих требований, предъявляемых к полимерным пленочным имплантам, применяемых в абдоминальной хирургии, немаловажными являются: отсутствие биотоксичности, т.е. имплант не должен оказывать негативного влияния на ткани организма; важен срок биодеградации мембран, изготовленных в различных технических и химических условиях. Срок пребывания импланта в зоне оперативного вмешательства должен обеспечить оптимальные условия для регенерации оперируемых тканей и препятствовать возникновению послеоперационных осложнений.
Важным условием выбора полимерной мембраны для использования в абдоминальной хирургии является степень реактивных изменений тканей в ответ на имплантацию изучаемого средства.
Цель исследования: в сравнительном аспекте изучить особенности ответной реакции тканей животного на подкожную имплантацию образцов полимерных пленочных имплантов в эксперименте «in vivo».
Материалы и методы
Для исследования были использованы 9 образцов полимерных мембран под номерами 70, 71, 72, 74, 75, 76, 77, 78, 79, разработанные ООО «Линтекс» (г. Санкт-Петербург). Все образцы изготовлены на основе полимеров карбоксиметилцеллюлозы и отличались друг от друга технологией изготовления (температурный режим, химические агенты, время высушивания и т.д.). Оперативные вмешательства проводили на лабораторных крысах самцах линии Вистар.
В эксперименте было сформировано 9 групп, соответствующих общему количеству экспериментальных образцов полимерных пленочных имплантов (ППИ). Всего прооперировано и выведено из эксперимента 90 животных. Оперативные вмешательства проводили под наркозом, в стерильных условиях операционного блока, с соблюдением всех принятых правил проведения экспериментальных исследований на животных.
Экспериментальным животным по срединной линии живота выполняли рассечение кожного и подкожно-жирового слоев. Тупым способом формировали два кармана между мышечным и подкожным слоями (по обе стороны от срединного разреза), глубиной до 3,5 см и длиной на протяжении всего разреза – 6 см. В каждый сформированный карман помещали образец ППИ размерами 2 × 1 см. Операционную рану ушивали с захватом мышечного слоя для изоляции двух сформированных карманов. Выведение животных из эксперимента проводили на 7-е и 14-е сутки.
Для морфологической оценки ответной реакции тканей брали комплекс тканей (кожный слой, подкожную клетчатку, мышечный слой и париетальную брюшину) в зоне имплантации полимерной мембраны размерами 10 × 10 мм. Для сравнительной оценки реакции соединительной ткани на ППИ, проводили морфологический анализ гистологических препаратов посредством световой микроскопии и подсчет клеточного индекса (отношение общего количества клеток-резидентов к общему количеству клеток-нерезидентов):
![]() (1)
(1)
где КИ – клеточный индекс; КР – клетки резиденты (общее количество макрофагов, фибробластов и фиброцитов); КН – клетки нерезиденты (общее количество гранулоцитов и моноцитов).
Статистическую обработку полученных данных проводили с использованием методики определения границ доверительного интервала (t) [5].
Результаты
При микроскопическом анализе гистологических препаратов, реактивные изменения тканей на 7-е сутки вокруг всех образцов полимерных мембран закономерны и заключаются в возникновении признаков воспалительного процесса в области, прилежащей к образцу. Визуализируются интерстициальный отек, лимфоцитарная инфильтрация, капилляростаз. Определяется высокая плотность клеток на единицу площади среза. Среди всех клеток соединительной ткани преобладают лимфоциты (наибольшее количество в препаратах, где использовались образцы 70, 71, 72, 75, 78 и 79). При анализе клеточного состава инфильтрата вокруг образцов 74, 76 и 77 количество фибробластов было максимальным (от 16,3 ± 0,21 до 18 ± 0,77), тогда как количество лимфоцитов было статистически значимо меньше в 1,5–2 раза, в сравнении с остальными образцами ППИ. У всех изученных образцов полимерных мембран наблюдалось статически значимое преобладание фибробластов над фиброцитами.
В результате подсчета клеточного индекса (КИ) было выявлено его максимальное значение в срезах, где использовался образец № 74 (КИ = 3,79 ± 0,22). При имплантации образцов 76 и 77 показатели КИ были в 1,3–1,7 раз меньше, однако статистически значимо больше в сравнении с оставшимися номерами образцов (рисунок 1).
Толщина зоны инфильтрации была максимальной при использовании образцов 71, 72, 75 (6,56 ± 0,81, 6,14 ± 0,17 и 8,56 ± 0,62 соответственно), а применение образцов 74, 76 и 77 – статистически значимо меньшей (рисунок 2). Минимальные значения толщины зоны инфильтрации соответствуют имплантированному образцу 74 (5,52 ± 0,04).
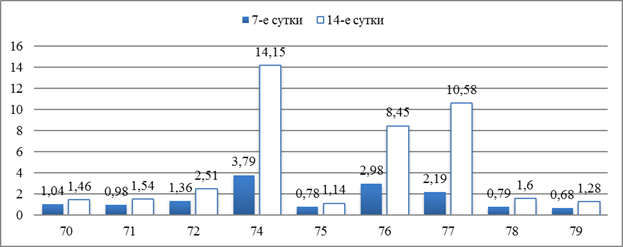
Рис.1. Значения клеточного индекса инфильтрата вокруг образцов полимерных мембран при их подкожной имплантации на сроках 7-е и 14-е сутки
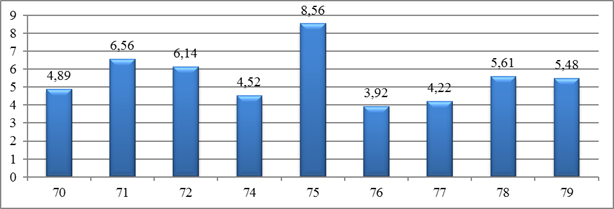
Рис.2. Показатели толщины зоны инфильтрации, образованной вокруг образцов полимерных мембран на 7-е сутки после имплантации, мм
К 14-м суткам эксперимента в тканях, которые окружали образцы ППИ, преобладают процессы пролиферации. Явления интерстициального отека отсутствуют. Вокруг всех образцов наблюдается уменьшение площади инфильтрата, появление тонкой, имеющей послойное строение, новообразованной соединительнотканной капсулы. Наибольшая толщина капсулы соответствует образцам № 74, 76 и 77 (рисунок 3).
В наружном, волокнистом слое капсулы визуализируются параллельно расположенные коллагеновые волокна, наибольшая степень зрелости которых соответствует образцам 74, 76 и 77. Во внутреннем клеточном слое преобладают клетки фибробластического ряда, наибольшее количество которых было выявлено при использовании тех же образов ППИ под номерами 74, 76 и 77. В сравнении с 7-ми сутками, у всех исследуемых образцов отмечалось преобладание фиброцитов над фибробластами среди клеток фибробластического ряда, с максимальными значениями у образцов 74, 76 и 77.
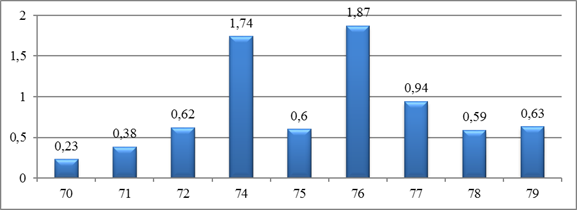
Рис. 3. Показатели толщины капсулы, образованной вокруг образцов полимерных мембран, на 14-е сутки после имплантации, мм
На фоне пролиферативных процессов в поле зрения продолжало оставаться высоким количество лимфоцитов при использовании образцов полимерных мембран 70, 75, 78 и 79, в сравнении с 7-ми сутками эксперимента статистически значимых отличий не было выявлено. При анализе значений КИ на 14-е сутки в сравнении с 7-ми сутками выявлено, что его значения выше в 4–5 раз при использовании образцов 74, 76, 77 и в 1,5–2 раза – при использовании остальных образцов, что было представлено на 1 рисунке.
В качестве примера разновидностей соединительнотканных капсул, образованных на 14-е стуки вокруг имплантированной полимерной мембраны, на рисунке 4 представлены микрофотоснимки разных по строению капсул.
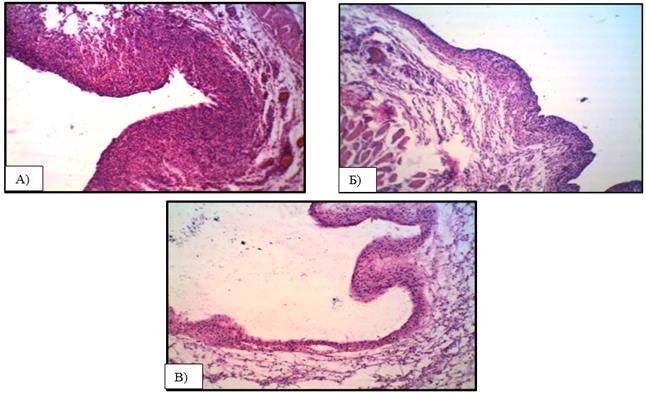
Рис. 4. Микрофотографии разных по строению соединительнотканных капсул, образованных вокруг имплантированной полимерной мембраны на сроке 14 сут. Окраска гематоксилин и эозин, ув. х 100; А) Капсула с преобладанием клеточного компонента;
Б) Капсула, состоящая из волокнистого и клеточного компонентов;
В) Капсула, с преобладанием волокнистого компонента
Таким образом, наименее выраженные реактивные изменения были выявлены при имплантации образцов 74, 76 и 77. Это объясняется тем, что на 7-е сутки была меньше площадь инфильтрата и на фоне преобладания в поле зрения лимфоцитов, количество клеток фибробластического ряда было больше, в сравнении с остальными образцами. На 14-е сутки наиболее зрелая капсула была образована также вокруг этих образцов.
Заключение
При анализе полученных результатов выявлено, что к 14-м суткам эксперимента после имплантации вокруг образцов полимерных мембран формируется новообразованная соединительнотканная капсула, происходит уменьшение площади инфильтрата, преобладают процессы пролиферации, что является закономерной реакцией тканей на инородный материал. Проведенное исследование подтверждает, что максимальной биологической инертностью обладают образцы полимерных мембран 74, 76 и 77.
Учитывая данные литературы и принципы клинической практики, импланты, применяемые в абдоминальной хирургии, должны быть биологически инертными, оказывать наименее выраженные реактивные изменения тканей в зоне имплантации, что указывает в пользу безопасности их использования. Имплантация полимерной мембраны не должна вызывать негативной реакции (отторжение, воспаление, некроз, нагноение и инфицирование). Поэтому такие показатели, как реактивные изменения окружающей соединительной ткани, образованной вокруг импланта, зрелость соединительнотканной капсулы, являются значимыми при выборе образца полимерной мембраны для дальнейших исследований. Каждый образец полимерных пленочных имплантов вызывает разную степень выраженности реакции тканей в ответ на его подкожную имплантацию, что связано с отличиями химического состава и физических параметров полимерных мембран, определяемых при их изготовлении. Полученные нами результаты позволяют судить о достаточной безопасности использования и биосовместимости изучаемых образцов полимерных мембран.
Выводы:
1. На 7-е сутки максимальные значения клеточного индекса инфильтрата вокруг имплантированных полимерных мембран соответствуют образцам 74, 76 и 77 (3,79 ± 0,22; 2,98 ± 0,32; 2,19 ± 0,18 соответственно), что статистически значимо больше в сравнении с другими вариантами образцов.
2. К 14-м суткам эксперимента вокруг образцов полимерных мембран № 74, 76 и 77 формируется новообразованная соединительнотканная капсула, показатели толщины которой (1,74 ± 0,26; 1,87 ± 0,34; 0,94 ± 0,24 соответственно) преобладают над толщиной капсулы остальных образцов, так же статистически существенные преимущества указанных образцов обнаружены при изучении соотношения фибробластов и фиброцитов в перипротезной капсуле.
3. Наименее выраженные реактивные изменения были выявлены при имплантации образцов 74, 76 и 77 в сравнении с остальными.
Библиографическая ссылка
Инархов М.А., Затолокина М.А., Липатов В.А., Ярмамедов Д.М. ИЗУЧЕНИЕ ОСОБЕННОСТЕЙ РЕАКТИВНЫХ ИЗМЕНЕНИЙ ТКАНЕЙ НА ПОДКОЖНУЮ ИМПЛАНТАЦИЮ НОВЫХ РАССАСЫВАЮЩИХСЯ МЕМБРАН НА ОСНОВЕ КАРБОКСИМЕТИЛЦЕЛЛЮЛОЗЫ В ЭКСПЕРИМЕНТАХ «IN VIVO» // Современные проблемы науки и образования. 2016. № 5. ;URL: https://science-education.ru/ru/article/view?id=25189 (дата обращения: 14.02.2026).



