Известно, что биохимический состав растений оказывает значительное влияние на степень предпочтения субстрата, их выживаемость и степень дефолиации крон древесных растений [5]. Вследствие этого параметры энтоморезистентности растений являются ключевыми, детерминирующими как возможность реализации вспышек массового размножения лесных насекомых-фитофагов, так и степень дефолиации крон и площади очагов [1]. Энтоморезистентность дифференцируется на конститутивную и индуцированную [9;12]. Конститутивная энтоморезистентность (природная) является генетически детерминируемой неповреждаемостью их насекомыми. На биохимическом уровне она обусловлена содержанием в хвое и листьях соединений, которые вызывают избегание и непредпочитаемость насекомыми этих растений [9;11]. Нередко они являются токсичными для насекомых (например: алкалоиды) [6]. Индуцированная энтоморезистентность активируется воздействием на растения различных экзогенных биотических и абиотических факторов [9;11]. При этом если биохимические аспекты механизмов индуцированной энтоморезистентности изучаются очень интенсивно [2; 3; 7; 9; 12; 13], то биохимические аспекты конститутивной энтоморезистентности изучены значительно меньше. Исходя из этого, биохимические аспекты конститутивной энтоморезистентности и были задачей данного исследования. Ранее этот вопрос нами изучался [4], но особенности сезонной динамики фенольных соединений (особенно фенолгликозидов, в значительной степени детерминирующих параметры энтоморезистентности у растений [10]) и количественные параметры изменения антиоксидантной активности не исследовались.
Материалы и методы
Для хроматографического анализа 20 мая был проведен сбор листьев березы повислой как из локальных затухших очаговмассового размножения непарного шелкопряда на пробных площадях с ежегодно регистрируемым процентом дефолиации крон, так и за границами очагов, где в течение 30 лет отсутствовала дефолиация. Взятие каждой пробы осуществлялось от нескольких деревьев. Затем пробы смешивались для получения средней пробы. Очаги массового размножения находились в Каменск-Уральском районе Свердловской области. Пробные площади располагались в березняках вблизи пос. Покровское. Контрольные пробы взяты в березняках вблизи пос. Храмцовское, растущих в сходных лесорастительных условиях.
Сразу после сбора листья березы высушивали при 60 °С, затем размалывали. Навеску с 2 г размолотых листьев смешивали с 20 мл 95 % этанола. Экстракцию фенольных соединений из листьев березы проводили в обратном холодильнике на водяной бане в течение 30 мин при кипении раствора. После этого суспензию центрифугировали при 10000 g в течение 10 мин. Супернатант фильтровали через фильтр с диаметром пор 0,2 мкм. Хроматографический анализ проводили на жидкостном хроматографе Shimadzu LC-20 со спектрофотометрическим УФ-детектором. Детектирование элюента осуществляли одновременно на двух полосах поглощения: 254 и 360 нм на хроматографической колонке PerfectSil Target ODS-35мкм с обращенной фазой, размером 250 х 4,6 мм. Градиентное элюирование проводилось в диапазоне 10–50 % со скоростью 1 мл/мин при температуре 40 °С. Элюент А – ацетонитрил – 0,05 М фосфатный буферный раствор (рН=3,0); элюент В – ацетонитрил-вода (9:1). Продолжительность хроматографического анализа – 45 мин при 40 °С. Из них от 0 до 30 мин проводилось градиентное элюирование в диапазоне 10–50 %, затем в течение 15 мин при концентрации 50 %. Для идентификации фенольных соединений использовали вещества-свидетели фирм: Fluka, Sigma, Aldrich: апигенин, аскорбиновая к-та, арбутин, гиперозид, галловая к-та, гидрохинон, кверцетин, изокверцетин, изокверцитрин, кафтаровая к-та, лютеолин, лютеолин-7-глюкозид, рутин, феруловая к-та, 4-кофеоилхинная к-та, 5-кофеоилхинная к-та, кемпферол, мирицетин, салицин, салидрозид.
Результаты
Градиентный хроматографический анализ (ВЭЖХ) образцов из листьев березы повислой, взятых как в затухших очагах непарного шелкопряда, так и за их границами, выявил 75 фенольных соединения (рис. 1).
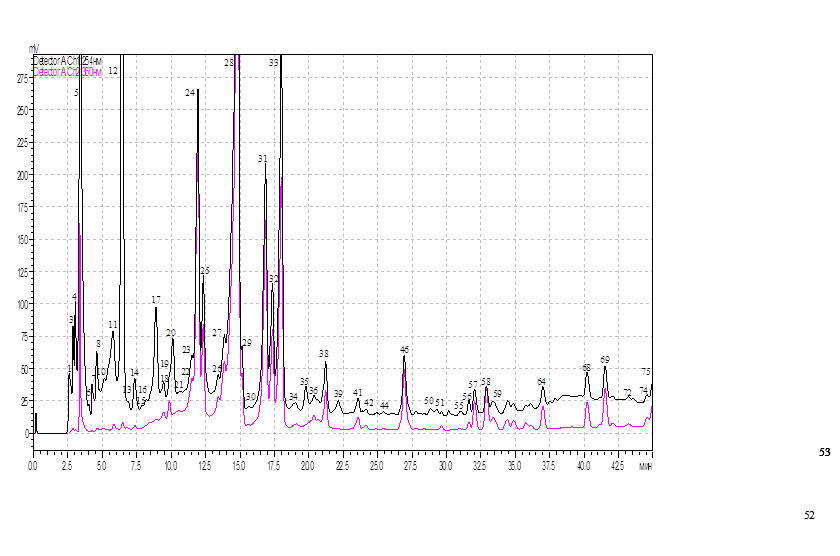 Рис. 1. ВЭЖХ фенольных соединений из листьев березы повислой в затухших очагах непарного шелкопряда
Рис. 1. ВЭЖХ фенольных соединений из листьев березы повислой в затухших очагах непарного шелкопряда
Из общего количества фракций нами идентифицировано 18 фенольных соединений. Список идентифицированных нами фенольных соединений в листьях березы представлен в таблице. По химическому составу это были флавоноиды, фенолгликозиды, фенолкарбоновые и гидроксикоричные кислоты.
Нами был проведен как тотальный сравнительный количественный попарный анализ основных, выявленных при хроматографии пиков, так и сравнительный анализ идентифицированных нами фенольных соединений (таблица, рис. 2).
Сравнительный анализ содержания идентифицированных фенольных соединений в листьях березы повислой в очагах непарного шелкопряда и за их границами
|
Очаг, пос. Покровское |
За границами очагов, пос. Храмцовское |
|||||
|
Наименование соединения |
ВУ |
Абсорбция (Mv) |
Υ360/ Υ254 |
ВУ |
Абсорбция (Mv) |
Υ360/ Υ254 |
|
Аскорбиновая к-та |
2,63 |
46,078±5,28 |
0,03 |
2,62 |
58,559±6,11 |
0,015 |
|
Арбутин |
2,83 |
81,23±9,37 |
0,054 |
2,83 |
102,252±12,38 |
0,085 |
|
Галловая к-та |
3,05 |
100,28±14,71 |
0,028 |
3,12 |
246,85±22,52 |
0,0091 |
|
Кафтаровая к-та |
4,0 |
16,526±2,012 |
0,044 |
3,92 |
14,685±1,36 |
0,098 |
|
Салицин |
4,8 |
24,705±2,85 |
0,034 |
4,71 |
49,009±5,47 |
0,051 |
|
Салидрозид |
6,43 |
345,098±41,18 |
0,016 |
6,32 |
259,909±29,89 |
0,014 |
|
4-кофеоилхинная к-та |
6,81 |
8,627±0,97 |
0,195 |
6,81 |
5,405±0,62 |
0,258 |
|
Рутин |
9,5 |
17,087±2,26 |
0,36 |
9,4 |
17,57±1,19 |
0,361 |
|
5-кофеоилхинная к-та |
9,82 |
23,92±2,51 |
0,546 |
9,82 |
29,0±3,14 |
0,540 |
|
Гиперозид |
11,5 |
33,52±3,82 |
0,70 |
11,55 |
29,819±3,35 |
0,504 |
|
Изокверцетин |
11,91 |
237,43±27,18 |
0,948 |
11,83 |
128,83±13,18 |
0,879 |
|
Феруловая к-та |
10.75 |
7,762±0,84 |
0.292 |
10.82 |
6.396±0,71 |
0.226 |
|
Изокверцитрин |
12,35 |
91,899±10,14 |
0,784 |
12,28 |
95,495±10,14 |
0,651 |
|
Мирицетин |
16,78 |
188,83±21,4 |
0,843 |
16,68 |
226,576±25,16 |
0,835 |
|
Лютеолин |
23,6 |
12,01±1,51 |
0,814 |
23,61 |
5,586±069 |
0,795 |
|
Кверцетин |
26,96 |
46,145±5,23 |
1,01 |
26,98 |
86,126±9,35 |
0,992 |
|
Апигенин |
28,43 |
1,732±2,02 |
0,645 |
27,75 |
2,252±0,29 |
0,796 |
|
Кемпферол |
29,7 |
3,408±0,41 |
1,139 |
29,68 |
4,594±0,52 |
1,275 |
Как показали результаты сравнительного анализа образцов листьев из очагов и контрольных древостоев (за границами очагов), они значительно отличались между собой (рис. 2). Так, за границами очагов у 37,3 % хроматографических пиков содержание фенольных соединений заметно возрастало, по сравнению с образцами из затухших очагов, у 56 % пиков содержание снижалось, у 5,97 % – не изменялось (рис. 2).
Сравнительный попарный анализ идентифицированных фенольных соединений продемонстрировал другие результаты. Так, за границами очагов у 52,94 % хроматографических пиков содержание фенольных соединений заметно возрастало, по сравнению с образцами из затухших очагов, у 35,29 % пиков содержание снижалось, у 11,76 % – не изменялось (рис. 2, таблица). Особенно большой интерес среди группы идентифицированных соединений представляют фенолгликозиды, так как известно, что они обладают антифидантными свойствами [6; 10].
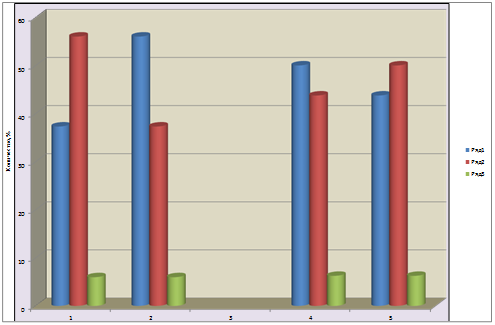
Рис. 2. Соотношение фенольных соединений при тотальном попарном анализе пиков хроматограмм из листьев березы (1,2) за границами очагов (1,4), в затухших очагах (2,5) и идентифицированных фенольных соединений (4,5)
По вертикали: изменение содержания фенольных соединений в пробе (в %). Слева направо: 1 – возрастание, 2 – снижение, 3 – отсутствие изменений.
Сравнительный анализ содержания фенолгликозидов в листьях березы из затухших очагов и за их границами показал, что содержание арбутина в пробах, взятых вне очагов, возрастало на 25,88 %, салицина на 98,38 %, содержание салидрозида, наоборот, снижалось на 24,68 %, лютеолина – на 53,49 % (рис. 2).
Для более точного сравнительного анализа основных тенденций изменения содержания фенольных соединений в листьях березы в затухших очагах и за их границами нами во всех пробах были исключены минорные фракции. Как показали результаты, у 36,1 % фенольных соединений их содержание заметно возрастало, у 50 % – снижалось, у 13,88 % не изменялось.
Следовательно, основной тенденцией у мажорных фракций фенольных соединений за границами очагов было снижение содержания, хотя и количество соединений с заметным возрастанием концентрации также было высоким.
Сравнительный анализ содержания фенольных соединений с данными предыдущего исследования, пробы для которого были взяты позже, показал, что по абсолютному содержанию пробы, взятые позже (в июле-августе), содержали более высокое количество идентичных соединений. Это, в целом, совпадает с результатами ряда других исследований, показавших, что к концу сезона вегетации содержание ряда соединений в листьях возрастает к концу сезона вегетации [8].
В целом, как показали результаты исследований при сравнительном анализе как тотальных фракций фенольных соединений в листьях березы, так и идентифицированных, наблюдаются разнонаправленные процессы: как снижение содержания фенольных соединений в листьях березы за границами очагов, так и их возрастание. При этом у многих фенольных соединений уровень этих изменений очень значителен (рис. 2, таблица). Доминирующей тенденцией при тотальном анализе фракций было снижение содержания фенольных соединений. Обращает внимание, что основная тенденция сохраняется и при элиминации из выборки минорных фракций, хотя количественно она снижается. Анализ идентифицированных фенольных соединений демонстрирует другую картину соотношений фракций – доминирование соединений, содержание которых возрастает в образцах, взятых за границами очагов. В предыдущем исследовании наблюдалась другая тенденция – незначительное преобладание количества фенольных соединений, содержание которых возрастало за границами очагов [4]. Эти различия могут объясняться как разным временем взятия проб, так и различными климатическими условиями в разные годы. Сравнительный анализ климатических условий весной и летом 2014 г. [4] и 2016 г. убедительно показал, что в мае 2014 г. наблюдалась умеренная засуха (ГТК=0,415), июне и июле, наоборот, ГТК было заметно выше нормы (1,54 и 1,88). В 2016 г. в мае отмечалась интенсивная засуха (ГТК=0,159), в июне ГТК была в норме (1,17), июле – умеренная засуха (ГТК=0,497). Мы предполагаем, что столь разнонаправленные тенденции обусловлены тем, что одновременно наблюдаются два биохимических процесса: Это реакция на фактор абиотического стресса (сильную майскую засуху) и активизация антиоксидантных процессов в листьях, которая всегда наблюдается при воздействии сильной засухи. Как установлено нами ранее, более интенсивная реакция на фактор абиотического стресса (сильную майскую засуху) наблюдается в березняках в затухших очагах [4]. Она проявляется в ингибировании синтеза фенольных соединений. Вторая реакция (активизации процессов антиоксидантной защиты) сопровождается возрастанием интенсивности синтеза фенольных соединений, так как известно, что многие флавоноиды являются мощными антиоксидантами [8]. Для проверки этого предположения мы провели сравнительный анализ соотношения идентифицированных нами фенольных соединений, обладающих по данным литературы антиоксидантной активностью в затухших очагах и за их границами. Как показали результаты, в контрольных насаждениях заметное возрастание антиоксидантной активности наблюдалось у 60 % фенольных соединений, снижение – у 33,3 %, отсутствие изменений – у 6,67 % (таблица). Соответственно, в затухших очагах возрастание содержания фенольных соединений с антиоксидантной активностью выявлено лишь у 33,3 % фракций. Таким образом, в низкорезистентных насаждениях доминировало ингибирование синтеза фенольных соединений, тогда как в высокорезистентных – антиоксидантная реакция. Тем не менее, в целом, доминирование в составе фенольных соединений у образцов, взятых за границами очагов, у которых содержание заметно возрастает (у идентифицированных соединений), а также заметное возрастание активности синтеза таких фенолгликозидов, как арбутин и салицин, детерминирующих уровень энтоморезистентности в листьях, свидетельствует о том, что в древостоях за границами очагов, где постоянно отсутствует дефолиация, и в период депрессии численности насекомых наблюдается более высокий постоянный уровень конститутивной резистентности.
Библиографическая ссылка
Колтунов Е.В., Яковлева М.И. СОСТАВ ФЕНОЛЬНЫХ СОЕДИНЕНИЙ ЛИСТЬЕВ БЕРЕЗЫ ПОВИСЛОЙ (BETULA PENDULA ROTH.) В ОЧАГАХ МАССОВОГО РАЗМНОЖЕНИЯ НЕПАРНОГО ШЕЛКОПРЯДА (LYMANTRIA DISPAR L.) И ЗА ИХ ГРАНИЦАМИ // Современные проблемы науки и образования. 2016. № 5. ;URL: https://science-education.ru/ru/article/view?id=25157 (дата обращения: 14.02.2026).



