Актуальность. До сегодняшнего времени сохраняются споры по вопросам этиопатогенеза герпетических инфекций и соотношения данного класса вирусных агентов к супрессии иммунной системы. В данном контексте необходимо дать несколько пояснений в отношении особенностей патогенеза инфекций семейства герпес. Цитируем Ю.В. Лобзина с соавторами [5]: «практически пожизненное сохранение герпесвирусов в организме человека объясняется способностью вирусной ДНК <…> изменять фенотипические свойства клеток хозяина – трансформация клеток. В результате трансформации запускаются иммунопатологические реакции, направленные против организма человека и проявляющиеся вирусиндуцированной иммуносупрессией».
Вторым понятием, требующим разъяснения, является понятие вирусиндуцированной иммуносупрессии. Представление о том, что инфекция – процесс, полностью зависимый от микроорганизма, доминирует в сознании врачей. Те же важнейшие нарушения в системе иммунитета организма, которые предшествуют ей, т.е. иммунодефициты, – игнорируются. Хотя индукция и интенсивность инфекционного процесса зависят от дозы, вирулентности, пути проникновения возбудителя, однако главным является степень недостаточности естественного или приобретенного иммунитета макроорганизма. Именно недостаточность иммунитета – относительный (к данному возбудителю) или абсолютный иммунодефицит – в каждой конкретной ситуации служит определяющим фактором развития инфекции. Инфекция, как фактор индукции, способствует реализации инфекционно-индуцированного иммунодефицита. Цитируя Д.К. Новикова [7; 8], необходимо говорить об иммунодефицитных болезнях (по МКБ-10) – болезнях иммунной системы как «врожденных (внутриутробных, антенатальных – примечание автора статьи), генетических или приобретенных структурных и/или недостаточностей какого-то звена в системе иммунитета, клинически проявляющихся рецидивами инфекции, вызванной вирусами, бактериями, грибами, паразитами». Из иммунодефицитных болезней вторичные иммунодефициты встречаются гораздо чаще первичных. Обычно вторичные иммунодефициты развиваются на фоне воздействия на организм неблагоприятных факторов окружающей среды или различных инфекций.
Продолжая цитировать «первоисточники», на которые достаточно часто опираются специалисты в области иммунологии и аллергологии, необходимо отметить, что приведенные определения касаются позднего постнатального периода. Так, в учебной литературе Р.М. Хаитова [10] под вторичным иммунодефицитом (ВИД) понимают такие нарушения иммунной системы, которые развиваются в позднем постнатальном периоде или у взрослых и, как принято считать, не являются результатом какого-то генетического дефекта. Среди ВИД условно можно выделить три формы: приобретенную, индуцированную и спонтанную.
К сожалению, именно данные определения ВИД применяются во всех возрастных группах, в том числе у детей. Достаточно своеобразно трактуются и формы ВИД, особенно спонтанная – «беспричинная». Такая трактовка уводит врача-клинициста от диагностического поиска, необходимости найти причину заболевания. Вновь обращаясь к работам Р.М. Хаитова [9; 10], необходимо отметить, что автор достаточно четко дает определение индуцированным ВИД - «это такие состояния, возникновение которых связано с какой-то конкретной причиной: рентгеновское облучение, кортикостероиды, цитостатики, травмы и хирургические операции, а также нарушения иммунитета, развивающиеся вторично по отношению к основному заболеванию (диабет, заболевания почек и печени, злокачественные процессы и т.д.). Вероятно, не полностью расшифрованный перечень причин («и т.д.») не позволяет определенной категории врачей соотнести с этим «т.д.» и инфекции! Также не рекомендуется применять неопределенные понятия, такие как «иммунодефицитное состояние», «иммунологическая недостаточность», так как их нельзя диагностировать или лечить как болезнь.
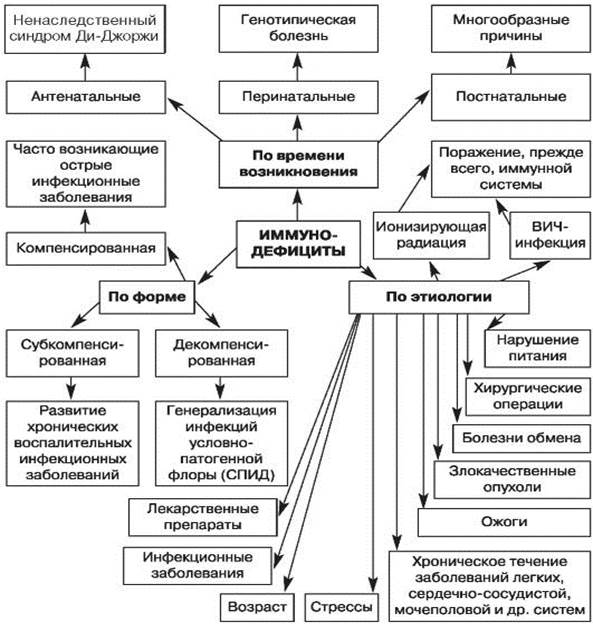
Рис. 1. Классификация вторичных иммунодефицитов по времени возникновения, этиологии, форме (по Белозерову Е.С. и др., 1992) [3]
Подводя итог в теоретической составляющей статьи – актуальности, необходимо обобщить следующее.
В педиатрии (17 лет 11 месяцев и 29 дней) в доминирующем большинстве речь идет об антенатальных и перинатальных иммунодефицитных болезнях, вторичных по отношению к анатомо-морфологическому субстрату иммунной системы – функциональных.
Таким образом, заключение врача-иммунолога должно быть сформулировано следующим образом. Антенатальная (или функциональная) иммунодефицитная болезнь, смешанного типа (или, при возможности, по отдельным звеньям, что мало вероятно), комбинированная индукция (инфекционная, гипоксическая и т.д.) с клиническими проявлениями основных синдромов – инфекционного, аллергического, аутоиммунного, неопластического и/или лимфопролиферативного.
Данные теоретические изыскания легли в основу целого цикла научно-исследовательских работ. Одно из таких исследований представлено в данной статье и посвящено исследованию иммуноиндуцирующей роли герпеса 4 типа - вируса Эпштейна-Барр у детей.
Цель: изучение особенностей клинических проявлений у детей с герпес-индуцированными формами иммунодефицитов (на примере 4 типа герпеса).
Материалы и методы. Клинико-иммунологические исследования были проведены у 320 детей в возрастном диапазоне от 9 месяцев до 17 лет. В группу исследования были также включены дети, имеющие инвалидизирующие виды патологии (детский церебральный паралич), с высоким инфекционным индексом не менее 6 раз в месяц, с неопластическими процессами, «пограничными» состояниями (лейкемоидные реакции, лимфоаденопатии). Клиническая оценка состояния здоровья детей осуществлялась в виде комплексного осмотра педиатра (номенклатура медицинских услуг). Также исследования включали в себя общелабораторные исследования - общий анализ крови, иммунологический профиль 2 уровня (реакция непрямой иммунофлюоресценции, ИФА крови), этиологические исследования (метод ИФА специфических иммуноглобулинов, ПЦР-исследования биологических субстратов – содержимое слизистых оболочек носа, зева, мочи).
Результаты собственных исследований и обсуждения. Небольшая историческая справка: двойную «фамилию» вирус получил в честь канадских ученых Мишеля Эпштейна и Эвелин Барр, так как именно им в 1964 году впервые удалось выделить его из клеток злокачественной лимфомы. Этот вирус отнесли к вирусам герпеса четвертого типа. Он имеет сложное строение и содержит ДНК. Хорошо переносит низкие температуры (до минус 70 °С) и высушивание, но быстро погибает под воздействием температуры выше 60 °С, ультрафиолетового облучения и дезинфицирующих средств. Передается вирус воздушно-капельным путем, преимущественно со слюной инфицированного человека. Возможны также гемотрансфузионный и половой пути передачи [2; 4]. Описаны случаи вертикальной передачи ВЭБ от матери плоду. Распространен вирус Эпштейна–Барр (ВЭБ) повсеместно. По статистике, в развивающихся странах и социально неблагополучных семьях большинство детей заражаются им к трем годам, а все население – к 16–18. В развитых странах такое распространение инфекции наступает чуть позже. Вирусом Эпштейна–Барр инфицировано от 80 до 100% взрослого населения любой страны. Наиболее известное и хорошо изученное заболевание, причиной которого является вирус Эпштейна–Барр – это инфекционный мононуклеоз. Ученые полагают, что этот вирус может быть причиной развития внутриутробных аномалий плода. Наряду с возбудителями токсоплазмоза, краснухи, цитомегаловирусной и герпес-инфекции первого и второго типов он входит в группу так называемых ТОRCH-инфекций. Установлено, что ВЭБ причастен к развитию аутоиммунных заболеваний, рассеянного склероза, некоторых форм гепатита, опухолей желудка, селезенки, вилочковой железы, синдрома хронической усталости и иммунной депрессии. Кроме того, он является причиной злокачественных заболеваний – лимфомы Беркитта, назофарингеальной карциномы и саркомы Капоши. Реактивация ЭБВИ (Эпштейна-Барр вирусная инфекция) и хроническое течение данной инфекции нередко развивается у пациентов со сниженной активностью иммунной системы. Наиболее характерные признаки хронической ЭБВИ – длительная субфебрильная температура тела (дольше 6 месяцев), слабость, потливость, боли в мышцах и суставах, затрудненное носовое дыхание, головокружение, нарушение сна, снижение памяти, внимания и интеллекта, эмоциональная лабильность. Как правило, эти симптомы сопровождаются увеличением лимфатических узлов, печени и селезенки. Возможно развитие пневмонии, угнетения активности костного мозга, гепатита. Исходами острой ЭБВИ, по данным И.К. Малашенкова и соавторов (2002) [6], являются выздоровление, латентная инфекция и хроническая рецидивирующая ЭБВИ. Исследованиями отечественных и зарубежных авторов установлено, что клиника хронической ЭБВИ у взрослых характеризуется наличием длительных симптомов интоксикации, лимфаденопатии, гепатоспленомегалии, тонзиллита, аденоидита, у части больных ? интерстициальной пневмонии, увеита, гепатита, патологии ЦНС и др. [2; 4; 5]. Что касается детей, то имеются лишь отдельные работы, посвященные описанию немногочисленных групп больных с хронической ЭБВИ. Кроме того, несмотря на многообразие методов лабораторной диагностики ЭБВИ (серологические методы, молекулярная гибридизация, полимеразная цепная реакция), до настоящего времени нет единства во взглядах ученых на информативность применяемых методик для определения формы и стадии инфекционного процесса.
Все дети (100%) относились к часто и длительно болеющим, при этом 72 ребенка были неорганизованными (22,5%). У 78 (24,4%) детей были зарегистрированы признаки рецидивирующей герпетической инфекции с локализацией на губах, крыльях носа, слизистой оболочке полости рта. Ежегодно 92 ребенка (28,4%) переносили бактериальные инфекции в виде тонзиллитов, пневмоний, пиелонефритов, фурункулезов, гнойных конъюнктивитов, отитов, рино-синуситов. Признаки лимфоаденопатии (микролимфоаденопатии) регистрировались у 270 детей (84,4%). У 2 детей были диагностированы неопластические процессы (один ребенок умер в 2009 году). Одна девочка с лейкемоидной реакцией наблюдается у гематоонколога в течение 2 лет. Субфебрильные реакции более 12 месяцев были зарегистрированы у 39 детей (12,2%). Грубые неврологические нарушения (преимущественно двигательные) были зафиксированы у 43 детей (13,4%) (рис. 2).
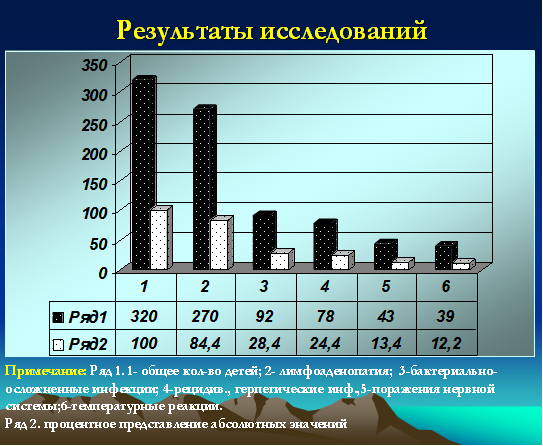
Рис. 2. Частота распределения клинических проявлений у детей с герпесиндуцированными иммунодефицитами
Иммунологические данные (в т.ч. данные лейкограммы), кроме количества лейкоцитов и лимфоцитов (абсолютное и относительное количество), носили неоднозначный характер. Классический супрессорный тип (в т.ч. и со снижением клеток цитолитической направленности) выявлялся у 108 детей (33,7%). Активация в системе клеток естественной цитотоксичности (CD16+) зафиксирована у 52 детей (16,2%). Увеличение В-клеточного пула было зарегистрировано у 38 детей (11,8%). Интересными, на наш взгляд, были полученные данные по CD95 маркеру, у 92 (28,7%) детей данный показатель был резко повышен и достигал значений 20-25%, у 30 (9,3%) детей указанный показатель не превышал 3% (рис. 3).
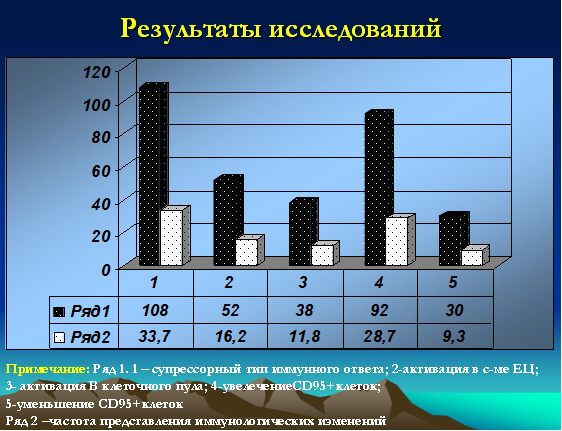
Рис. 3. Иммунологические особенности (типы распределения) у детей с герпесиндуцированными иммунодефицитами
ИФА, проведенный у детей, выявил 100% контаминацию вирусом ЭБ. Определялась следующая совокупность специфических антител:
- IgM к VCA (к капсидному антигену) – выявляются в крови в первые дни и недели болезни, максимально сохраняются до 3-4 недель;
- IgG к VCA (к капсидному антигену) – появляются в крови спустя 1-2 месяца от начала болезни, затем постепенно снижаются и сохраняются на пороговом (низком уровне) пожизненно. Повышение их титра характерно для обострения хронической ЭБВИ;
- IgM к EA (к раннему антигену) – появляются в крови в первую неделю заболевания, сохраняются в течение 2-3 месяцев и исчезают. Могут сохраняться в высоких титрах длительное время (более 3-4 месяцев), тревожно в плане формирования хронической формы ЭБВИ. Появление их при хронической инфекции служит индикатором реактивации;
- IgG к ЕA (к раннему антигену) – появляются к 3-4-й неделе заболевания, становятся максимальными на 4-6-й неделе болезни, исчезают через 3-6 месяцев. Появление высоких титров повторно указывает на активацию хронической инфекции;
- IgG к NA-1 или EBNA (к нуклеарному или ядерному антигену) – являются поздними, поскольку появляются в крови через 1-3 месяца после начала заболевания. При этом острофазные антитела выявлялись (IgM к VCA и IgM к EA) у 42 детей (13,1%), у 268 (83,7%) детей титры антител (IgG VCA + IgG к NA-1 или EBNA) значительно превышали нормативные и достигали значений более 160, у 10 (3,1%) детей диагностически значимых титров выявлено не было [9; 13] (рис. 4).
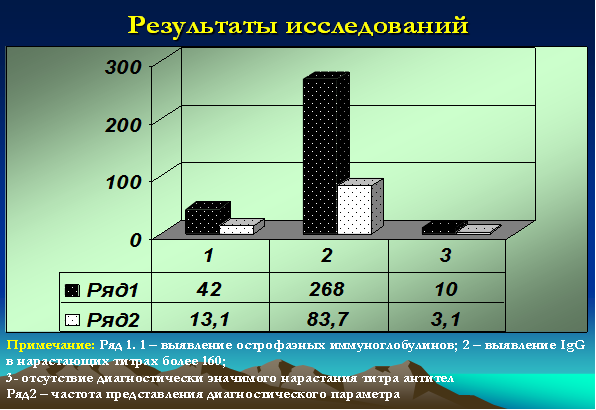
Рис. 4. Серологические исследования у детей с герпесиндуцированными иммунодефицитными болезнями
Клинические, иммунологические и этиологические сопоставления выявили следующие закономерности.
У детей с грубой неврологической симптоматикой диагностировались иммуносупрессорные изменения с резким увеличением титра антител к вирусу ЭБ. Дети, часто и длительно болеющие, имели разнонаправленные изменения: от иммуносупрессорных до активационных в системы гуморального звена, цитотоксической защиты (В-лимфоциты, иммуноглобулины класса «G», CD16+ и CD25+ клетки), уровень CD95+ клеток был преимущественно снижен.
Отдельно хочется остановиться на методах ПЦР-диагностики. В литературе активно обсуждается вопрос об использовании ПЦР для исследований на инфекции семейства герпес в различных биологических субстратах. Здесь необходимо понимать, что данный метод, особенно при использовании его для исследования плазмы, имеет свои особенности – он всегда количественный! Определение качественное не имеет смысла, так как инфекция пожизненно персистирует в организме человека. Как у больных ЭБВИ, так и у носителей может быть положительная ПЦР. Поэтому для их дифференцировки проводится ПЦР-анализ с заданной чувствительностью: для носителей до 10 копий в пробе, а для активной инфекции – 100 копий в пробе. Специфичность данного метода хоть и достигает 100%, при этом не исключает ложноположительные результаты, т.к. ПЦР-анализ информативен только при размножении (репликации) вируса, то существует и определенный процент ложноотрицательных результатов с отсутствием репликации в момент исследования [5; 9].
В результате проведенного нами исследования, ПЦР крови всегда имела отрицательный результат, даже у детей с неопластическими процессами. Распределение ПЦР-положительных результатов у детей со слизистых оболочек (ротоглотка, нос) и мочи имело следующее цифровое распределение.
Положительные реакции с 3 биологических объектов имели 36 детей (11,25%), у 62 положительные ПЦР реакции были с зева и носа – 19,38%, у 43 детей диагностировали положительный результат только с зева (13.44%), и 71 ребенок имели положительные значения ПЦР со слизистой оболочки носа (22,19%). Положительные значения только в моче имели 51 ребенок (15,94%). Остальные дети (в количестве 57) имели отрицательный результат ПЦР-исследований с биологических сред.
Дети с неопластическими процессами, длительным субфебрилитетом, лейкемоидной реакцией, лимфоаденопатией имели признаки активации хронической инфекции, резкое увеличение CD95+ клеток, положительные маркеры наличия и обострения ВЭБ в ИФА и ПЦР-исследованиях.
Таким образом, все дети имели индуцированные формы функциональной иммунодефицитной болезни, доминирующей причиной которой являлся вирус ЭБ. Проведенные предварительные клинико-иммунологические исследования наглядно демонстрируют необходимость комплексного обследования детей с функциональными нарушениями в системе иммуногенеза с обязательной оценкой уровня инфекционной (вирусной) контаминации. Выявление основных причин трактуется необходимостью применения комплексных методов лечения, в т.ч. и с применением противовирусных препаратов.
Библиографическая ссылка
Левкова Е.А., Савин С.З. ГЕРПЕС-ИНДУЦИРОВАННЫЕ ИММУНОДЕФИЦИТНЫЕ БОЛЕЗНИ У ДЕТЕЙ (НА ПРИМЕРЕ 4 ТИПА ГЕРПЕСА) // Современные проблемы науки и образования. 2016. № 5. ;URL: https://science-education.ru/ru/article/view?id=25135 (дата обращения: 11.02.2026).



