Пентоксифиллин является вазодилатирующим, ангиопротекторным, антиагрегатным, антитромбическим средством [3; 5; 8; 9].
Применение пентоксифиллина требует продолжительного курса лечения для достижения положительных результатов, а при нарушении приема лекарственного препарата уменьшается его терапевтический эффект. Выходом является разработка новых более эффективных пролонгированных лекарственных форм препарата [3; 5; 8; 9].
Лекарственные средства пролонгированного действия могут быть получены методом инкапсулирования на основе полимерных носителей с контролируемым высвобождением активных субстанций.
При разработке технологии получения микрочастиц пролонгированного действия очень важно подобрать полимер с оптимальными параметрами.
Основными требованиями, предъявляемыми к полимерам, которые используются для получения пролонгированных лекарственных форм, являются: способность хорошо растворяться в органических растворителях, смешивающихся с водой, биодеградируемость полимеров, биосовместимость полимеров с лекарственными веществами [7].
С учетом вышеперечисленных физико-химических свойств пентоксифиллина был выбран в качестве полимерного носителя сополимер молочной и гликолевой кислот (PLGA) [2; 4].
При получении микрочастиц пролонгированного действия на основе биодеградируемых полимеров могут возникнуть явления агрегации, которые влияют на степень включения лекарственного вещества в полимерную матрицу. Поэтому для уменьшения агрегации микрочастиц используют поверхностно-активные вещества (ПАВ). Наиболее часто применяемыми при получении микро- и наночастиц являются поливиниловый спирт (ПВС) и твин-80 [4].
Микрочастицы пентоксифиллина на основе поли-DL-лактид-ко-гликолида получали методом соосаждения [4]. Точные навески пентоксифиллина и поли-DL-лактид-ко-гликолида растворяли в небольшом объеме хлороформа, затем по каплям вводили полученный раствор в водный раствор ПАВ (ПВС или Твин – 80) при постоянном перемешивании с помощью гомогенизатора Ultra-Turrax T-18 (IKA, ФРГ). Получение микрочастиц пентоксифиллина проводилось при комнатной температуре (20 °С). Полученную эмульсию взбалтывали в течение 10-24 часов до полного удаления хлороформа [4].
Полученные микрочастицы отделяли центрифугированием при скорости вращения 6000 об/мин в течение 10 мин, микрочастицы промывали водой очищенной и повторно центрифугировали (4 раза). Оценку полученных микрочастиц пентоксифиллина проводили по степени включения пентоксифиллина в полимерную матрицу.
Степень включения (СВ) пентоксифиллина в микрочастицы рассчитывали по формуле:
СВ%![]()
![]()
где С общ – содержание пентоксифиллина в готовом образце микрочастиц;
Ссвободн – концентрация свободного (не связанного с микрочастицами) пентоксифиллина [1; 4].
Степень включения пентоксифиллина в микрочастицы определяли методом спектрофотометрии. Вначале определяли содержание свободного пентоксифиллина, а затем связанного (включенного в микрочастицы).
Полученную суспензию помещали в мерную колбу на 25 мл, доводили до метки фосфатным буферным раствором с рН 6,8, затем 1 мл раствора помещали в мерную колбу на 50 мл, доводили тем же растворителем. Измеряли спектр поглощения на спектрофотометре в кварцевых кюветах с толщиной слоя 10 мм при длине волны 274 нм. В качестве раствора сравнения использовали фосфатный буферный раствор с рН 6,8 (рис. 1) [6].
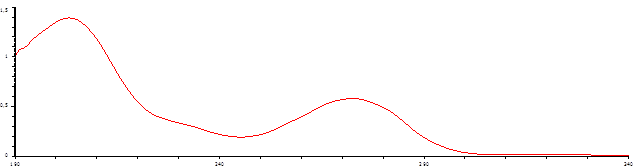
Рис. 1. УФ-спектр 0.001633%-ного раствора пентоксифиллина в фосфатном буферном растворе (рН 6.8)
По итогам эксперимента был получен следующий результат: степень включения пентоксифиллина в микрокапсулы на ПВС 3% больше и составляет – 86,5%, в отличие от Твин–80 - 80,48%. Следовательно, в дальнейшей работе в качестве ПАВ будет использоваться ПВС (рис. 2).
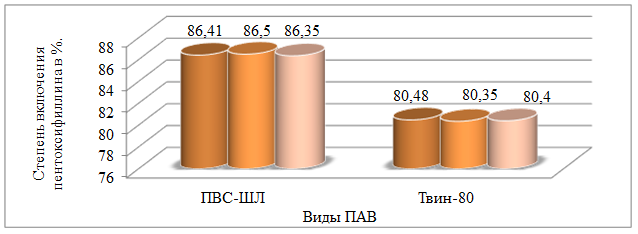
Рис. 2. Зависимость степени включения пентоксифиллина от вида ПАВ
Известно, что при увеличении концентрации ПАВ происходит образование плотной гидрофильной оболочки на поверхности микрочастиц, что приводит к снижению степени включения лекарственного вещества в полимерную матрицу. При дальнейшем увеличении концентрации раствора ПАВ полученные микрочастицы приобретают асимметрическую форму и включение лекарственного препарата в него невозможно. Поэтому необходимо выбрать оптимальную концентрацию ПАВ для максимального включения пентоксифиллина в полимерную матрицу [1; 2].
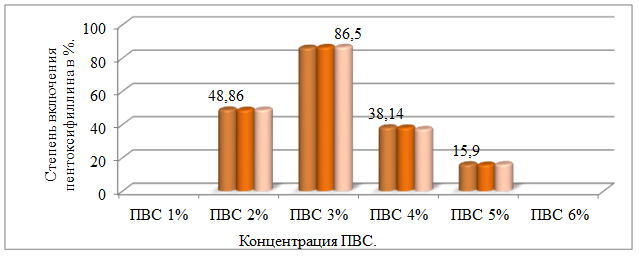
Для выбора оптимальной концентрации ПАВ были получены микрочастицы пентоксифиллина с использованием ПВС 1, 2, 3, 4, 5, 6%-ного растворов. Полученные микрочастицы пентоксифиллина оценивались по степени включения пентоксифиллина в полимерную матрицу (рис. 3).
Рис. 3. Зависимость степени включения пентоксифиллина от концентрации ПВС
Как видно из полученных данных, наибольшая степень включения пентоксифиллина в микрочастицы достигается при концентрации ПВС= 3%.
На следующем этапе исследований изучалась зависимость степени включения пентоксифиллина в микрочастицы от скорости гомогенизации. При получении микрочастиц пролонгированного действия на основе биодеградируемых полимеров скорость гомогенизации оказывает существенное влияние на степень включения лекарственного вещества. Так, низкая скорость гомогенизации приводит к медленному испарению органического растворителя и увеличению времени образования активной поверхности полимера. Это значительно увеличивает размер микрочастиц и уменьшает степень включения лекарственного вещества. Увеличение интенсивности гомогенизации приводит к вспениванию [4].
Микрочастицы пентоксифиллина пролонгированного действия на основе ПЛГА получали с помощью гомогенизатора Ultra-Turrax T-18 с интервалом скоростей от 3600 до 24000 об/мин. Полученные микрочастицы пентоксифиллина оценивались по степени включения пентоксифиллина в полимерную матрицу (рис. 4).
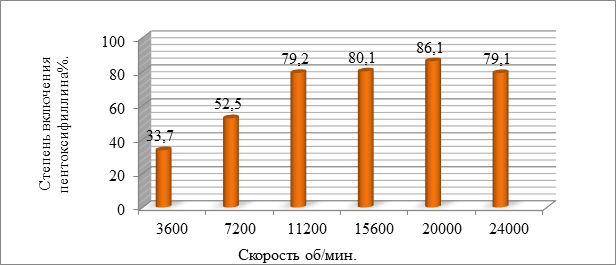
Рис. 4. Зависимость степени включения пентоксифиллина от скорости гомогенизации
Полученные экспериментальные данные позволили сделать вывод, что оптимальные показатели микрочастиц пентоксифиллина пролонгированного действия наблюдались при скорости гомогенизации 20000 об/мин. Уменьшение скорости гомогенизирования приводит к увеличению размеров микрочастиц и снижению степени включения пентоксифиллина в полученные микрочастицы.
Одним из условий, влияющих на степень включения лекарственного вещества в полимерную матрицу, является зависимость соотношения лекарственного вещества и полимера.
По данным литературы, увеличение количества полимера приводит к повышению вязкости раствора и увеличению размера частиц, что ведет к снижению устойчивости коллоидной системы. При этом снижается степень включения лекарственного вещества в микрочастицы, то есть получение микрочастиц таким способом проводить нецелесообразно [2].
Поэтому была проведена серия опытов по выбору соотношения пентоксифиллина к ПЛГА для включения пентоксифиллина в полимерную матрицу (рис. 5).
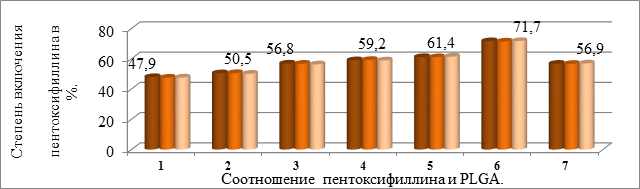
Рис. 5. Влияние соотношения пентоксифиллина и PLGA на степень включения в полимерную матрицу
Степень включения пентоксифиллина в микрочастицы определяли методом спектрофотометрии (1- 1:0,5; 2- 1:1; 3-1:1,5; 4- 1:2; 5-1:2,5; 6 – 1:3; 7-1:4).
Из приведенных данных следует, что максимальная степень включения пентоксифиллина наблюдается при соотношении пентоксифиллин : PLGA - 1:3.
Одним из немаловажных условий для максимального включения пентоксифиллина в микрочастицы пролонгированного действия является очередность введения основных компонентов. Поэтому были использованы 2 способа введения пентоксифиллина в ПЛГА в получаемый раствор.
1. Совместное растворение пентоксифиллина и ПЛГА в хлороформе с последующим введением в раствор ПАВ.
2. Раздельное растворение пентоксифиллина и ПЛГА в хлороформе и последовательное введение их в ПАВ (таблица 1).
Таблица 1
Влияние очередности введения пентоксифиллина и PLGA в полимерную матрицу
|
Способ введения |
Степень включения пентоксифиллина в полимерную матрицу, % |
|
Совместное растворение |
74 |
|
74,2 |
|
|
74,3 |
|
|
Раздельное растворение |
1,67 |
|
1,6 |
|
|
1,65 |
Как следует из полученных данных, очередность добавления пентоксифиллина и PLGA в раствор ПАВ оказывает значительное влияние на степень включения. Поэтому для получения микрочастиц был выбран первый способ совместного растворения пентоксифиллина и ПЛГА в хлороформе с последующим введением в раствор ПАВ.
Известно, что изменение температуры полимеризационной среды влечет за собой изменение показателя растворимости полимера, который не должен превышать оптимум, так как PLGA проявляет высокую чувствительность к температурным изменениям (таблица 2).
Таблица 2
Зависимость степени включения пентоксифиллина от температуры среды полимеризации
|
Температура, °С |
Степень включения пентоксифиллина в полимерную матрицу, % |
|
0 |
16,7 |
|
10 |
42,9 |
|
20 |
81,8 |
|
30 |
61,9 |
|
40 |
49,7 |
Из полученных данных следует, что оптимальной температурой полимеризационной среды является 20 °С.
Таким образом, подобраны оптимальные условия получения пролонгированной лекарственной формы пентоксифиллина на основе поли-DL-лактид-ко-гликолида, а именно в качестве ПАВ наиболее эффективно использовать ПВС в концентрации 3%, при скорости гомогенизации 20000 об/мин, при соотношении пентоксифиллин : PLGA – 1:3, способом совместного растворения пентоксифиллина и ПЛГА в хлороформе с последующим введением в раствор ПАВ, при температуре 20 °С, в этих условиях происходит максимальное включение пентоксифиллина в полимерную матрицу микрочастиц.
Библиографическая ссылка
Тимченко Т.В., Щербакова Л.И., Компанцев В.А., Маркова О.М. ИЗУЧЕНИЕ ОСНОВНЫХ ФАКТОРОВ, ВЛИЯЮЩИХ НА СТЕПЕНЬ ВКЛЮЧЕНИЯ ПЕНТОКСИФИЛЛИНА В ПОЛИМЕРНУЮ МАТРИЦУ ПОЛИ-DL-ЛАКТИД-КО-ГЛИКОЛИДА С ЦЕЛЬЮ РАЗРАБОТКИ ПРОЛОНГИРОВАННОЙ ЛЕКАРСТВЕННОЙ ФОРМЫ // Современные проблемы науки и образования. 2016. № 4. ;URL: https://science-education.ru/ru/article/view?id=24996 (дата обращения: 16.02.2026).



