В настоящее время замораживание эмбрионов считают незаменимой технологией в большинстве лабораторий вспомогательных репродуктивных технологий (ВРТ) [3, 5, 9]. Важность криоконсервации была подтверждена комиссией по этическим нормам ASRM. Эффективная программа криоконсервации может снизить вероятность развития осложнений при стимуляции яичников, профилактики многоплодной беременности, вероятность отрицательного результата в случае переноса эмбрионов при повышении прогестерона, отсутствии роста эндометрия, а также предотвратить утрату эмбриона [4, 10].
Для успешной криоконсервации необходимы криопротекторы – химические вещества, которые при добавлении в криоконсервирующую среду защищают клетки от повреждений во время охлаждения, хранения или размораживания. Криопротекторы бывают двух категорий: проникающие и непроникающие (исходя из способности проникать в клеточную мембрану). Проникающие криопротекторы традиционно обладают низкой молекулярной массой, которая понижает температуру замерзания; в их числе глицерол, этиленгликоль, пропиленгликоль и диметилсульфоксид. Непроникающие криопротекторы используют при осмотическом сжатии клеток перед заморозкой, они контролируют регидратацию при размораживании. Таким образом, непроникающие криопротекторы (обычно моносахариды или дисахариды) очень важны для смягчения потенциально вредного воздействия «осмотического шока» при замораживании и размораживании. Сахароза служит самым распространенным непроникающим криопротектором.
Повреждения в процессе криоконсервации могут возникнуть в результате воздействия таких криофакторов, как например, длительного воздействия токсичных криопротекторов, образования кристаллов льда или осмотического шока при заморозке. На данный момент существует две основные категории стратегий криоконсервации гамет/эмбрионов: медленная заморозка и витрификация. Медленная заморозка осуществляется при помощи специального оборудования – программного замораживателя. Многочисленные протоколы различаются применением проникающих и непроникающих криопротекторов, а также скоростью заморозки и разморозки. По этим причинам зачастую сложно обобщить или сравнить результаты криоконсервации. Ниже приведен универсальный пример протокола медленной криоконсервации эмбриона в стадии дробления. Перед криоконсервацией эмбрионы подвергают специфичному для данной программы критерию отбора. После промывания эмбрионов в обрабатывающей среде с добавлением протеина 12–15 мг/мл их погружают в ту же самую среду, содержащую 1,5 моль/л пропиленгликоля (пропандиола), а затем в раствор с содержанием 1,5 моль/л пропиленгликоля и 0,1 моль/л сахарозы. Эмбрионы погружают в пластиковые пробирки или пузырьки и помещают в программируемую криогенную камеру, где они охлаждаются на 2 °С в минуту, начиная с комнатной температуры, до 4 или 6 °С. Через 5 мин термовоздействия охлажденный объект прижимают к стенке контейнера, чтобы индуцировать «сидинг». На этом уровне контейнеры погружают в жидкий азот для хранения. Размораживание происходит при хранении контейнера сначала при комнатной температуре, затем при 37 °С. Эмбрионы извлекают из контейнеров и погружают в размораживающие растворы. Первый раствор обычно содержит чуть большее количество непроникающего криопротектора. Он защищает клетки от «осмотического шока» и разрыва, а также удаляет проникающий криопротектор. Это достаточно длительная по времени процедура. В связи с чем в настоящее время наиболее популярны методы быстрой заморозки гамет и эмбрионов – витрификации.
Витрификация – форма быстрой заморозки, применяющая очень высокие концентрации криопротектора, в результате чего происходит отвердевание без формирования кристаллов льда. Кристаллы льда бывают главной причиной внутриклеточных повреждений в результате заморозки. Термин «витрификация» происходит от латинского слова «vitreous», что означает «стеклянный» или «напоминающий стекло». Витрификацию можно считать модифицированным подходом к криоконсервации, развившимся на основе криоконсервации зародышей млекопитающих. Таким образом, вещества для замораживания содержат нормальные молекулярные и ионные пропорции первоначального жидкого состояния и могут считаться чрезвычайно вязкими, сверхохлажденными жидкостями. При данном методе ооциты или эмбрионы обезвоживаются путем кратковременного воздействия концентрированного раствора криопротектора перед помещением образцов непосредственно в жидкий азот. Применение витрификации в настоящее время находится в центре внимания многих клинических лабораторий. Независимо от средств криоконсервации, гаметы или эмбрионы хранят в жидком азоте при температуре -196 С. При таком режиме реакции и процессы, происходящие внутри клеток, приостанавливаются. Таким образом, нельзя определить предел длительности хранения гамет и эмбрионов.
Материалы и методы
Исследование проведено в лаборатории ВРТ Медицинской компании ИДК, являющейся клинической базой кафедры репродуктивной медицины, клинической эмбриологии и генетики. В работе проведен анализ 1247 криоциклов, в которых было проведено замораживание (витрификация)/размораживание эмбрионов и их перенос в полость матки с последующей оценкой эффективности программы. Для проведения витрификация и размораживания использовали среды компании Irvine Scientific (USA) в соответствии со стандартным прокотолом проведения процедур в соответствии с рекомендациями производителя.
Для замораживания использовались эмбрионы отличного и хорошего качества 5-х суток развития in vitro [1, 6, 8]. Оценка качества эмбрионов проводилась в соответствии с классификацией бластоцист D. Gardner (1999) (рис. 1).
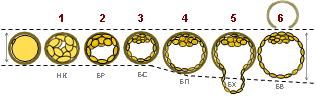
Рис. 1. Оценка бластоцист по D. Gardner (1999)
Примечание: НК – начало кавитации, БР – бластоциста ранняя, БС – бластоциста, БП – бластоциста полная, БХ – бластоциста с хетчингом, БВ – бластоциста вылупившаяся.
Витрификация эмбрионов и их размораживание (оттаивание) производились с рекомендациями завода-производителя Irvine Scientific (USA). Витрификация эмбриона(ов) осуществляется при комнатной температуре (+20–24°С). Замораживание и последующее хранение эмбрионов осуществлялось на носителях закрытого типа CryoTip (Irvine Scientific, USA).Эмбрион(ы) эквилибрировали в растворе Equilibration Solution (ES) в течении 6–10 минут (в зависимости от стадии развития эмбриона). При этом он свободно погружался на дно капли и начинал сжиматься, после чего постепенно возвращался к первоначальному размеру, по мере впитывания равновесного раствора ES, что свидетельствовало о завершении этапа эквилибрации. После завершения эквилибрации эмбрион(ы) аспирировали на кончик пипетки и с минимальным объемом среды ES и помещали на дно капли с раствором Vitrification Solution (VS). В этом растворе эмбрион имел тенденцию к всплытию. Эмбрион(ы) однократно промыли в растворе VS. Время экспозиции – 30 секунд, при этом отмечалось сморщивание эмбриона (ов) вследствие дегидратации. Перед набором эмбриона(ов) в носитель закрытого типа CryoTip его подписывали в соответствии с фамилией пациентки и номером карты, а также датой замораживания. Затем, под микроскопом и под контролем зрения, проводили забор эмбриона (ов) вместе с раствором VS и запаивали носитель при помощи ультразвукового запаивателя. После чего помещали CryoTip в жидкий азот. Общее время от момента помещения эмбриона(ов) в раствор VS и до момента погружения носителя в жидкий азот должно быть 90–110 секунд. Хранение замороженных эмбрионов проводили в сосудах Дьюара до момента размораживания.
Размораживание (оттаивание) эмбриона(ов) проводится при комнатной температуре (+20–24°С). Перед процедурой размораживания необходимо заранее (не менее, чем за 30 мин) достать из холодильника растворы для размораживания Thawing Solution (TS), Dilution Solution (DS), Washing Solution (WS) и довести растворы до комнатной температуры (+20–24°С). Во время процедуры выключить нагревательные поверхности, минимизировать воздействие света на эмбрион(ы) во время размораживания. Раскапать 5 мкл и 50 мкл среды TS для размораживания. Извлечь из сосуда Дьюара в изотубу с нужным носителем, погрузить в криованну, заполненную жидким азотом. Извлечь CryoTip из визотубы в жидком азоте, сверить информацию, написанную на рукоятке CryoTip. Сделать надписи над каплями на крышке чашки TS, DS,WS1 и WS2. Дважды осторожно перевернуть каждый флакон вверх дном для смешивания содержимого. Раскапать по 50 мкл раствора для дилюции DS и растворов для промывки WS1 и WS2 в чашку, накрыть крышкой.
CryoTip достать из жидкого азота и быстро погрузить в емкость с теплой дистиллированной водой (+37°С) в течение 30 сек, обрезать соломинку, в соответствии с метками, указанными на соломинке, и выдавить содержимое соломинки с помощью шприца в каплю с TS. Далее, в соответствии с рекомендациями производителя, последовательно перемещаем эмбрион(ы) из капли TS вDS на 4 мин, а затем дважды в капли с WS по 4 мин. После чего помещаем эмбрионы в заранее подготовленную проэквилиброванную среду на 3–4 часа до момента переноса.
Результаты исследования. Основными факторами успеха эмбриологического этапа программы являются: строгий отбор эмбрионов хорошего и отличного на замораживание, выполнение протокола замораживания эмбрионов, квалификация эмбриолога.
Для анализа эффективности программ ВРТ после применения витрифицированных эмбрионов оценивались следующие ключевые показатели: % размораживания, средний балл эмбрионов на перенос, частота наступления беременности (ЧНБ), частота имплантации (ЧИ), уровень многоплодной беременности (МП) [2, 7, 10].
В таблице представлены ключевые показатели качества криопрограммы лаборатории ВРТ Медицинской компании ИДК (2015).
Ключевые показатели качества криопрограммы лаборатории ВРТ
Медицинской компании ИДК, 2015 г.
|
Ключевые показатели |
Значение |
|
Количество циклов |
377 |
|
Количество размораживаний |
342 (90,7 %) |
|
% выживаемости (более 75 %) |
86 % |
|
Количество переносов |
330 |
|
Количество перенесенных эмбрионов |
457 |
|
Среднее количество эмбрионов на перенос |
1,4 |
|
Показатель ЧНБ |
43,9 % |
|
Показатель ЧИ |
35,5 % |
|
Показатель МП |
11 % |
Анализ ключевых показателей свидетельствует о том, что программа успешно работает, имея невысокий уровень многоплодной беременности при высоких показателях ЧНБ и ЧИ. Обращает на себя внимание тот факт, что количество перенесенных эмбрионов в криопрограмме составляет 1,4 эмбриона на перенос, т.е. более половины циклов осуществляется с переносом одного эмбриона. Показатели ЧНБ и ЧИ свидетельствуют о том, что качество эмбрионов при переносе является достаточно высоким, поскольку разница между ЧНБ и ЧИ менее 10 %. Этот факт еще раз подтверждает, что витрификация эмбрионов позволяет сохранить биологический потенциал к развитию эмбриона и привести к наступлению нормальной беременности.
За период с 2011 г. по 2015 г. в лаборатории ВРТ Медицинской компании ИДК показатели ЧНБ и ЧИ имеют постоянную тенденцию к нарастанию (рис. 2).
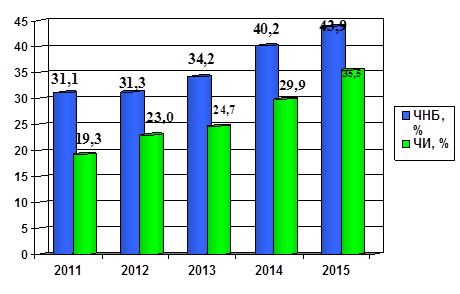
Рис. 2. Показатели ЧНБ и ЧИ в криопрограмме за период 2011–2015 гг.
Витрификация эмбрионов применяется не только в криопрограмме в случае неудачной предыдущей попытки экстракорпорального оплодотворения (ЭКО), но также и при ряде др. клинических ситуаций: повышении прогестерона в цикле стимуляции, отсутствии роста эндометрия в настоящем цикле, риске развития гиперстимуляции яичников. Эти состояния предполагают отсроченный перенос эмбрионов. В этих случаях эмбрионы отличного и хорошего качества замораживаются и переносятся в др. благоприятном для зачатия цикле.
Так, по данным нашей клиники, ЧНБ при отсроченном переносе при повышении уровня прогестерона составляет до 60 %, при развитии СГЯ – 80 % (доля сегментаций цикла по причине риска развития СГЯ от общего количества циклов – 4 %).
Выводы
Таким образом, процедура витрификации гамет и эмбрионов позволяет получить беременность после неудачной предыдущей попытки беременности после переноса в стимулированном цикле ВРТ, а также получить повторную беременность, имея на хранении замороженные эмбрионы. Витрификация эмбрионов позволяет отсрочить перенос и дает шанс на получение беременности при повышении прогестерона, отсутствии роста эндометрия, а также предупреждает развитие осложнений на проведение гормональной терапии в программах ВРТ.
Библиографическая ссылка
Шурыгина О.В., Тугушев М.Т., Байзарова А.А., Сараева Н.В. ВИТРИФИКАЦИЯ ГАМЕТ И ЭМБРИОНОВ - ЭФФЕКТИВНЫЙ ИНСТРУМЕНТ ПОВЫШЕНИЯ РЕЗУЛЬТАТИВНОСТИ ПРОГРАММ ВСПОМОГАТЕЛЬНЫХ РЕПРОДУКТИВНЫХ ТЕХНОЛОГИЙ (ВРТ) // Современные проблемы науки и образования. 2016. № 4. ;URL: https://science-education.ru/ru/article/view?id=24955 (дата обращения: 28.02.2026).



