Особенности тканевой реакции на синтетические импланты, применяемые в герниологии, остаются предметом дискуссии, что связано с накоплением противоречивых долгосрочных результатов их клинического применения. Основные изменения вокруг волокон полипропиленовых сетчатых имплантов сопровождаются формированием фиброзной капсулы. Ключевая роль в ее развитии принадлежит особенностям синтетической активности макрофагов, адгезирующихся на поверхности протезирующего материала. Секреторную активность этих клеток обычно исследуют in vitro на бессмертных макрофагоподобных линиях, моноцитах или макрофагах, полученных из костномозговых предшественников путем их дифференцировки в культуре [4]. Она отражает реакцию фагоцитов, дифференцирующихся из моноцитов крови и мигрирующих в направлении провоспалительных сигналов. Выделение резидентных макрофагов для проведения экспериментальной оценки различных материалов in vitro - весьма трудоемкая и дорогостоящая процедура, не позволяющая воспроизвести естественную реакцию этих клеток in vivo.
Цель работы – изучить функциональную активность тканевых макрофагов in vivo, мигрирующих и адгезирующихся на поверхность протезирующих герниопластических материалов на основе полипропилена и титана.
Материал и методы исследования
Эксперименты выполнены на 29 белых лабораторных крысах обоего пола весом 180-250 г, которые случайным образом были разделены на группы. Животных содержали в условиях сертифицированного вивария (ИСО 9001:2008). При выполнении исследования руководствовались национальным стандартом РФ ГОСТ Р 33044-2014 «Принципы надлежащей лабораторной практики», полностью аутентичным стандартам GLP/OECD.
С соблюдением принципов асептики животным первой группы под общим обезболиванием (золетил – 3 мг/кг + рометар – 2 мг/кг, внутримышечно) выполняли средне-срединную лапаротомию с интраперитонеальной имплантацией на петли тонкой кишки фрагмента стандартного полипропиленового сетчатого протеза «Эсфил» (ЗАО «Линтекс», Россия) и Optomesh Thinlight (Tricomed, Польша). Животным второй группы аналогичным образом были установлены сетчатые протезы «Титановый шелк» (НПФ «Темп», Россия). Площадь имплантируемого материала составляла 12-20 см2 в зависимости от размера животного.
Через 52 часа в асептических условиях крысам выполняли релапаротомию и извлекали имплантированный материал, который разрезали на два фрагмента. Первый обрабатывали 0,25%-ным раствором трипсина Difco с ЭДТА (Invitrogen). Смытые клетки осаждали центрифугированием при 1500 об/мин (200 g), трехкратно отмывали ФСБ. Затем их лизировали в дистиллированной воде и замораживали при температуре -20 °С. После осаждения часть смытых клеток ресуспендировали в ЭСК. Из полученной суспензии делали мазки для окраски азур-эозином по Романовскому и выявляли активность неспецифической эстеразы моноцитов/макрофагов с применением набора «Диахим-цитостейн – нэ» («Абрис») в реакции с α-нафтилацетатом (Sigma-Aldrich).
В лизате определяли активность неспецифической эстеразы, содержание ДНК и активность металлопротеаз. Активность неспецифической эстеразы оценивали спектрофотометрически с о-нитрофенилбутиратом в качестве субстрата (Sigma-Aldrich) согласно протоколу фирмы–изготовителя (Esterase - CSRD). Количество ДНК определяли с помощью флуоресцентного красителя Hoechst 33258 согласно протоколу (DNA Quantitation Kit, Sigma-Aldrich) на планшетном ридере Infinite 200 PRO (Tecan). Калибровочную кривую для пересчета количества ДНК на число клеток строили с использованием суспензии клеток, полученных лаважом петель кишок интактных крыс.
Активность металлопротеаз выявляли методом желатиновой зимографии [9]. Образцы лизата клеток, стандарт активности коллагеназы из Clostridium histolyticum (Sigma-Aldrich, активность не менее 125 CDU/mg) и стандарты молекулярной массы (BIO-RAD, Broad range) наносили на гель, содержащий желатин (Sigma-Aldrich). После окончания электрофореза гели инкубировали в течение часа в 2,5%-ном растворе Тритона Х-100, помещали в 0.05М Трис (рН 7.8-8.0) с добавлением 0,9%-ного раствора натрия хлорида, 0,11% кальция хлорида, 0,05% азида натрия на 14 часов при 37 °С для проявления зимограммы, окрашивали Кумасси G-250 и дифференцировали 7,5%-ным раствором уксусной кислоты, содержащей 0,5% этанола. Идентификацию полос, проявляющих желатиназную активность, осуществляли по их молекулярным массам. Денситометрию зимограмм выполняли с помощью программного комплекса ImageJ. Активность металлопротеаз перитонеального экссудата, при его наличии, у экспериментальных животных определяли аналогичным способом.
Второй фрагмент извлеченного из брюшной полости образца сетчатого протеза размером около 0,5 см,2 помещали в стерильные флаконы со средой DMEM/F12+HEPES, содержащей 10% ЭСК (ООО «БиолоТ»), на 24 часа при 37 °С. После окончания инкубации протезирующий материал извлекали из среды, а адгезированные на нем клетки лизировали. В лизате определяли содержание ДНК, в среде - содержание ИЛ-1β, ИЛ-6, ИЛ-10 методом иммуноферментного анализа с помощью тест-систем производства eBioscience: Rat IL-1β Platinum ELISA - BMS630 (чувствительность от 4 pg/ml), Rat IL-6 Platinum ELISA – BMS625 (чувствительность от 12 pg/ml), Rat IL-10 Platinum ELISA -BMS629 (чувствительность от 1,5 pg/ml) на ИФА-ридере Multiscan FC (Thermo scientific).
Активность металлопротеаз, неспецифической эстеразы и содержание интерлейкинов представляли в пересчете на 106 мононуклеаров в соответствии с данными цитограмм и калибровочной кривой на ДНК.
Для определения достоверности различий показателей использовали непараметрический критерий Вилкоксона-Манна-Уитни (U). Достоверными считали различия при р<0,05.
Полученные результаты
Смытая с образцов протезирующих материалов обеих групп популяция клеток состояла преимущественно из мононуклеаров с округлыми или бобовидными ядрами (78-97%), а также включала незначительное число эозинофилов, нейтрофильных лейкоцитов и тучных клеток. Лимфоциты составляли менее 1% клеточной популяции.
Подавляющее большинство мононуклеаров, полученных с поверхности всех пластических материалов для герниопластики, содержало неспецифическую эстеразу с характерным для моноцитарных линий диффузным распределением фермента в цитоплазме, что позволяло идентифицировать их как макрофаги (рис. 1).
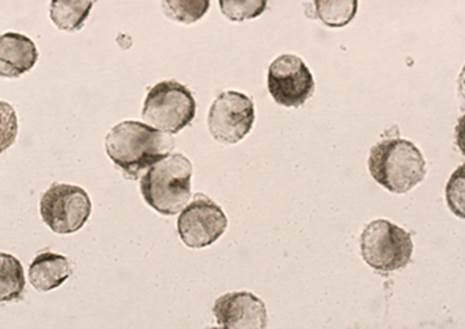
Рис. 1. Активность неспецифической эстеразы клеток, снятых с поверхности титановых имплантов. ИЦХ реакция с α-нафтилацетатом. Ув. 100
По активности неспецифической эстеразы, определяемой в лизате клеток биохимическим методом, достоверных различий между макрофагами, снятыми с различных протезирующих материалов, обнаружено не было (таблица).
Характеристики макрофагов, адгезированных на поверхности имплантов для герниопластики
|
Тип импланта |
ИЛ-1β пкг/106 клеток (М ± m) |
Диапазон варьирования ИЛ-1β, пкг/106 клеток |
ИЛ-10 пкг/106 клеток (M ± m) |
Диапазон варьирования Ил-10, пкг/106 клеток |
Эстераза внутриклеточная, mU /106 клеток |
ММР-9 внутриклеточная CDU/106 клеток |
|
|
Про-MMP-9 |
активная MMP-9 |
||||||
|
Эсфил |
0,51±0,23 n=4 |
0,37–1,05 |
16,8±7,2 n=4 |
7,36–35,11 |
0,67±0,05 n=7 |
1,63±0,60 n=7 |
0,23±0,07 n=7 |
|
Титановый шелк |
1,84±0,98 n=12 |
0,03–11,92 |
52,0±20,1 n=12 |
2,18–188,06 |
0,60±0,05 n=14 |
0,76±0,14* n=14 |
0,09±0,03* n=14 |
|
Optomesh ThinLight |
1,28±0,45 n=7 |
0,22–2,94 |
23,1±11,6 n=7 |
2,50–83,49 |
0,56±0,05 n=8 |
0,79±0,22* n=8 |
0,12±0,07 n=8 |
Примечание: * – достоверные отличия по критерию Манна-Уитни от импланта «Эсфил» при р<0,05.
Содержание ИЛ-6 в средах культивирования вторых фрагментов тестируемых материалов с адгезированными макрофагами оказалось ниже или на уровне порога чувствительности используемого метода. Содержание Ил-1 β и ИЛ-10 в среде инкубации макрофагов, адгезированных на поверхности как титанового, так и полипропиленового сетчатых протезов, варьировало в широких пределах (таблица), что подтвердилось крайне высокими значениями стандартного отклонения и ошибки средней величины для сравниваемых материалов. Характерной особенностью цитокинового профиля макрофагов всех животных оказалось значительное превалирование уровня секреции Ил-10 над уровнем секреции Ил-1β.
На зимограммах были визуализированы фракции с желатиназной активностью, соответствующей про-ММР-9 (Mr=94 кДа); активной ММР-9 (Mr=82 кДа); про-ММР-2 (Mr=68 кДа); активной ММР-2 (Mr=62 кДа), а также полоса с Mr около120 кДа, что было расценено как комплекс про-ММР-9 с липокалином (рис. 2).
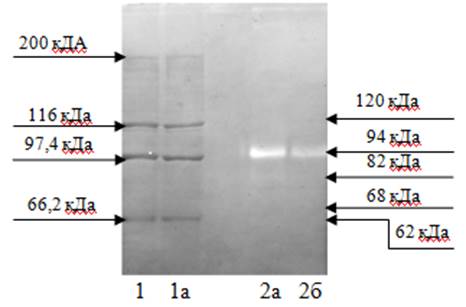
Рис. 2. Зимограмма лизата клеток и стандарты молекулярной массы.
1 и 1а – дубли стандартов молекулярной массы. 2 – локализация полос с желатиназной активностью: 2а – имплант «Эсфил» и 2б – имплант «Титановый шелк»
Наиболее четко и на всех зимограммах была выражена фракция про-ММР-9 и активная форма ММР-9. Остальные фракции были определены не на всех зимограммах.
Содержание про-ММР-9 в макрофагах, адгезированных на образце материала «Эсфил», значительно выше, чем в клетках, снятых с образцов эндопротезов Optomesh и «Титановый шелк». Наряду с этим выявлено увеличение количества активной формы ММР-9 в макрофагах из материала «Эсфил» по сравнению с клетками, адгезированными на материале «Титановый шелк» (таблица). Однако процентное соотношение активной ММР-9 статистически не отличалось для макрофагов, адгезированных на всех трех исследуемых видах материалов для герниопластики (10,78±2,73% - Optomesh; 11,43±2,10% - «Титановый шелк» и 14,32±3,82% - «Эсфил»).
Обсуждение результатов
Известно, что макрофаги, дифференцирующиеся из моноцитов крови на поверхностях различных имплантируемых материалов in vitro, нельзя отнести ни к классически (М1), ни к альтернативно (М2) активированным, поскольку они экспрессируют цитокины и ферменты, характерные для обеих субпопуляций, с последующим смещением (при длительном культивировании) спектра цитокинов от провоспалительных к противовоспалительным [10; 11]. В опубликованном нами ранее исследовании также показано, что в течение первых суток после имплантации макрофаги активно мигрируют к поверхности эндопротезов на основе титана и полипропилена и синтезируют медиаторы М1 фенотипа [1]. В настоящей работе при инкубации в культуральной среде всех видов протезирующих материалов с адгезированными на них макрофагами выявлено многократное преобладание секреции ИЛ-10 над ИЛ-1β, при этом синтез клетками ИЛ-6 незначительный или отсутствует. Эти особенности цитокинового профиля тканевых макрофагов, адгезированных на полипропиленовых и титановом сетчатых протезах, свидетельствуют о том, что данная популяция клеток не инициирует реакцию воспаления ни на одном из исследованных нами видов эндопротезов. Приведенные данные хорошо согласуются с результатами исследования D.M. Higgins et al., обнаруживших синтез фиксированными на поверхности нейлоновых сетчатых протезов макрофагами мыши ИЛ-4, ИЛ-10, ИЛ-13 и TGF-b и отсутствие экспрессии ими провоспалительных медиаторов ИЛ-6, ФНО-α и ИФ-γ [8].
Обращает на себя внимание высокая вариабельность синтеза и секреции ИЛ-1β и ИЛ-10 макрофагами разных животных, что, возможно, и не позволяет выявить различий в цитокиновом профиле клеток, адгезированных на различных видах эндопротезов. Эти данные не являются следствием технической ошибки. Многие авторы указывают на индивидуальные наследственные колебания уровней продукции цитокинов у человека и животных, которые влияют на выраженность воспалительной реакции, что объясняется функциональным полиморфизмом генов цитокинов [2]. Значительные различия в индивидуальной реактивности показаны как в клинических исследованиях, так и в экспериментах. S. Orenstein et al. представили данные об очень высокой вариабельности секреции ИЛ-1β мононуклеарами крови различных доноров in vitro. Так, при изначально одинаковом уровне нестимулированного синтеза ИЛ-1β макрофагами взаимодействие клеток с протезирующим материалом для герниопластики AlloMax приводило к индукции ответа с шестидесятикратной разницей в показателях [12]. Данные экспериментальных исследований показали, что мыши различных генетических линий отличаются по интенсивности стимулированной секреции ИЛ-1β моноцитами крови более чем в 36 раз [7].
Металлопротеазы макрофагов являются эффекторными молекулами с разнообразными функциями. Нами показано, что в течение первых трех суток при контакте с чужеродными материалами перитонеальные макрофаги крыс синтезируют в основном про-ММП-9, и в очень незначительном количестве – про-ММП-2. Два различных по составу протезирующих материала – на основе титана («Титановый шелк») и полипропилена (Optomesh) – индуцируют одинаковый уровень экспрессии про-ММП-9, в то время как обнаруживаются достоверные различия между двумя имплантами из одного и того же полимера – полипропилена («Эсфил» и Optomesh). Полученные различия могут быть обусловлены особенностями микро- и нанотопографии поверхностей материалов. Известно, что метод желатиновой зимографии не исключает частичной активации проформ металлопротеаз в процессе пробоподготовки [13]. Кроме того, активные формы ММП-9 и ММП-2 обнаруживаются внутри клеток и в естественных условиях [6]. Поэтому наличие определенной доли активной ММП-9 внутри клеток, скорее всего, не имеет отношения к реакции их на материал и связано с особенностями пробоподготовки и/или с наличием в клетках конститутивно активной формы ММП-9.
Металлопротеазы, в том числе и макрофагальные, всегда рассматривались как ферменты деградации межклеточного матрикса. Однако ММП-9 обладает уникальным свойством – она является профиброгенным фактором, поскольку обеспечивает процессинг латентной формы TGF-β, переводя его в активную форму, инициирующую рост соединительной ткани [3]. Повышенный уровень синтеза про-ММП-9 макрофагами на поверхности сетчатого протеза «Эсфил»» может указывать на более интенсивный фибриллогенез в зоне протезирования этим материалом.
Таким образом, подавляющее число мононуклеаров, адгезированных на поверхности полипропиленовых и титанового имплантов для герниопластики, являются макрофагами. Клетки в присутствии всех исследованных материалов изменяют свое функциональное состояние в направлении выраженной секреции ИЛ-10, низких уровней ИЛ-6 и ИЛ-1β, высокого внутриклеточного содержания про-MMП-9 и незначительного-ММП-9, про-MMП-2 и ММП-2. Полученные данные свидетельствуют о функциональной активности макрофагов репаративного типа, способных стимулировать регенерацию раны и фибриллогенез. Высокая индивидуальная вариабельность секреции интерлейкинов ИЛ-10 и ИЛ-1β макрофагами, адгезированными на поверхности эндопротезов, возможно, связана с генетическим полиморфизмом и может быть причиной различной выраженности воспалительного ответа на импланты, изготовленные даже из одного вида материала.
Библиографическая ссылка
Милякова М.Н., Пономарева Ю.В., Грибкова О.В., Сарбаева Н.Н., Лимарева Л.В., Богуш В.В. ФУНКЦИОНАЛЬНЫЕ ОСОБЕННОСТИ МАКРОФАГОВ ПРИ ВЗАИМОДЕЙСТВИИ С ИМПЛАНТАМИ ДЛЯ ГЕРНИОПЛАСТИКИ // Современные проблемы науки и образования. 2016. № 3. ;URL: https://science-education.ru/ru/article/view?id=24856 (дата обращения: 21.02.2026).
DOI: https://doi.org/10.17513/spno.24856



