В настоящее время основной причиной развития сердечной недостаточности является ишемическая болезнь сердца (ИБС), и в частности инфаркт миокарда (ИМ) [4]. Известно, что обширность поражения сердечной мышцы является важным фактором, влияющим на характер постинфарктного ремоделирования сердца и клинические проявления ишемической болезни сердца, а также сердечной недостаточности. Поэтому постинфарктное ремоделирование сердца вызывает большой интерес у исследователей [3].
После инфаркта миокарда развивается патологический тип ремоделирования, обусловленный дилатацией полости левого желудочка, потерей значительного объема сократительного миокарда, что приводит к сердечной недостаточности. Выраженность раннего и позднего постинфарктного ремоделирования определяется многими факторами, включая размер и локализацию инфаркта, активность симпато-адреналовой системы, регуляцию ренин-ангиотензин-альдостероновой системы и натрийуретических пептидов [3].
В последние десятилетия широко обсуждается влияние симпатической нервной системы на течение сердечно-сосудистых заболеваний, в том числе и на ремоделирование ЛЖ. Ее активность определяется генетическими факторами, физической нагрузкой и особенностями медикаментозного лечения. При развитии сердечной недостаточности на фоне постинфарктного ремоделирования уровень симпатической активности повышается, а концентрация катехоламинов в крови обратно пропорциональна выживаемости [3].
С учетом вышесказанного представляется актуальным проведение исследования нарушения функций левого желудочка в зависимости от общеклинических данных и параметров, отражающих состояние вегетативной нервной системы (ВНС).
Цель исследования: на основании изучения влияния вегетативного статуса на ремоделирование левого желудочка у больных, перенесших инфаркт миокарда, разработать математическую модель прогнозирования ремоделирования левого желудочка.
Материалы и методы исследования. Проведено открытое простое исследование методом поперечного среза, в которое вошло 107 пациентов, перенесших инфаркт миокарда. Исследование проводилось на базе БУЗОО «Городская клиническая больница № 1 им. Кабанова А.Н.» города Омска. Критерии включения: возраст от 35 до 65 лет; перенесенный ИМ со стабильным течением ИБС не ранее шести месяцев, предшествующих точке включения в исследование; устойчивый синусовый ритм, письменное информированное согласие. Критерии исключения: некомпенсированные органические клапанные пороки; злокачественные новообразования; сахарный диабет; сопутствующие заболевания в фазе обострения; дыхательная, печеночная, почечная недостаточность; острые заболевания на момент включения в исследование. Исследование соответствует положениям Хельсинкской декларации, протокол исследования утвержден локальным Этическим комитетом Омского государственного медицинского университета.
Всем пациентам проведено общеклиническое исследование, включавшее расспрос, физикальное исследование с определением антропометрических показателей (рост, масса тела, окружность талии (ОТ)), с последующим вычислением индекса массы тела по Кетле (ИМТ) и площади поверхности тела. Проводился анализ данных медицинской документации, содержащей сведения о результатах обследования пациентов (ОАК, ОАМ, биохимические исследования крови, в том числе – липидный спектр крови).
Функциональный класс стенокардии определяли согласно классификации Канадского сердечно-сосудистого общества, стадия и функциональный класс хронической сердечной недостаточности (ХСН) – согласно национальным клиническим рекомендациям по диагностике и лечению сердечной недостаточности [4]. Инструментальные методы диагностики включали в себя электрокардиографию (ЭКГ), эходоплеркардиографию (ЭхоКГ), исследование вариабельности сердечного ритма (ВСР).
При проведении ЭхоКГ на аппарате «MayLab 20» определяли структурные и функциональные параметры левого желудочка (ЛЖ). Оценивали следующие параметры ремоделирования ЛЖ [3]: конечный диастолический размер (КДР), см; конечный систолический размер (КСР), см; конечный диастолический объем (КДО), мл; конечный систолический объем (КСО), мл; относительная толщина стенок ЛЖ (ОТС), которая рассчитывалась по формуле: ОТС = (ЗСЛЖ+МЖП)/КДР; фракция выброса, ФВ %; масса миокарда левого желудочка (ММЛЖ), г; индекс ММЛЖ (иММЛЖ), г/м2; индекс конечного систолического размера ЛЖ (иКСР), который рассчитывался по формуле: иКСР = КСР/площадь поверхности тела; индекс конечного диастолического размера ЛЖ (иКДР), который рассчитывался по формуле: иКДР = КДР/площадь поверхности тела. О наличии гипертрофии ЛЖ судили по иММЛЖ: при иММЛЖ более 115 г/м2 у мужчин и более 95 г/м2 у женщин.
Всем пациентам на момент включения в исследование проведено 5-минутное исследование вариабельности сердечного ритма (ВСР) в покое на приборе «ВНС-микро» (компании «Нейрософт», Россия). Проанализированы временные и спектральные (частотные) параметры ВСР [5]: 1) RRNN, мс – средняя длительность интервалов R-R; 2) SDNN, мс – стандартное отклонение величин нормальных отклонений интервалов R-R, интегральный показатель, характеризующий в целом ВСР и отражающий влияние разных отделов вегетативной нервной системы на синусовый узел; 3) pNN50, % – доля последовательных интервалов R-R, различие между которыми составляет 50 мс; 4) TP, мс^2 – общая мощность спектра; 5) HF% – высокочастотные колебания ЧСС при частоте 0,15-0,40 Гц, что отражает вагусный контроль сердечного ритма (колебания парасимпатического отдела вегетативной нервной системы (ВНС)); 6) LF% – низкочастотные колебания ЧСС при частоте 0,04-0,15-Гц, на мощность в этом диапазоне оказывает влияние преимущественно изменение тонуса симпатического отдела ВНС; 7) VLF% – очень низкочастотные колебания в диапазоне 0,003-0,04 ГЦ, на которые оказывают влияние гуморальные факторы, такие как ренин-ангиотензин-альдостероновая система, концентрация катехоламинов в плазме и т.д.
Анализ полученных данных проводился с использованием редактора электронных таблиц MS Excel 7.0 и статистической программы STATISTICA 6.0. Количественные данные на предварительном этапе статистического анализа оценивали на нормальность распределения по критерию Shapiro-Wilk. Непрерывные переменные представлены при нормальном распределении в виде средней арифметической (М±σ), при распределении, отличном от нормального - в виде медианы и межквартильных интервалов (Ме, 25%; 75%). Номинальные данные представлены в виде относительных частот объектов исследования (n, %). Достоверность различий непрерывных данных оценивали с помощью непараметрических критериев: для несвязанных выборок – парного критерия Mann-Whitney U-test, для связанных – критерия Wilcoxon signed-ranks test. Для оценки различий номинальных данных использовали Fisher test при анализе несвязанных выборок и критерий McNemar's test - для связанных. Критический уровень значимости нулевой статистической гипотезы (р) принимали равным 0,05; при р<0,05 различия считались статистически значимыми [6].
Из 107 пациентов, перенесших инфаркт миокарда и включенных в исследование, у 44 (41,1%) в анамнезе было стентирование коронарных артерий, у 12 (11,2%) – аорто-коронарное шунтирование. Среди них 93 пациента – мужчины (86,9%), 14 – женщины (13,1%). Средний возраст пациентов составил 55±5,5 года. Мужчины и женщины были сопоставимы по возрасту (р=0,8). Клиническая характеристика пациентов представлена в таблице 1.
Таблица 1
Клиническая характеристика пациентов, перенесших инфаркт миокарда
|
Клинические параметры |
Все пациенты, n= 107 (100%) |
р, при сравнении относительных показателей |
|
|
мужчины, n=93 (86,9%) |
женщины, n=14 (13,1%) |
||
|
Возраст пациентов, включенных в исследование, Me (25;75) |
56 (51;59) |
||
|
54,5 (51;59) |
56,4 (55; 60) |
0,13 |
|
|
Количество перенесенных инфарктов миокарда, 1/2/3, n= (%) |
91 (85,0%)/ 14 (13,1%)/ 2 (1,9%) |
||
|
81 (87%)/ 11 (12%) / 1 (1%) |
10 (71,4%)/ 3 (21,4%)/ 1 (7,2%) |
0,09/ 0,3/ 0,1 |
|
|
АКШ в анамнезе, n= (%) |
12 (11,2%) |
||
|
12 (12,9%) |
0 |
0,09 |
|
|
Стентирование в анамнезе, n= (%) |
44 (41,1%) |
||
|
39 (41,9%) |
5 (35,7%) |
0,79 |
|
|
ФК стенокардии, I/II/III, n= (%)** |
24/58/25 (22,4%/54,2%/23,4%) |
||
|
22 (23,7%)/ 52 (55,9%)/ 19 (20,4%) |
2 (14,2%)/ 6 (42,9%)/ 6 (42,9%) |
0,4/ 0,4/ 0,06 |
|
|
Стадия ХСН, I/II/III, n= (%) |
22 (20,6%)/ 82 (76,6%)/ 3 (2,8%) |
||
|
20 (21,5%)/ 70 (75,3%)/3 (3,2%) |
2 (14,3%)/ 12 (85,7%)/ 0 |
0,02*/ 0,4/ 0,5 |
|
|
ФКХСН, I/II/III, n= (%)** |
12 (11,2%)/76 (71,0%)/19 (17,8%) |
||
|
12 (12,9%/ 64 (68,8%)/ 17 (18,3%) |
0/12 (85,7%)/ 2 (14,3%) |
0,2/ 0,2/ 0,7 |
|
|
Степень АГ, I/II/III, n= (%) |
18 (16,8%)/ 24 (22,4%)/ 52 (48,6%) |
||
|
18 (19,4%)/ 21 (22,6%)/ 41 (44%) |
0/ 3 (21,4%)/ 11 (78,6%)*** |
0,002*/0,07/ 0,02* |
|
|
ИМТ, кг/м² |
28,7 (26,5; 31,4) |
||
|
29,2 (26,5; 31,4) |
30,5 (27,3; 33,7) |
0,36 |
|
|
ОТ, см |
102 (74;123) |
92,5 (85;140) |
0,88 |
|
Количество человек с абдоминальным ожирением, n=(%) |
43(46,2%) |
9(64,3%) |
0,32 |
* Достоверность различий между мужчинами и женщинами, ** пациентов с IV степенью/ФК в исследовании не было; *** у 13 (14%) мужчин АГ не было; р - уровень значимости, АКШ – аорто-коронарное шунтирование, АГ – артериальная гипертензия, ФК – функциональный класс, ХСН – хроническая сердечная недостаточность, ИМТ – индекс массы тела, ОТ – окружность талии.
В исследовании количество мужчин было достоверно больше, чем женщин (р<0,001), что, возможно, связано с таким фактором риска ССЗ, как мужской пол. Как видно из табл. 1, мужчины и женщины сопоставимы по возрасту на момент включения в исследование, по количеству перенесенных ИМ, по ФК стенокардии, по ИМТ, по локализации ИМ, по ОТ и количеству лиц с абдоминальной формой ожирения. У мужчин достоверно чаще проводилось стентирование коронарных артерий (р<0,001), АКШ, и они имели достоверно более низкие степени сопутствующей артериальной гипертензии.
Результаты и обсуждение. Всем пациентам на момент включения в исследование проведена ЭхоКГ. Данные ЭхоКГ, отражающие ремоделирование левого желудочка, у исследуемых пациентов, перенесших инфаркт миокарда, представлены в таблице 2.
Таблица 2
Показатели ЭхоКГ у пациентов, перенесших инфаркт миокарда, в зависимости от наличия и вида коронарного вмешательства
|
Исследуемые пациенты |
||||
|
Показатель ЭхоКГ, Ме (25;75) |
все пациенты |
перенесшие только ИМ |
перенесшие ИМ и стентирование коронарных артерий |
перенесшие ИМ и АКШ |
|
n=107 |
n=53 |
n=42 |
n=12 |
|
|
КДР, см |
5,5 (5,1;5,7) |
5,4 (5,2;5,7) |
5,4 (5,0;5,7) |
5,8 (5,3;6,1) |
|
КСР, см |
3,8 (3,4;4,1) |
3,8 (3,5;4,1) |
3,6 (3,2;4) |
4,0 (3,9;4,6) |
|
*иКДР, см/м² |
2,7 (2,5;2,8) |
2,6 (2,5;2,7) |
2,6 (2,4;2,8) |
2,9 (2,7;3,1) |
|
*иКСР, см/м² |
1,8 (1 ,6;2,0) |
1,8 (1,7;2,0) |
1,8 (1,6;1,9) |
2,1 (1,9;2,3) |
|
КДО, мл |
146,4 (123,8;160) |
141,3 (129,5;160,0) |
138,3 (118,2;160,0) |
163,3 (132,4;186,9) |
|
КСО, мл |
62,7 (47,4;74,2) |
61,9 (50,9;74,2) |
54,4 (40,9;70,0) |
70,1 (63,9;94,9) |
|
ФВ % |
57,6 (51,3;64) |
57,1 (52,5;64,0) |
60,7 (52,2;65,4) |
52,1 (47,9;60,8) |
|
ММЛЖ, г |
210,4 (170,2;249,3) |
206,7 (172,7;241,4) |
195,9 (167,4;234,6) |
206,3 (189,4;281,9) |
|
иММЛЖ, г/м2 |
101,7 (47,4;74,2) |
100,3 (84,3;111,9) |
95,5 (83,6;110,4) |
106,6 (94,2;141,4) |
|
ОТСЛЖ, мм |
36,5 (32,1;40,7) |
36,5 (32,7;40,7) |
37,8 (31,6;41,1) |
33,9 (31,8;37,0) |
* Уровень значимости (р) по тесту Kruskal-Wallis менее 0,05.
При анализе параметров ЭхоКГ нормальная геометрия левого желудочка выявлена у 71% (76 пациентов), у остальных 29% (31 пациент) выявлены различные патологические типы ремоделирования левого желудочка. В исследуемой группе был 41 (38,3%) пациент с ФВ менее 55%, 32 (29,9%) пациента с гипертрофией ЛЖ по иММЛЖ, и 2 (1,9%) – с дилатацией ЛЖ по иКДР (>3,2 см/м²). В зависимости от уровня иММЛЖ и ОТС были определены четыре типа ремоделирования ЛЖ [7]:
1) концентрическая гипертрофия левого желудочка (увеличение иММЛЖ и ОТС);
2) эксцентрическая гипертрофия (увеличение иММЛЖ при нормальной ОТС);
3) концентрическое ремоделирование (увеличение ОТС при нормальном иММЛЖ);
4) нормальная геометрия левого желудочка.
Наиболее благоприятным вариантом ремоделирования ЛЖ для прогноза у больных с постинфарктным кардиосклерозом является 4-й тип - нормальная геометрия ЛЖ [7].
По вариантам ремоделирования ЛЖ [7] пациенты в исследуемых группах в зависимости от наличия КВ не различались (Р>0,05). Чаще всего встречалась нормальная геометрия ЛЖ, реже - эксцентрическая гипертрофия ЛЖ, и в незначительном количестве случаев - концентрическое ремоделирование и гипертрофия ЛЖ.
При исследовании вариабельности сердечного ритма для большинства пациентов исследуемой группы отмечается снижение временных показателей и общей мощности спектра ВСР, а также преобладает доля VLF, что свидетельствует о снижении адаптационных возможностей сердечно-сосудистой системы, повышении степени гуморальной регуляции ВСР и является признаком автономной кардионейропатии (табл. 3).
Таблица 3
Временные показатели и спектральные показатели ВСР у пациентов, перенесших инфаркт миокарда, в зависимости от наличия и вида коронарного вмешательства
|
Показатель ВСР |
Все пациенты, n=107 |
Пациенты, перенесшие только ИМ, n=53 |
Пациенты, перенесшие ИМ и стентирование коронарных артерий, n=42 |
Пациенты, перенесшие ИМ и АКШ, n=12 |
|
Ме (25; 75) |
||||
|
RRNN, мс |
949 (872;1048) |
949 (878; 1055) |
948 (866;1030) |
958 (890,5;1030) |
|
*SDNN, мс |
37 (24;66) |
48 (23;69) |
32 (25;64) |
31 (23;37,5) |
|
pNN50, % |
2,05 (0,32;6,48) |
3,34 (0,58; 7,26) |
2,03 (0,31;7,18) |
0,696 (0,001 3,055) |
|
TP, мс^2 |
674 (417;1521) |
729 (426; 2101) |
665,5 (394;1039) |
712,5 (449;1357,5) |
|
VLF% |
53 (44,8;66,4) |
53,7 (46,7;64,0) |
52,2 (33,8;66,5) |
57,9 (45,8;79,8) |
|
LF% |
26,8 (19,1;32,9) |
27,6 (20,5;32,5) |
26,1 (20,6;33,4) |
57,9 (45,8;79,8) |
|
HF% |
17,5 (9,9;27,7) |
18,3 (9,38;28,0) |
16,6 (10,7;29,5) |
12,7 (6,0;22,3) |
*Статистически значимые отличия групп (р<0,05) по тесту Kruskal-Wallis.
Как видно из таблицы 3, во всех группах пациентов SDNN изначально снижена (менее 50 мс), что свидетельствует о снижении ВСР в целом у больных, перенесших ИМ. Однако в группе пациентов без коронарного вмешательства SDNN достоверно несколько выше, чем в других группах. Полученные данные, возможно, связаны с тем, что в группу с коронарными вмешательствами вошли пациенты с более тяжелым течением ИБС, соответственно и риск неблагоприятного прогноза, возможно, определяло не наличие коронарного вмешательства, а более тяжелое течение атеросклероза.
Для дальнейшего анализа зависимости вариантов ремоделирования ЛЖ от ВСР мы исключили пациентов с АКШ, так как они значимо отличались по SDNN от остальной когорты наших пациентов, а пациентов с ИМ и ИМ+стентирование объединили в одну группу. У всех пациентов исследуемой группы также отмечалось снижение общей мощности спектра ВСР, преобладание доли VLF по 5-минутному исследованию ВСР, что отражает повышение степени гуморальной регуляции вариабельности сердечного ритма, а также свидетельствует о снижении адаптационных возможностей сердечно-сосудистой системы. Частотные показатели спектрального анализа ВСР различались у исследуемой группы пациентов в зависимости от варианта ремоделирования ЛЖ (рисунок).
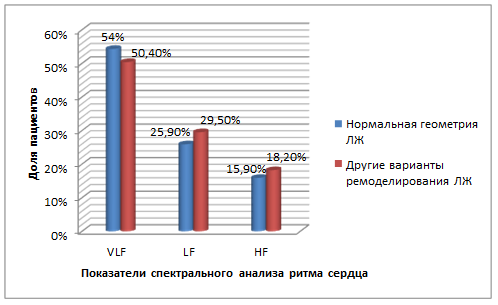
Частотные показатели ВСР у пациентов, перенесших инфаркт миокарда без АКШ, в зависимости от варианта ремоделирования левого желудочка
Статистически значимых различий частотных показателей ВСР в зависимости от наличия нормального варианта ремоделирования ЛЖ или других неблагоприятных типов ремоделирования ЛЖ (рисунок) не было. Хотя имелась тенденция к повышению симпатических влияний (LF%) в группе с неблагоприятными типами ремоделирования ЛЖ (р=0,05), тогда как гуморальные влияния у них были выражены в меньшей степени (VLF%). Выявленные изменения ВСР отражают общую тенденцию у больных с постинфарктным кардиосклерозом и соответствуют литературным данным [1; 5].
В нашем исследовании более половины пациентов, перенесших ИМ, имели избыточную массу тела, у 43 (46,2%) мужчин имелась абдоминальная форма ожирения (объем талии более 102 см), у 9 (64,3%) женщин также имелось абдоминальное ожирение (объем талии более 88 см).
Для изучения влияния вегетативного статуса и антропометрических данных на ремоделирование ЛЖ нами был проведен регрессионный анализ. Оценивалась связь между клиническими (антропометрическими) данными, параметрами ВСР и ЭхоКГ у больных, перенесших ИМ. В модель были включены пациенты, перенесшие инфаркт миокарда без АКШ, в том числе и перенесшие стентирование коронарных артерий (95 (88,8%) пациентов), так как они статистически не различались по параметрам ЭхоКГ, отражающим ремоделирование ЛЖ. Статистическую значимость модели в целом оценивали по F-критерию Фишера и уровню значимости (р) [6]. В модель были включены следующие предикторы: объем талии, см, и LF% в спектральном анализе ВСР (табл. 4).
Таблица 4
Параметры регрессионной модели для прогноза иКДР у пациентов, перенесших инфаркт миокарда без АКШ
|
Параметр |
Cтандартизованные коэффициенты b |
P |
F (для модели в целом) |
P (для модели в целом) |
|
9,32 |
<0,001 |
|||
|
(Constant) |
7,05 |
<0,001 |
||
|
Объем талии в см |
-0,87 |
0,001 |
||
|
LF% ВСР |
-0,13 |
0,004 |
Согласно полученной регрессионной модели иКДР у пациентов, перенесших ИМ без АКШ, может быть вычислена по формуле:
иКДР = 7,05- 0,87×LnХ1-0,13×LnХ2,
где LnХ1 - натуральный логарифм окружности талии в см, LnХ2 - натуральный логарифм LF% ВСР. Статистическая значимость модели в целом: F = 9,32; р<0,001, что также подтверждено правильным распределением остатков в модели.
иКДР, отражающий размер ЛЖ по отношению к площади поверхности тела, при его увеличении более 3,2 см/м² свидетельствует об изменении геометрии ЛЖ [7]. Следует предположить, что пациенты с предсказанным иКДР менее 3,2 имеют нормальную геометрию ЛЖ, в то время как при значении предсказанного иКДР более 3,2 имеется один из вариантов патологического постинфарктного ремоделирования (концентрическое ремоделирование ЛЖ, концентрическая гипертрофия ЛЖ или эксцентрическая гипертрофия ЛЖ).
Пример. Пациент Шаломенко Д.В. 60 лет, обратился на прием к кардиологу с целью диспансерного осмотра по поводу ИБС. Стенокардия напряжения ФК II. ПИКС (2014). ХСН II А. ФК II. Артериальная гипертензия III стадии, риск 4. Получает лечение согласно стандартам ведения пациентов после перенесенного инфаркта миокарда. Течение заболевания стабильное. Рост - 178 см, вес - 110 кг, ОТ - 124 см, ППТ по формуле Гебана и Георга – 2,36. По ЭхоКГ выявлено увеличение КДР - 5,5 см, иКДР - 2,3 см/м². При проведении во время приема 5-минутной записи ВСР - доля LF=63% в общем спектре. Предсказанный иКДР=7,05-0,87×LnОТ-0,13×Ln LF%=7,05- 0,87×Ln124-0,13×Ln63=7,05-0,87×4,82-0,13×4,14=2,3. Следовательно, можно предположить отсутствие патологического варианта ремоделирования ЛЖ.
Наличие ремоделирования сердца само по себе предопределяет прогрессирование хронической сердечной недостаточности. Предотвращение ремоделирования сердца может служить ключом к прерыванию порочного круга сердечно-сосудистого континуума, который развивается при ХСН.
Как продемонстрировано в многочисленных клинических исследованиях, у пациентов после инфаркта миокарда объемы левого желудочка обладают предсказательной ценностью развития неблагоприятных сердечно-сосудистых событий, включая смерть, повторный инфаркт, желудочковые аритмии и митральную регургитацию [7]. У 30–50% пациентов, перенесших инфаркт миокарда, наблюдается прогрессирующая дилатация полости ЛЖ [7] с нарушением геометрии ЛЖ.
Ремоделирование ЛЖ у пациентов, перенесших ИМ, зависит от ЧСС и состояния ВНС. Так, увеличение ЧСС ухудшает показатели ремоделирования сердца [8], а дисбаланс вегетативной нервной системы с преобладанием активности симпатической нервной системы, приводящий к повышению ЧСС, является одним из факторов, форсирующих патологическое ремоделирование ЛЖ [7]. Также у пациентов, перенесших ИМ, происходит существенная перестройка автономной нервной системы сердца, что связано с анатомическими и функциональными сдвигами. Это ведет к нарушению как симпатических, так и парасимпатических регуляторных влияний, что связано со значительной структурной перестройкой миокарда. Это приводит к снижению вариабельности сердечного ритма и проявляется изменением временных параметров (уменьшение SDNN, RRNN, pNN50) и характеристик спектрального анализа (снижение общей спектральной мощности (ТР), уменьшение высокочастотной (HF), увеличение низкочастотной составляющих спектра (LF) и изменение их соотношения) [2].
Ожирение, как фактор риска ремоделирования сердца, в сочетании с сердечно-сосудистой патологией, в настоящее время является предметом активного изучения [10]. Абдоминальное ожирение также приводит к гиперактивации симпатической нервной системы [9].
В настоящее время ЭхоКГ остается золотым стандартом диагностики ремоделирования ЛЖ у больных, перенесших ИМ. И согласно плану диспансерного наблюдения проведение данного вида исследования рекомендовано 1 раз в год. Однако чем раньше будет диагностировано изменение геометрии ЛЖ, тем более эффективно можно проводить профилактику прогрессирования сердечной недостаточности. В связи с этим представляет интерес выявление когорты больных, у которых можно предположить на амбулаторном приеме изменения ремоделирования ЛЖ, и направить таких больных на ЭхоКГ с расширенным количеством параметров для определения типа ремоделирования ЛЖ.
Расчет прогнозируемого иКДР по предложенному регрессионному уравнению позволяет выделить пациентов, требующих проведения внеплановой ЭхоКГ. Таким образом, у пациентов, перенесших инфаркт миокарда, на основании измерения ОТ и определения степени выраженности симпатических влияний (LF%) можно предсказать изменение геометрии ЛЖ на основании расчета предсказанного иКДР, и при получении расчетной величины более 3,2 рекомендовать проведение внеплановой ЭхоКГ с определением варианта ремоделирования ЛЖ и, соответственно, коррекции лечения.
Таким образом, мы предполагаем, что результаты нашего исследования могут помочь в более ранней диагностике прогрессирования ХСН у больных, перенесших инфаркт миокарда, что также позволит персонифицировано проводить лечение этих больных, улучшить их клиническое состояние, качество жизни и прогноз.
Библиографическая ссылка
Замахина О.В., Бунова С.С., Усачева Е.В., Нелидова А.В., Шерстюк С.А., Женатов А.Б. РЕМОДЕЛИРОВАНИЕ ЛЕВОГО ЖЕЛУДОЧКА СЕРДЦА В ЗАВИСИМОСТИ ОТ ВЕГЕТАТИВНОГО СТАТУСА У БОЛЬНЫХ, ПЕРЕНЕСШИХ ИНФАРКТ МИОКАРДА // Современные проблемы науки и образования. 2016. № 3. ;URL: https://science-education.ru/ru/article/view?id=24681 (дата обращения: 08.02.2026).



