Изучению метаболизма нейромедиаторов в крови при различных заболеваниях посвящены работы, в которых установлена роль гистамина. Показано, что он является регулятором многих жизненно важных функций организма и участвует в процессах нейротрансмиссии, иммуномодуляции, гемопоэза, заживления ран, биологических ритмах день-ночь [3]. Накопление гистамина в организме может привести к патологическим явлениям. Изучено его выделение из клеток при анафилатических и аллергических реакциях и установлена роль гистамина как медиатора гиперчувствительности немедленного типа. Эти процессы сопровождаются увеличением содержания указанного нейромедиатора, причем степень выраженности реакций определяется повышением его концентрации. Нарушение метаболизма гистамина, приводящее к увеличению его содержания в организме, наблюдается и при нейродермите, поллинозе, которые относится к группе аллергических расстройств [1]. Создание диагностических тестов определения гистамина для мониторинга его физиологических функций является актуальной задачей. Для этой цели используют лабораторные способы иммуноанализа, основанных на применении антител [4]. В последние годы расширились диагностические возможности применения антител для оценки изменения содержания эндогенных биорегуляторов. Наряду с разработкой классических методов иммуноанализа, в которых применяют моноклональные антитела, либо созданные по технологии иммунизации животных, получили развитие методы определения естественных антител к биомолекулам различного вида [2]. Установлено, что важной составной частью циркулирующих иммуноглобулинов являются естественные антитела (E-AT) [5,6]. Показано, что при патологических состояниях происходит изменение нормального уровня E-AT, которое, как правило, связано с нарушением метаболизма того или иного ключевого эндогенного соединения, участвующего в патогенезе заболевания. Предметом данного исследования являлись естественные антитела к гистамину, присутствующие в сыворотке крови больных с аллергическими расстройствами.
Цель данной работы заключалась в выделении аффинной хроматографией естественных антител к гистамину из сыворотки крови больных аллергическими расстройствами, проведении сравнительного исследования их иммунохимических свойств и установлении возможности диагностического применения.
Материалы и методы
Основными материалами работы были образцы биологической жидкости – сыворотки крови. Для исследования получены образцы сыворотки крови 70 больных нейродермитом в возрасте от 18 до 34 лет со средней продолжительностью заболевания 7,0±1,5 лет в отделе иммунологии ГУ ЦНИКВИ Росздрава. Образцы сыворотки крови для исследования 55 больных в возрасте от 19 до 54 лет и продолжительностью заболевания в среднем 7.9±1.2 лет с диагнозом поллиноз, предоставлены Клинической больницей № 4 г. Пенза. Степень тяжести кожного процесса определяли с помощью индекса SCORAD. Больные нейродермитом были распределены на 2 группы: первую группу со средней степенью тяжести составили 16 человек, индекс SCORAD равнялся 49.60+3,44. Вторую с тяжелыми проявлениями заболевания и индексом SCORAD 68.142,2+l,23 – 13 человек. При проведении иммунохимических исследований в качестве контрольных образцов использовали сыворотки крови 25 здоровых доноров в возрасте от 20 до 50 лет, полученные в Учреждении Российской академии медицинских наук Гематологическом научном центре РАМН.
Получение конъюгата гистамина на основе полимерной матрицы
Синтез конъюгированного антигена гистамина на основе поли(4-нитрофенил)акрилата выполняли следующим образом. К раствору 6 мг (0.036 ммоль) поли(4-нитрофенил) акрилата в 1 мл ДМФАабс, добавляли 1.1 мг (0.009 ммоль) гистамина и выдерживали реакционную смесь в течение суток при температуре 20 °С. Добавляли для инактивации не прореагировавшего активированного эфира 5 % раствор аммиака. Растворитель упаривали в вакууме. Оставшееся масло многократно промывали эфиром и растворяли в 1 мл ДМФАабс, оставляли на хранение при температуре -20 °С. В результате был получен конъюгат гистамина, содержащий 15 молей гаптена на моль полимерного носителя.
ИФА определения антител к гистамину в сыворотке крови человека
Планшет сенсибилизировали раствором конъюгированного антигена гистамина (по 100 мкл в лунку) в 2 мкг/мл концентрации в 0.02 М карбонатном буфере (рН 9.5) в течение 18 часов при температуре 4 °С. После сорбции планшет отмывали трижды (3*100 мкл) 0.005 % раствором твин-20 взабуференном физиологическом растворе (ЗФР) (рН 7.2), и вносили в лунки в двух повторах по 100 мкл исследуемой сыворотки в растворе ЗФР, содержащем 0.01 % твин-20, в разведении 1/200. Планшет инкубировали в течение 1 часа при температуре 37 °С. Отмывали, как описано выше, и добавляли в лунки по 100 мкл раствора антивидовых антител либо против IgG, либо против IgM человека, меченные пероксидазой хрена в разведении 1/2000. Далее выполняли стандартную процедуру ИФА. Полученные данные обработали статистически по критерию Стьюдента.
Получение сорбента для аффинной хроматографии антител к гистамину
При получении сорбента для аффинной хроматографии 2 г суспензии макропористого аминопропилированного стекла, предварительно активированного полинитрофенилак-рилатом, к 3 мл диметилформамида (ДМФ) добавляли раствор 5 мг гистамина в 1 мл ДМФ. Реакционную смесь перемешивали ночь при 4 °С, затем добавляли 2 мл 0,1 % этаноламина в ДМФ. Через 2 ч полученный сорбент промывали 100 мл ЗФР, а затем таким же объемом ЗФР, содержащим 0,05 % твина-20. Для определения емкости полученного сорбента использовали кислотный гидролиз 0,1 г активированного гистамином макропористого стекла с последующим определением гидролизата с помощью элементного анализа. В результате установлено, что иммуносорбент содержит 0,8 мг/г ковалентно связанного гистамина.
Выделение антител к гистамину аффинной хроматографией
Для выделения антител к гистамину из сыворотки крови больных нейродермитом и доноров иммуносорбент помещали в колонку и уравновешивали ЗФР, затем добавляли 2 мл исследуемой сыворотки, инкубировали в течение 10 минут. Далее осуществляли элюцию не связавшихся сывороточных белков ЗФР, используя для контроля выходящих фракций проточную кювету при длине волны 280 нм. После падения оптической плотности в проходящем через колонку элюате до нуля, проводили смену буфера на 0.2 М глицин-HCl (pH 2.8) и выделяли с колонки вторую фракцию, в которой немедленно доводили pH до 7.2 раствором 1 М K2HPO4.Определили концентрацию антител, связывающих гистамин в выделенных фракциях. Содержание иммуноглобулинов, хроматографированных из сыворотки крови больных находилось в среднем интервале 0.062±0.040 мг/мл, а в сыворотке крови доноров составляло 0.022±0.004 мг/мл.
Ингибиторный ИФА для оценки специфичности и аффинности антител к гистамину
Раствором выбранной концентрации антигена гистамина (диапазон от 100 до 300 нг/мл) в карбонатном буфере 0.05 М (рН 9.5) сенсибилизировали лунки планшета (по 100 мкл) в течение 18 часов при температуре 4 °С, затем промывали и добавляли по 100 мкл смеси, содержащей выделенные антитела в разведении 1:2 и различные концентрации ингибитора в интервале от 10-12 до 10-6 моль/л. Планшет инкубировали в течение 1 часа при температуре 37 °С и проводили описанные выше операции ИФА.
Определение специфичности антител к гистамину
На основании полученных данных ИФА строили кривую зависимости изменения оптической плотности (OD450) от концентрации добавленного ингибитора, по которой устанавливали условия 50 % торможения для каждого образца сыворотки при взаимодействии антител с иммобилизованным на планшете антигеном. Специфичность рассчитывали, как отношение молярных концентраций антигена и исследуемого соединения, вызывающих в ИФА 50 % ингибирование.
Расчёт константы аффинности антител к гистамину
Расчёт Ка проводили на основании кривых ингибиторного ИФА, при использовании в качестве ингибитора исследуемого антигена. Ка определяли как обратную величину концентрации свободного ингибитора, необходимую для 50 % торможения антител (I50), связавшихся с иммобилизованным на планшете антигеном: Ka=1/I50.
Обсуждение полученных результатов
Конъюгированные антигены гистамина синтезировали с использованием полимерной матрицы, путём конденсации исходногосоединения, содержащего свободную аминогруппу, с поли(4-нитрофенил)акрилатом. Соотношение гаптена и полимерного носителя варьировало в реакции от 70 % до 10 % замещения гистамином. Обнаружено, что из всего разнообразии синтезированных конъюгированных антигенов, комплексы с 10–15 % замещением полимерной матрицы гистамином являются наиболее пригодными для определения всей популяции специфических иммуноглобулинов, которые, как известно, различаются по силе связывания с антигеном и содержанию в каждой индивидуальной сыворотке крови человека.Выявление иммуноглобулинов в сыворотке крови пациентов, связывающих гистамин, выполняли твердофазным ИФА
Таблица 1
Условия ИФА определения антител к гистамину в анализируемых образцах сыворотки крови
|
Исследуемый антиген, содержащий в качестве гаптена: |
Изотип иммуноглобулинов |
Интервал разведения сыворотки |
Интервал концентрации сорбируемого антигена, мкг/мл |
|
Гистамин |
IgM |
1/100 – 1/1200 |
0,05 – 2 |
|
IgG |
1/100 – 1/800 |
0,05 – 3 |
На основании выбранных условий ИФА проводили определение содержания антител IgG и IgM класса в индивидуальных сыворотках здоровых лиц и больных нейродермитом, аллергическим поллинозом (рис.1).
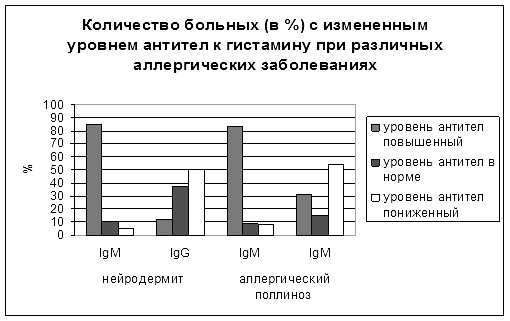
Рис. 1. Изменение уровня антител к гистамину при различных аллергических заболеваниях
Проведённая статистическая обработка полученных данных позволила установить, что больных условно можно подразделить на три категории: группа с пониженным, с повышенным и соответствующим норме содержанием антител. В плане дальнейшего развития исследования необходимо:
1) Установить, как связаны изменения уровня антител с развитием заболевания.
2) Определить, насколько эти изменения являются специфическими и отражают участие гистамина в патогенезе.
Таблица 2
Данные ИФА выявления антител IgM класса к гистамину в сыворотке крови больных и доноров
Исследуемый антиген |
Значение оптической плотности (OD450) в ИФА в среднем по группе |
|||
|
Больные нейродермитом 1 группа |
Больные нейродермитом2 группа |
Больные аллергическимполлинозом |
Доноры |
|
|
Гистамин |
0.72±0.042* |
0.41±0.039* |
0.34±0.054* |
0.64±0.041 |
*p<0,05
Для группы больных содержание антител IgMкласса было наиболее информативным и позволяло обнаружить высокий процент пациентов с достоверным изменением уровня антител по сравнению с нормой. Причем для больных нейродермитом уровень антител к гистамину различался в зависимости от тяжести процесса и был повышенным для пациентов первой группы (SCORAD равнялся 49.60+3,44).
Выделение антител к гистамину из сыворотки крови доноров и больных нейродермитом и поллинозом проводили аффинной хроматографией с помощью синтезированного иммуносорбента. Из сыворотки крови доноров и больных выделены антитела к гистамину IgG и IgM класса. Причём у 60 % доноров установлено наличие антител класса IgG и только в единичных случаях 10 % одновременно присутствовали IgM и IgG антитела. При исследовании изотипического состава антител против гистамина, выделенных из сыворотки крови больных, обнаружены значительные отличия по сравнению с донорами. У 70–80 % обследованных больных выделены антитела IgM класса, а у остальных – IgM и IgG класса. Для анализируемых образцов антител против гистамина определили константу аффинности (Ка). В таблице 3 представлены обобщенные данные значений Ка для больных аллергическим поллинозом, нейродермитом и доноров. В группе больных наблюдается возрастание аффинности антител и Ка лежит в диапазоне от 105-107 М-1 до 107-1010 М-1 .
Таблица 3
Определение Ка для антител, выделенных из сыворотки крови доноров и больных
|
Исследуемый антиген |
Диапазон Ка, М-1 |
|||
|
Группа больных |
Группа доноров |
|||
|
гистамин |
IgG |
IgM |
IgG |
IgM |
|
106-107 |
107-1010 |
103-104 |
103-104 |
|
Далее для всех исследуемых образцов аффинно очищенных антител была изучена специфичность связывания с некоторыми антигенами, имеющими либо сходные с гистамином структурные фрагменты, либо проявляющих похожую физиологическую активность (рис. 2). В результате установлено, что все выделенные из сыворотки крови антитела индивидуальны по своей специфичности и не дают перекрёстных реакций с исследованными ингибиторами, отличающимися по структуре от использованных для аффинной хроматографии.
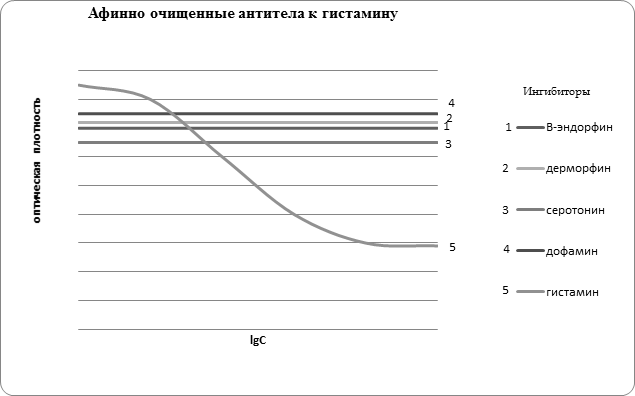
Рис. 2. Специфичность антител, выделенных из сыворотки крови больных
Таким образом, разработанный метод ИФА определения антител к гистамину позволяет установить изменения содержания антител в кровотоке больных при патологических состояниях, характеризующихся нарушением метаболизма указанного биорегулятора. Проведено исследование иммунохимических свойств естественных антител к гистамину. Показаны новые диагностические возможности выявления естественных антител для мониторинга болезненных процессов с участием гистамина.
Библиографическая ссылка
Морозова В.С., Другова Е.Д., Петроченко С.Н., Мягкова М.А. ИММУНОХИМИЧЕСКИЕ СВОЙСТВА ЕСТЕСТВЕННЫХ АНТИТЕЛ К ГИСТАМИНУ В НОРМЕ И ПРИ ПАТОЛОГИИ // Современные проблемы науки и образования. 2016. № 3. ;URL: https://science-education.ru/ru/article/view?id=24611 (дата обращения: 13.03.2026).



