Нарушение целостности верхнечелюстной пазухи является широко распространённой самостоятельной патологией, сопровождающей различные типы переломов костей верхней челюсти [7]. При переломах костей средней зоны лица различной этиологии в подавляющем большинстве случаев встречаются повреждения стенок верхнечелюстного синуса [15]. Однако в тактике лечения пациентов с травматическими повреждениями костей средней зоны лица данная нозология часто отодвигается на второй план, а то и вовсе не учитывается [5,16]. Ряд авторов отмечают значительную возможность инфицирования верхнечелюстного синуса, поскольку в 20 % случаев, даже в клинически здоровом синусе, имеется бактериальный рост, наличие же микрофлоры при травме гайморовой пазухи выявлено почти во всех исследованиях [3,4]. По мнению ряда авторов, основными источниками инфицирования верхнечелюстных синусов являются периапикальные очаги воспаления, одонтогенные кисты, инородные тела, перфорации дна пазухи [2,14]. Причем наряду с бактериальной микрофлорой в развитии воспалительных процессов существенная роль принадлежит микотической инфекции, в последние годы в связи с бурным развитием имплантологии увеличилось число пациентов с синуситами после дентальной имплантации и синус-лифтинга [5,15]. Недооценка этих факторов, как правило, влечет за собой ошибки в диагностике и лечении больных с травмами средней зоны лица, что приводит к грубым деформациям и функциональным нарушениям – возникают диплопия, затрудненное носовое дыхание, развиваются дакриоциститы, риниты, а также снижается качество пережевывания пищи [6,8]. Очевидна необходимость углубленного изучения проблемы травматических повреждений верхнечелюстного синуса и в организационном плане, и в совершенствовании лечебной тактики на различных этапах медицинской реабилитации, позволяющих повысить положительные исходы, получить более высокие функциональные и эстетические результаты, сократить сроки реабилитации больных [9,10]. Между тем нет достаточного количества работ, в которых при лечении больных с острой травмой средней зоны лица были бы изучены и учтены причины и пути развития посттравматических воспалительных процессов верхнечелюстного синуса [11,12]. Известно, что основой для изучения нозологической формы является детальное исследование морфологических изменений на всех этапах развития патологического процесса. Однако в литературе отсутствуют данные о морфологических изменениях в повреждённых верхнечелюстных пазухах. Можно лишь предположить, что в верхнечелюстной пазухе в этот период может развиваться реактивное острое серозное воспаление, но патологоанатомического или морфологического подтверждения этого процесса в литературе нами не обнаружено.
С теоретической и практической точки зрения представляется целесообразным создать экспериментальную модель травматического верхнечелюстного синусита. Данную модель можно будет в дальнейшем использовать для изучения эффективности экспериментальной патогенетической терапии больных с повреждением целостности гайморовой пазухи, апробации существующих методов лечения этого заболевания, разработки новых, персонализированных методов оперативного доступа к верхнечелюстному синусу и лечения. Результаты исследований могут быть использованы как при разработке рекомендаций по послеоперационному ведению больных с травматическим верхнечелюстным синуситом, так и у пациентов после проведенной синусотомии. Важность проблемы лечения и профилактики синуситов различной этиологии обусловлена еще и тем, что она выходит за рамки одной специальности – собственно оториноларингологии, а тесным образом переплетается с целым рядом смежных специальностей, таких, как стоматология, челюстно-лицевая хирургия, травматология, иммунология, патологическая физиология. Все вышесказанное указывает на необходимость дальнейшего совершенствования диагностики посттравматических патоморфологических процессов в слизистой оболочке верхнечелюстной пазухи при одонтогенных процессах различной этиологии.
Цель исследования: определение особенностей посттравматических патоморфологических процессов в слизистой оболочке верхнечелюстной пазухи в эксперименте.
Материалы и методы исследования. Для изучения анатомо-морфологического строения верхнечелюстной пазухи, формирования и обоснования экспериментальной модели травмы гайморовой пазухи использовали 16 кроликов породы «Серый великан» в возрасте от 1 до 2 лет (взрослые животные).
В основной группе (12 животных) экспериментальную модель травмы формировали под общим внутримышечным наркозом 2 % раствора ксилазина гидрохлорида и 2 % раствора кетамина гидрохлорида из расчета веса животного (0,15 мл на 1 кг) наружным доступом (рис. а) остеотомии верхней челюсти по Ле-Фор I с последующим выполнением сагиттальных распилов до обнажения слизистой оболочки верхнечелюстного синуса (рис. б). В контрольной группе (4 животных) объектом исследования являлась слизистая оболочка интактной верхнечелюстной пазухи.
Животные обеих групп содержались в одинаковых условиях на обычной диете и не подвергались каким-либо лечебным мероприятиям. Забор материала осуществлялся под общим наркозом. В ходе повторного хирургического вмешательства через 3, 7 суток, 1 и 2 месяца выпиливали костные фрагменты в оперированной ранее области вместе со слизистой оболочкой верхнечелюстного синуса. Выделенные блоки фиксировали в 10 % нейтральном формалине, декальцинировали в трилоне-Б и подвергали стандартной гистологической обработке с заливкой в парафин. Срезы толщиной 8–10 мм окрашивали гематоксилин-эозином, по Ван-Гизон, альциановым синим и по Маллори.
Эксперимент на животных проведен в соответствии с принципами надлежащей лабораторной практики (Национальный стандарт «Принципы надлежащей лабораторной практики» ГОСТ Р 53434-2009) и положительным заключением этического комитета СтГМУ. Материалы исследования подвергнуты математической обработке на персональном компьютере с помощью пакетов статистических программ Exel 2007, Statistica for Windous 5.0. Для сопоставления двух, трех или более эмпирических распределений одного и того же признака использовали непараметрические методы, альтернативные параметрическому критерию Стьюдента: W-критерий Уилкоксона, χ2-критерий Пирсона, U-критерий Манна – Уитни, а также коэффициент ранговой корреляции Спирмена.
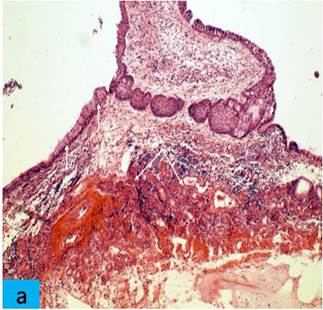
Результаты исследования. В тканевых структурах верхнечелюстной пазухи на 3 сутки после нанесения травмы в основной группе по сравнению с контрольной (рис. а) имеются существенные различия. В собственной пластинке слизистой оболочки основной группы регистрируются сосудистые расстройства (стазы, сладжи, очаги кровоизлияний). Отмечено выраженное увеличение периваскулярных пространств, фрагментация соединительной ткани. Среди элементов соединительной ткани определяется клеточная инфильтрация с преобладанием нейтрофильных лейкоцитов.
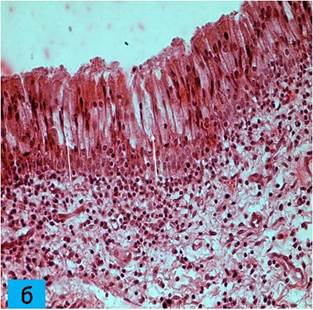
Микропрепараты контрольной (а) и опытной группы (б) на 3-и сутки эксперимента. а - нормальное соотношение реснитчатых и бокаловидных эпителиоцитов слизистой оболочки верхнечелюстной пазухи (отмечено стрелками). Окраска гематоксилином и эозином. Об. 20, ок. 10; б - десквамация эпителиальных клеток слизистой оболочки (отмечено стрелками). Окраска гематоксилином и эозином. Об. 20, ок. 20
Высота эпителия 18,2±1,4 мкм, соотношение реснитчатых 161,6±6,5 и бокаловидных эпителиоцитов 9,8±3,2 в 1 мм (1:16), без значительных изменений по сравнению с контролем (р>0,05). На третьи сутки собственная пластинка слизистой оболочки пазухи на всём протяжении отёчная, сосуды полнокровны. Отмечается десквамация эпителиальных клеток слизистой оболочки. В просвете пазухи среди слизи видны немногочисленные полиморфноядерные лейкоциты и слущенный эпителий. Резко увеличивается секреция желёз собственного слоя слизистой оболочки. В очагах кровоизлияний выявляются зёрна гемосидерина. Собственная пластинка инфильтрирована полиморфноядерными лейкоцитами (рис. б).
На седьмые сутки эксперимента преобладает равномерная инфильтрация стромы лимфоцитами и макрофагами. Просвет сосудов расширен. Фрагментация соединительнотканных элементов сохранена. В эпителии пазухи формируется подобие сосочковых выростов с фиброзом подлежащей ткани. Регистрируется отёк слизистой оболочки, нарушение боковых клеточных контактов, повышение секреции бокаловидных клеток и некроз некоторых участков мерцательного эпителия. В собственном слое слизистой оболочки наблюдается полнокровие сосудов и десквамация эпителия желёз собственного слоя слизистой оболочки. Эпителиальные клетки железистых протоков набухшие, вакуолизированные. В просвете пазухи накапливается умеренное количество нейтрофилов и десквамированных эпителиальных клеток.
Спустя 4 недели после нанесения травмы многие эпителиоциты имеют признаки дистрофических изменений и некроза, лишь отдельные клетки сохранили реснички. Высота эпителиального пласта на всём протяжении понизилась до 11,7±2,1 мкм (Р<0,05). Базальная мембрана значительно утолщена, собственная пластинка сохраняет картину отёка в зоне, прилежащей к линии перелома стенки пазухи. Определяется скудная инфильтрация собственной пластинки нейтрофильными лейкоцитами и лимфоцитами. Регистрируются пролифераты фибробластов с формированием рыхлой соединительной ткани. Эти процессы ярче протекают в очагах старых обширных кровоизлияний. В зоне значительных повреждений эпителия отмечены выраженные полиповидные образования с частичной эпидермальной метаплазией и десквамацией эпителиального пласта. В слизистой оболочке пазухи обширные очаги десквамации реснитчатых эпителиоцитов. Определяется снижение секреторной активности бокаловидных клеток и уменьшение их количества. В собственных железах слизистой оболочки наблюдается отёк с обтурацией просвета протоков секретом и десквамированным эпителием. К 60 суткам на фоне исчезающей многорядности мерцательного эпителия регистрируются участки со снижением его высоты до 10,9±1,9 мкм (р<0,05). Выявлены признаки метаплазии многорядного эпителия в многослойный плоский. Количество бокаловидных клеток резко снижено по сравнению с контролем 4,3±1,41 мм (р<0,05). Снижение высоты эпителиального слоя обусловлено процессами воспаления и дегенеративно-дистрофическими изменениями слизистой оболочки. Следует отметить, что общий механизм регенеративного действия включает в себя усиление биосинтеза пуриновых и пиримидиновых оснований, РНК, функциональных и ферментативных клеточных элементов, в том числе фосфолипидов мембран, а также стимуляцию редупликации ДНК и деления клеток, поэтому в собственной пластинке преобладает картина хронического воспаления с выраженной эозинофильной инфильтрацией, а в собственных железах пазухи отмечены признаки их гиперфункции.
Заключение. На основании полученных результатов установлено, что перелом костных стенок верхнечелюстной пазухи кролика вызывает развитие альтеративно-экссудативного воспаления слизистой оболочки, которое выражается в формировании отёка сразу после травмы с последующим его нарастанием вплоть до седьмых суток. Отёк слизистой оболочки сопровождается гиперемией кровеносных сосудов с третьих по седьмые сутки и массовой инфильтрацией соединительной ткани лейкоцитами, причём, сначала преобладают нейтрофилы, а к седьмым суткам нарастает количество лимфоцитов и макрофагов. Спустя 4 недели после травмы наблюдается скудная инфильтрация соединительной ткани преимущественно эозинофилами, в то же время отмечены признаки репарации в виде формирования пролифератов фибробластов в очагах старых обширных кровоизлияний. Наиболее тяжёлые очаговые повреждения наблюдаются в зонах, непосредственно прилежащих к линии перелома, и на всей латеральной стенке – здесь же проявляются адаптивные механизмы с признаками метаплазии многорядного эпителия в многослойный плоский. Таким образом, при повреждении костных стенок верхнечелюстного синуса в его слизистой оболочке развивается выраженное альтеративно-экссудативное воспаление, которое переходит в хроническую форму спустя 4 недели после травмы.
Библиографическая ссылка
Щетинин Е.В., Сирак С.В., Кошель И.В. ПАТОФИЗИОЛОГИЧЕСКОЕ ИССЛЕДОВАНИЕ ОСОБЕННОСТЕЙ ПОСТТРАВМАТИЧЕСКИХ ПРОЦЕССОВ ТКАНЕЙ ВЕРХНЕЧЕЛЮСТНОЙ ПАЗУХИ В ЭКСПЕРИМЕНТЕ НА ЖИВОТНЫХ // Современные проблемы науки и образования. 2016. № 3. ;URL: https://science-education.ru/ru/article/view?id=24535 (дата обращения: 16.02.2026).



