Учитывая высокий защитно-приспособительный потенциал, пульпа зуба является перспективным объектом для исследования в эксперименте и клинике [1; 2; 13]. Сохранение жизнеспособной пульпы при эндодонтических вмешательствах обеспечивает нормальную трофику тканей зуба и предупреждает периапикальные осложнения [4; 5]. В ряде исследований последних лет показано, что после витальной ампутации корневая пульпа сохраняет свою жизнеспособность, продуцируя репаративный дентин, а через 6-8 недель после операции вторичный дентин обнаруживается даже визуально [9; 10; 14]. Сегодня постоянно ведутся поиски наиболее эффективных средств, сохраняющих корневую пульпу и стимулирующих репаративный дентиногенез [6; 13]. Для защиты корневой пульпы некоторые авторы предлагают препараты, содержащие коллаген, мукополисахариды, антибиотики, антисептики, анестетики, гормоны [3; 7]. Особенностью коллагена считается его способность образовывать комплексы с лекарственными и биологически активными веществами, что дает возможность создания лекарственных препаратов пролонгированного действия, в которых коллаген играет роль депо. Перспективным также является использование коллагеновой губки в качестве матрицы-носителя для различных тканеинженерных конструкций [8; 15]. Особое значение приобретают в этой связи эктомезенхимальные стволовые клетки, дающие начало одонтобластам пульпы зуба. В настоящее время в основе идентификации данных клеток организма лежит оценка их морфологии с помощью поверхностных маркеров. Одним из наиболее перспективных маркеров стволовых клеток является C-kit (CD117), который является рецептором к фактору стволовых прогенеторных клеток StemCellsFactor – SCF, что характеризует его как рецептор, маркирующий «взрослые» или «способные к дифференциации» стволовые клетки. Молекула С-kit обладает свойствами тирозинкиназ. В результате связывания этих поверхностных молекул происходит активация С-kit, что влечет за собой усиление пролиферации и переход клеток-предшественников на более высокий, «продвинутый» уровень дифференцировки [11; 12]. В научных публикациях встречаются данные об обнаружении С-kit-позитивных клеток у человека в сердце, желудке и кишечнике, мочеточниках, а также единичные сведения об их идентификации в почках, поджелудочной железе и пульпе зуба.
Цель исследования. Исследование роли С-kit-позитивных клеток пульпы зуба в оптимизации репаративного дентиногенеза при биологических методах лечения пульпита в условиях экспериментального остеопороза.
Материал и методы исследования. Для покрытия корневой пульпы при биологическом методе лечения пульпита использовали тканеинженерную конструкцию, в состав которой входит гидрогель PuraMatrix/3DM с эктомезенхимальными клетками, иммобилизованными на коллагеновую губку. Данная тканеинженерная конструкция представляет собой синтетический биодеградируемый матрикс-гель на основе олигопептидных фрагментов, формирующий нанонити и предварительно культивированные эктомезенхимальные клетки барана, обработанные 5-азацитидином. Готовый тканеинженерный продукт получали путем механического смешивания геля с прекультивированными эктомезенхиальными клетками in situ, а затем иммобилизовали на стерильную коллагеновую губку, которую получали путем лиофилизации замороженных растворов коллагена. Выбор губки в качестве матрицы-носителя тканеинженерной конструкции обусловлен тем, что, меняя параметры исходного раствора и режима лиофилизации, можно варьировать структуру губки, изменяя тем самым ее механическую прочность, эластичность, адсорбционную емкость, скорость ангио- и неогенеза в зависимости от цели применения. Кроме того, большая внутренняя поверхность, гидрофильность коллагеновых губок обусловливает хороший гемостатический эффект, и губка резорбируется быстрее, благодаря чему осуществляется наибольший контакт корневой пульпы с тканеинженерной конструкцией.
Экспериментальное исследование проведено на 12 двухлетних овцах, которые были разделены на 2 группы: основную и контрольную. В основной группе формировали экспериментальную модель остеопороза: под общим наркозом (Zoletil 50) выполняли овариоэктомию, затем в течение 3 месяцев проводили внутримышечные инъекции дексаметазона (10 мг/кг массы по 4 инъекции в неделю). Забор материала производили в области нижних резцов, путем выделения зубоальвеолярных сегментов под общим наркозом через 1, 7, 14, 30, 60 и 180 суток после начала опыта. В контрольной группе исследовали соответствующие зубоальвеолярные сегменты у интактных животных.
Для получения экспериментальной модели острого пульпита применяли следующую методику. С язычной поверхности бором формировали полости по типу глубокого кариеса и инфицировали различными штаммами микроорганизмов, выделенных из кариозных зубов человека, после чего зубы пломбировались. Как показали гистологические исследования, такая методика вызывала серозно-гнойное воспаление коронковой пульпы. Через 1 сутки под местной анестезией sol. Ultracaini 4% с адреналином у животных производили витальную ампутацию пульпы. Гемостаз пульпы осуществляли стерильными ватными шариками. В основной группе животных на дно пульповой камеры в области устья корневого канала накладывали тканеинженерную конструкцию, состоящую из коллагеновой губки, гидрогеля PuraMatrix/3DM и прекультивированных эктомезенхимальных клеток с последующим пломбированием зуба. В контрольной группе в состав коллагеновых губок вводили гидрокортизон, фурацилин, хондроитинсульфат, анестезин (всего 8 различных прописей), а также использовали препараты, содержащие гидрат окиси кальция — кальцин-пасту и кальмецин, поскольку они, как известно, обладают выраженным дентиногенным действием. Зубы удаляли в сроки от 1 суток до 6 месяцев. Материал, взятый для гистологических исследований, фиксировали в 10%-ном растворе забуференного формалина, проводили через спирты возрастающей плотности и ксилол, а затем заливали в гистологическую среду «Гистомикс» с использованием гистологического процессора замкнутого типа Tissue-Tek VIP™ 5 Jr. производства Sakura (Япония). Идентификацию введенных в состав тканеинженерной конструкции прекультивированных клеток и собственных клеток пульпы проводили с использованием гистохимических методов оценки, включая анализ активности C-kit - трансмембранного рецептора белка тирозина.
Эксперимент на животных проводили в соответствии с принципами надлежащей лабораторной практики (Национальный стандарт «Принципы надлежащей лабораторной практики» ГОСТ Р 53434-2009) и положительным заключением этического комитета СтГМУ.
Результаты и обсуждение. Используя коллаген в комбинации с другими препаратами при витальной ампутации пульпы зуба в эксперименте, мы исходили из принципов патогенетической терапии ран: закрытие раневой поверхности от вторичной инфекции; ускорение дентиногенеза за счет стимуляции его образования на поверхности тканеинженерной конструкции из коллагена с прекультивированными эктомезенхимальными клетками и гидрогелем PuraMatrix/3DM; стимуляция заживления раны и отложения солей кальция путем комплексообразования с хондроитинсульфатом, являющимся естественным активатором фибриллогенеза и связывающим ионы кальция; ускорение регенерации действием продуктов лизиса. Предполагалось, что коллаген в составе тканеинженерной конструкции может стать основой для образования новой ткани и, рассасываясь, постепенно будет замещаться дентином, образуя, таким образом, дентинный мостик, прикрывающий вход в корневые каналы.
При исследовании гистологических препаратов контрольной группы в сроки 7-14 суток установлена вакуолизация одонтобластов, гиперемия периферических отделов пульпы, появление внутрипульпарных кист, кровоизлияний в пульпе и слое одонтобластов, серозный отек плащевого дентина и частичное его отторжение (рис. а). На гистологических препаратах в основной группе в эти же сроки после витальной ампутации и наложения коллагеновой губки с тканеинженерной конструкцией также выявлены воспалительные изменения, выражающиеся в незначительном полнокровии сосудов корневой пульпы, отеке, диапедезных кровоизлияниях. К 30-м суткам эксперимента в контрольной группе серозно-фибринозная экссудация сменяется диффузной нейтрофильной, а затем лимфоидно-макрофагальной инфильтрацией. Резорбция инокулированной коллагеновой губки в основном осуществляется макрофагами, которые к данному сроку наблюдения местами формируют макрофагальный «барьер» между губкой и корневой пульпой с эктазией дентинных канальцев и некрозом отростков одонтобластов. В основной группе процессы регенерации пульпы протекают значительно быстрее, и к сроку 1 месяц развитие соединительной ткани на месте лизированной коллагеновой губки идет не только с периферии, но и из центра корневой пульпы. Гистохимическими методами установлено, что в резорбции тканеинженерной конструкции активно участвуют многоядерные гигантские клетки, появляющиеся позднее макрофагов вокруг нерезорбированных фрагментов коллагеновой матрицы.
Через 2 месяца после начала опыта в контрольной группе наблюдаются фрагменты новообразованного дентина, расположенные на периферии корневого канала, но не смыкающиеся в центре; описанная картина на некоторых препаратах имела вид «прерванного моста».
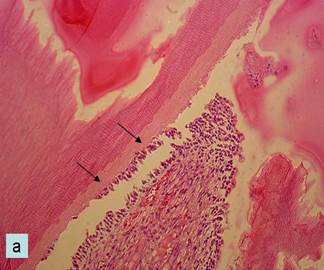
Микропрепараты - гистологические срезы биоптатов пульпы зубов экспериментальных животных на 7-е (а) и 14-е (б) сутки после начала опыта; а - серозный отек плащевого дентина и его отторжение. Окраска гематоксилином и эозином. Об. 20, ок. 10;
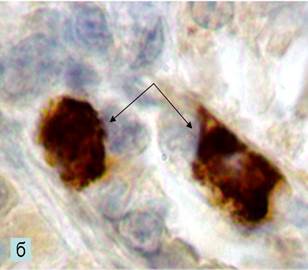
б - многоядерные гигантские клетки (отмечены стрелками), имеющие более темное окрашивание вокруг ядра по всей цитоплазме. Гистохимическая реакция на C-kit (CD117) маркер (рецептор фактора стволовых клеток). Ок. 100, об. 40
К данному сроку в основной группе во всех исследуемых препаратах отмечается четко сформированный дентинный мостик, по структуре схожий с дентином, отделяющий корневую пульпу от пульповой камеры. Новообразованный дентин с хорошо выраженными, параллельно расположенными дентинными канальцами образуется от стенок корневого канала и, смыкаясь, формирует четкий барьер. Корневая пульпа полностью сохранена, иногда отмечается полнокровие сосудов. Слой одонтобластов также хорошо выражен, на некоторых препаратах при сформированном дентинном мостике в корневой пульпе отмечаются склеротические изменения и очаги лимфо-гистиоцитарной инфильтрации.
Гистохимические методы исследования показали, что активизация пролиферации в основной группе обеспечена клеточным составом использованной тканеинженерной конструкции. В основной группе животных произошла активизация клеток как эктомезенхимального, так и мезенхимального стволовых компартментов пульпы зуба: прекультивированные эктомезенхимальные клетки из тканеинженерной конструкции реализовали свое участие в процессе регенерации пульпы на каждом этапе межклеточного взаимодействия по регуляции большинства биологических процессов в клетке, таких как пролиферация, дифференцировка, адгезия клеток и миграция (рис. б). За счет реакции окислительного фосфорилирования тирозина тирозинкиназой обеспечивается связывание трансмембранного рецептора C-kit с лигандом SCF, что позволило оценить антиапоптотические события в прогениторных клетках на каждом из этапов репаративного дентиногенеза.
Таким образом, в контрольной группе при использовании коллагеновой губки в комбинации с различными препаратами, призванными стимулировать регенерацию корневой пульпы после витальной ампутации, образование дентинного мостика протекает значительно медленнее, чем в основной группе. Намечающийся дентинный мостик в контрольной группе мы наблюдали только к сроку трех месяцев; напротив, в основной группе репаративный дентиногенез завершался построением дентинного моста к сроку двух месяцев. В ряде случаев корневая пульпа под дентинным мостиком в контрольной группе вообще не регенерировала, и на большинстве препаратов наблюдались явления ее фиброзного превращения.
Заключение. Полученные результаты свидетельствуют о том, что в ранние сроки наблюдения от 1 до 7 суток в корневой пульпе после витальной ампутации коронковой пульпы у экспериментальных животных основной и контрольной групп развивается асептическое воспаление. В последующие сроки наблюдения в основной группе разработанная тканеинженерная конструкция оказывает наиболее выраженное влияние на каждом этапе процесса заживления и регенерации: защищает пульпу от инфицирования, уменьшает экссудацию, оказывает гемостатический эффект, а в отдаленные сроки способствует значительному ускорению образования дентинного мостика.
Библиографическая ссылка
Сирак С.В., Кобылкина Т.Л., Сирак А.Г. ОПТИМИЗАЦИЯ РЕПАРАТИВНОГО ДЕНТИНОГЕНЕЗА ПРИ БИОЛОГИЧЕСКИХ МЕТОДАХ ЛЕЧЕНИЯ ПУЛЬПИТА // Современные проблемы науки и образования. 2016. № 3. ;URL: https://science-education.ru/ru/article/view?id=24518 (дата обращения: 01.02.2026).



