В последние годы в России и за рубежом широкое распространение в лечении больных с дегенеративно-дистрофическими заболеваниями суставов (ДДЗС) получила операция замены больного сустава на искусственный (эндопротезирование) [5; 6]. Не затрагивая вопросы потребности в таких операциях, мы попытались выяснить причины «недолговечности» искусственных суставов. Как известно из литературы, средняя продолжительность «жизни» эндопротеза тазобедренного сустава (ЭТБС) составляет 10-11 лет. Чаще всего поводом к его замене является асептическая нестабильность, причина которой - в отсутствии или недостатке остеоинтеграции имплантата в организме реципиента [3; 5; 6].
Экспериментальные работы по изучению различных покрытий имплантатов с целью выявления их оптимальной остеоинтеграции в организмах животных дают обнадёживающие результаты. Вместе с тем их внедрение в практическое здравоохранение далеко до своего завершения. На сегодняшний день трудно подобрать идеальные материалы для создания таких покрытий.
По данным многих авторов, наибольшим сродством к костной ткани обладают кальций-фосфатные соединения (КФС) [1; 3; 7; 9]. Продолжаются исследования по улучшению их связей с живой костью. Было показано улучшение характеристик КФС при добавлении в их состав органических (хитозан) [9] и неорганических (кремний) «легирующих» компонентов. Определённый интерес представляет изучение влияния неорганического германия в составе кальций-фосфатных покрытий имплантатов на происходящие вокруг них процессы остеогенеза в условиях эксперимента [8].
Цель исследования
Оценить в условиях эксперимента гистологическую картину взаимодействия композиционного материала из фосфата кальция и германия с костной тканью.
Материал и методы исследования
Для экспериментального исследования ЗАО «ТРЕК – Э Композит» (г. Москва) были изготовлены 4 группы штифтов круглого сечения диаметром 4 мм и длиной 20 мм (рис. 1).

Рис. 1. Общий вид четырёх групп штифтов (пояснения в тексте)
Первая группа штифтов (контрольная) - из медицинской стали, вторая (контрольная) - из титанового сплава ВТ6 с модифицированной методом химико-термической обработки (ХТО) поверхностью. В результате ХТО на поверхности изделия образуется нанослой из карбоксинитрида титана с повышенной твёрдостью [8]. Третья группа штифтов (опытная) – из титанового сплава ВТ6, покрытых кальция фосфатом и 1%-ным германием. Последний нанесён методом микродугового оксидирования. Четвёртая группа штифтов (опытная) аналогична третьей, только в составе покрытия содержалось 5% германия. В эксперименте использовали 29 беспородных кошек мужского пола массой от 2500 до 3400 г в возрасте от 1,5 до 4 лет. Это обусловлено характером движения их в пространстве (в отличие от кроликов, которые перемещаются прыжками), формой бедренной кости, схожей с человеческой (у кроликов – саблевидная), достаточными размерами костей и выживаемостью животных при одновременных вмешательствах на двух задних конечностях. Содержание и уход проводили согласно требованиям «Европейской конвенции по защите позвоночных животных, используемых для экспериментальных и других научных целей», рекомендациям по кормлению и содержанию лабораторных животных, а также Приказу Минздрава СССР от 12.08.1977 № 755 и «Всемирной декларации прав животных» («Universal Declaration of Animal Rights», принятой Международной лигой прав животных 23 сентября 1977 года в Лондоне и объявленной 15 октября 1978 года в штабе ЮНЕСКО в г. Париже) [2; 10]. Операции выполняли под внутримышечным наркозом золетилом в дозе 15 мг/кг с премедикацией атропина сульфатом в дозе 0,04 мг/кг подкожно и 0,2%-ным раствором рометара в дозе 0,1 мл/100 г массы тела. Разрез кожи и подлежащих тканей проводили по наружной поверхности в верхней трети тазовой конечности. Обнажали межвертельную ямку, отсюда сверлом диаметром 4 мм формировали канал в дистальном направлении бедренной кости на протяжении 20 мм. В этот канал специальным импактором устанавливали штифт. На противоположной конечности проводили аналогичное вмешательство. Раны послойно ушивали. Животных выводили из опыта через 3 месяца с соблюдением правил биомедицинской и ветеринарной этики. Под в/м наркозом золетилом в дозе 15 мг/кг в нижнюю полую вену вводили 20 мл 10%-ного раствора магнезии. После остановки сердечной и дыхательной деятельности изымали кости и готовили макропрепараты, которые фиксировали в 10%-ном растворе формалина. Для морфологического изучения зоны имплантации штифтов из проксимальных отделов бедренных костей приготовили 46 поперечных пластинок толщиной 5 мм. Их на 3 недели помещали в 4%-ный раствор азотной кислоты при температуре воздуха +18-22 °С. Обезвоживание проводили спиртами возрастающей концентрации, заливали материал парафином, нарезали микротомом. Гистологические срезы толщиной 7-10 мкм окрашивали гематоксилином и эозином. Световую микроскопию проводили на микроскопах «Karl Zeiss» (Jena, Germany) и «БИОЛАМ» (ОАО «ЛОМО», Россия) с различным увеличением. Наиболее демонстративные участки фотографировали.
Результаты и обсуждение
В первой группе наблюдений (штифты из медицинской стали) внутренняя поверхность трубчатой кости содержала небольшое количество разрушенных балок. Часть остеоцитов в прилежащей костной ткани некротизирована. Имеются очажки умеренной пролиферации остеогенных клеток, находящихся между сохранившимися участками зрелой костной ткани. Местами происходит формирование молодой костной ткани (рис. 2). На поверхности костного канала находятся единичные гемосидеробласты, указывающие на имевшиеся ранее кровоизлияния.

Рис. 2. Формирование молодой костной ткани. Окраска гематоксилином и эозином, х150
Во второй группе наблюдений (карбоксинитрид титана) материал представлен фрагментами трубчатой кости с участками активного костного мозга. Внутренняя поверхность трубчатой кости ровная, с очагами небольшого количества молодых остеоцитов (рис. 3). Гаверсовы системы на внутренней трети кости отсутствуют; в наружном отделе сформированы типичные гаверсовы системы. Имеется некроз некоторых систем, часть костных лакун запустевшая, что указывает на гибель отдельных клеток. Данный процесс представляет собой, очевидно, проявление структурной перестройки костной ткани. Местами внутренняя поверхность кости слоистая из-за напластования молодой ткани, что отражает, по-видимому, процесс активного формирования костной ткани. Остеоциты внутренней части костной трубки располагаются по-разному: местами хаотично, местами параллельно, упорядоченными рядами.

Рис. 3. Ровная внутренняя поверхность трубчатой кости с очагами небольшого количества молодых остеоцитов (показано стрелкой). Окраска гематоксилином и эозином, х150
В третьей группе (кальция фосфат и германий 1%) фрагменты трубчатой кости характеризуются рядом морфологических изменений. В некоторых наблюдениях внутренняя поверхность кости покрыта тонким слоем мелкозернистой инородной базофильной массы (рис. 4). Там же располагаются молодые костные балки, характеризующиеся беспорядочным расположением остеоцитов. Указанные балки, смыкаясь, формируют гаверсовы системы, на внутренней поверхности которых находится отмеченная выше инородная масса. Данный феномен можно трактовать как показатель включения материала в регенерирующую костную ткань. Тут же имеются небольшие скопления остеобластов и остеокластов, что свидетельствует как о новообразовании костной ткани, так и о резорбции её. Всё это указывает на происходящую перестройку костной ткани в соответствии с функцией органа. Наружная часть трубчатой кости представляет собой зрелую костную ткань с концентрически ориентированными гаверсовыми системами.
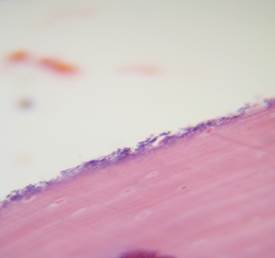
Рис. 4. Внутренняя поверхность кости, покрытая тонким слоем мелкозернистой инородной базофильной массы. Окраска гематоксилином и эозином, х150
В 4-й группе наблюдений (кальция фосфат и германий 5%) на внутренней поверхности трубчатой кости имеются более массивные наложения крупнозернистой полупрозрачной инородной массы. Под этой массой располагается неравномерный слой остеогенных клеток. Местами располагаются очажки пролиферации этих клеток. Поверхность формирующихся костных балок покрыта указанной массой. Остеоциты балок расположены беспорядочно, что указывает на их продолжающийся рост. Местами отмечено врастание остеобластов в данную массу, что свидетельствует о начале формирования костных балок (рис. 5). Следовательно, напыление не препятствует регенерации костной ткани, но и активизирует этот процесс. В частичках костного мозга встречаются маленькие фрагменты указанной инородной массы. Клетки костного мозга, контактирующие с частичками напыления, не имеют признаков деструкции. На внутренней поверхности костной трубки находятся фрагменты разрушенных балок, что может свидетельствовать о тесном соединении балок с напылением штифта и о разрушении последних при его извлечении.

Рис. 5. Врастание остеобластов молодой костной балки в мелкозернистую инородную базофильную массу (указано стрелками). Окраска гематоксилином и эозином, х280
Заключение
Таким образом, проведённые эксперименты показывают, что процессы образования костной ткани и остеоинтеграции преобладают в группе имплантатов, покрытых кальция фосфатом и германием. Повышение концентрации германия в составе композитного покрытия стимулирует данные процессы.
Библиографическая ссылка
Кузьманин С.А., Назаров Е.А., Папков В.Г. МОРФОЛОГИЧЕСКАЯ КАРТИНА ВЗАИМОДЕЙСТВИЯ КОМПОЗИЦИОННОГО МАТЕРИАЛА ИЗ ФОСФАТА КАЛЬЦИЯ И ГЕРМАНИЯ С КОСТНОЙ ТКАНЬЮ В ЭКСПЕРИМЕНТЕ // Современные проблемы науки и образования. 2016. № 3. ;URL: https://science-education.ru/ru/article/view?id=24456 (дата обращения: 16.01.2026).



