ВВЕДЕНИЕ
Несмотря на высокий уровень развития цивилизации, бремя травматизма остается неразрешенной проблемой, которая продолжает привлекать пристальное внимание клиницистов и исследователей, приводит к большим потерям даже в экономически благополучных странах, и входит в первую тройку ведущих причин смерти [1]. Частота алкогольного опьянения у лиц, пострадавших в дорожно-транспортных происшествиях (при смертельном и несмертельном травматизме), достигает 30–40 %. Алкогольное опьянение, в котором нередко находятся пациенты, значительно утяжеляет их состояние, затрудняет диагностику и оказание неотложной помощи на догоспитальном этапе. Алкогольная интоксикация изменяет клиническую картину травмы. Изучение патогенетических особенностей при сочетанной травме в сочетании с алкоголизацией показало, что больные в состоянии алкогольного опьянения должны рассматриваться как группа повышенного риска, поскольку их компенсаторные механизмы ослаблены [9,10]. Терапевтическая тактика в отношении травмированных пациентов с алкогольными проблемами имеет свои особенности. Однако не всегда можно получить достоверную информацию о наличии алкогольных проблем у пациента. При тяжелых сочетанных травмах зачастую невозможно определить донозологическое состояние пострадавшего, и ориентироваться приходится на косвенные признаки. Поиск информативных методов диагностики остается актуальной задачей.
Алкогольная интоксикация, предшествующая травме, вызывает метаболические нарушения, токсическое поражение печени, которые утяжеляют прогноз. Одним из механизмов неудовлетворительных репаративных процессов при хронической алкогольной интоксикации может явиться усиление процессов апоптоза.
Апоптоз – форма запрограммированной клеточной гибели. Термин «апоптоз» взят из греческого языка (apoproёgmena), этим словом называли «то, что должно быть отвергнуто в споре», или «листья, опадающие с деревьев осенью» [11]. Годом признания апоптоза как физиологического явления считается 1972 год, когда английские исследователи Kerr, Wyllie, Currie представили убедительные морфологические доказательства существования этого явления [3]. Биологический смысл апоптоза заключается в том, что это активный, генетически регулируемый процесс, участвующий в дифференцировке, морфогенезе, поддержании клеточного гомеостаза, защите от патологических процессов [21]. Это необходимый компонент жизнедеятельности организма, который включает элиминацию клеток с повреждённым геномом.
В настоящее время используются два определения апоптоза: морфологическое, в котором подразумевается апоптоз как форма клеточной гибели, проявляющаяся в её уменьшении, в фрагментации и конденсации хроматина и в уплотнении цитоплазматической мембраны, без выхода содержимого в межклеточное пространство; и биохимическое определение, при котором апоптоз – это программируемая клеточная смерть в результате реализации генетической программы или ответа на внешние факторы, требующая энергетических затрат и синтеза новых макромолекул [6]. В настоящее время под апоптозом принято понимать каспазозависимый процесс упорядоченной гибели отдельных клеток, который происходит в нормальных и патологически измененных органах и тканях организма под действием внеклеточных или внутриклеточных стимулов [8].
В современной классификации программированной смерти клеток (ПСК) выделяют ПСК I типа – апоптоз, II типа – аутофагию и III типа – некроз клетки (онкоз) [6]. Принципиальное различие между апоптозом и некрозом заключается в различных последствиях этих процессов для окружающих тканей и всего организма. Апоптоз завершается фагоцитозом апоптотических телец макрофагами или стромальными клетками, не происходит явлений альтерации, воспаления или иммунного ответа, тогда как при некрозе наблюдаются все эти процессы, развивается полноценный иммунный ответ [2].
Программа апоптотической гибели клетки проходит несколько этапов:
- индукция,
- активация про-апоптотических белков,
- активация каскада белковых комплексов – каспаз, расщепляющих белки-мишени,
- морфологическая перестройка внутриклеточных органелл.
- фрагментация клетки с образованием апоптотических телец,
- фагоцитоз макрофагами или стромальными клетками [5,6].
При каспазном механизме клеточной гибели происходит следующее. Активируются инициаторные, затем – эффекторные каспазы. Последние и активированные ими ферменты (эндонуклеазы) разрушают компоненты клетки, фрагментируют ДНК, в результате хроматин скапливается по периферии ядра, распадается цитоскелет, митохондрии, аппарат Гольджи, эндоплазматический ретикулум. При некаспазном механизме клеточной гибели из митохондрий выходят флавопротеин AIF и эндонуклеаза G, мигрируют в ядро и вызывают распад ядерной ДНК на олигонуклеотиды. Наблюдается конденсация хроматина и экспозиция фосфатидилсерина во внешнем монослое плазматической мембраны. Конечный этап – фрагментация ядра, клетки и образование апоптотических телец [6,7].
Стандартного метода выявления апоптоза не существует. Используются следующие методы морфологической верификации в комплексе:
- рутинная микроскопия с использованием обычных методов фиксации и окрашивания;
- флуоресцентно-микроскопическое исследование;
- электронная микроскопия;
- выявление олигонуклеосомной деградации ДНК в отдельных клетках.
Метод электронной микроскопии является наиболее точным, однако из-за необходимости идентификации процесса апоптоза в отдельных клетках он является слишком затратным для массового применения. Кроме того, по оценкам, отдельные стадии программируемой клеточной гибели длятся не более 1–1,5 часов, что также затрудняет их выявление.
Формально наиболее вероятным критерием апоптоза является наличие каспазозависимой олигонуклеосомной деградации хроматина при сохранении целостности мембранных структур клеток [2,3], но практически это можно выявить лишь в специально оснащённых лабораториях.
Апоптоз не является специфической реакцией на какие-то определённые патологические процессы. Так, согласно исследованиям E.Mutijima и др. (2014), при морфологическом исследовании операционного материала шейки бедра TUNEL-методом апоптотические остеоциты и остеобласты выявляется одинаково часто как при остеоартритах, так и при переломах, алкоголь-индуцированных или идиопатических остеонекрозах, в целом, независимо от этиологического фактора [23].
Хотя апоптоз и является нормальным саногенетическим процессом, в некоторых случаях тяжелого повреждения он носит характер патологического и усугубляет состояние пострадавшего [15,16,17].
При черепно-мозговой травме (ЧМТ) повреждение ткани головного мозга и экстрацеребральные нарушения вызывают метаболические сдвиги и запускают патологические процессы, приводящие к гибели нервных клеток через механизм некроза и апоптоза. При некрозе происходит разрушение мембраны и внутриклеточных структур лизосомальными ферментами и массовая гибель клеток. Активируется система цитокинов, происходит повреждение соседних клеток, включается иммунный ответ. Повреждённые очаги хорошо определяются с помощью рутинных способов визуализации. Проявления апоптоза не столь очевидны и более отсрочены по времени от момента травмы, чем некроз. Для активации механизма апоптоза при ЧМТ необходимо образование ложных нейромедиаторов и нейротоксичных аминокислот. Предположительно считается, что степень активации нейротоксического каскада пропорциональна тяжести повреждения мозга, а непосредственным повреждающим фактором является гипоксия [12]. Активация каспаз при апоптозе приводит к постепенной гибели нейрона, сморщиванию клетки и выпадению её функции. Поскольку гибнут отдельные клетки, а соседние с ними нейроны не страдают, и при этом не развивается системной реакции воспаления, определить объёмы апоптотически погибших нервных клеток клиническими методами визуализации невозможно. Вместе с тем, установлены общие антигенные детерминанты белков мозга и тимуса человека [7,8], т.е., если по картине периферичекой крови можно судить о состоянии тимуса и иммунной системы, то по этим же показателям можно получить представление о состоянии мозговой ткани.
Не только гипоксия тканей головного мозга действует повреждающе, но и избыток кислорода, что вызывает активацию перекисного окисления и повреждение белков и липидов клеточной мембраны. Для нейтрализации этих процессов предложено использовать препараты с антиоксидантной активностью, например, производные янтарной кислоты, которые, кстати, широко применяются в комплексной терапии алкоголизма. Однако их клиническая эффективность в настоящее время не является строго доказанной [12]. Некоторые авторы рассматривают этанол в качестве нейропротективного агента при инсульте или ЧМТ. Так, в недавнем исследовании американских учёных, проведённом на крысах, было показано, что введение этанола в небольшой дозе после инсульта предупреждает развитие обширных повреждений головного мозга. Введение этанола в дозе 1,5 г/кг массы тела животного в срок до 4 часов после двухчасовой окклюзии средней мозговой артерии оказывает сильное нейропротективное действие, повышает экспрессию гипоксия-индуцированного фактора 1α и предупреждает внутримозговое кровоизлияние после использования тромболитиков [14, 24]. В другом исследовании, проведённом в Турции, изучено влияние умеренных доз алкоголя на цистеин-протеаза-индуцированный апоптоз нейронов и образование оксида азота в тканях мозга при повреждении. В группе крыс, получивших этанол и травму мозга, уровень активности ферментов каспазы-3 и катепсина-L оказался ниже, чем у крыс, получивших только травму. Авторы объясняют это способностью этанола подавлять активность лизосомальных протеаз и продукцию оксида азота [17].
Однако использование этанола в качестве нейропротектора представляется чрезвычайно спорным шагом. Хроническое употребление алкоголя увеличивает риск развития острого респираторного дистресс-синдрома, тяжелой формы острого повреждения легких, которое характеризуется поражением альвеолярного эпителия и эндотелиального барьера и развитием интенсивного воспаления. Злоупотребление алкоголем ассоциировано с большей частотой развития сепсиса или пневмонии, увеличением времени пребывания в стационаре, медицинских расходов и более высокой смертностью [9,18].
Нейродегенеративное действие алкоголя доказано во множестве исследований. Этанол-индуцированные повреждения лежат в основе многих расстройств алкогольного спектра. По мнению Luo J. (2012), этанол не подавляет, а индуцирует апоптоз [20]. Схематически это показано на рисунке.
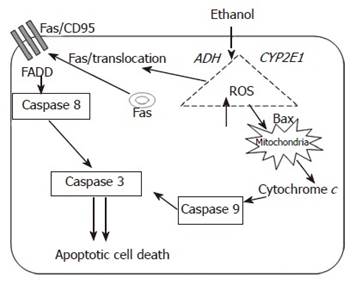
Схема инициации и распространения этанол-индуцированного апоптоза
Метаболизм этанола и сопутствующая генерация активных форм кислорода активируют про-апоптотические механизмы через рецептор смерти Fas/CD95 и внутренние механизмы апоптоза [22].
Другие исследования показали, что употребление алкоголя перед ожоговой травмой ослабляет иммунную защиту и повышает вероятность развития инфекционных осложнений. В тканях селезёнки у получивших алкоголь мышей уменьшалось образование интерлейкина-2 и снижалась продукция Т-лимфоцитов, по сравнению с также травмированными мышами, не получавшими алкоголь [15].
Основными физиологическими регуляторами клеточной гибели являются глюкокортикоиды. Дегидроэпиандростерон (ДГЭА) и его конъюгированная форма ДГЭА-сульфат (ДГЭАС) является ключевым звеном в биосинтезе всех стероидных гормонов и обладает собственными эффектами. Этот нейростероид оказывает нейропротективное и стресспротективное действие, защищая организм от пагубного воздействия высоких доз кортизола [11]. Нейростероиды обладают многими эффектами в ЦНС и могут быть вовлечены в патофизиологические процессы при травме, а также при алкоголизме. Оценка соотношения концентраций ДГЭА и кортизола характеризует состояние анаболических и катаболических процессов, т.е. стресслимитирующих и стрессреализующих систем, что можно использовать в прогнозе реабилитационного процесса.
Применение кортикостероидов при ЧМТ для лечения и предупреждения отека мозга теоретически должно приводить к стабилизации мембраны нервной клетки, предупреждению отёка и гибели клетки, а также к подавлению избыточной активации воспалительных цитокинов, развивающейся вследствие некроза тканей. Большие дозы кортикостероидов эффективно уменьшают сосудистый отек вокруг очагов повреждения. В крупном проспективном исследовании сверхраннего применения кортикостероидов при ЧМТ (CRASH trial colloborators, 2004, n>10000) показано, что отрицательные эффекты кортикостероидов, в случаях, когда они, возможно, были показаны, превышали предполагаемую пользу. Результаты лечения были хуже, а летальность – выше в группах, получавших метилпреднизолон. В исследование не включались те случаи, когда кортикостероиды были определённо показаны или определённо не показаны. В клинической практике их можно использовать для экстренного повышения церебрального перфузионного давления вместе с симпатомиметиками и инфузионной терапией [12].
Несмотря на то, что считается доказанным участие апоптоза в развитии отсроченной гибели нейронов головного мозга после травматического повреждения, вопрос о биологической роли этого процесса остается открытым. Пока до конца не известно, является ли программируемая гибель клетки исключительно вредным процессом или же устранение нефункционирующих клеток, находящихся в состоянии парабиоза, является приспособительной реакцией, направленной на усиление выживаемости, когда в условиях ЧМТ повышено внутричерепное давление, нарушена микро- и макроциркуляция, увеличена проницаемость гематоэнцефалического барьера. Безусловно, продолжение исследований данной проблемы обосновано и актуально.
Что касается апоптотических процессов в нейтрофилах человека с тяжелой скелетной и черепно-мозговой травмой, то на основании их учета можно сделать заключение, как минимум, о стадии иммунного дистресс-синдрома при критических состояниях [5].
Целью данного исследования было изучение признаков апоптоза нейтрофилов у пострадавших с сочетанными черепно-мозговыми и скелетными травмами (СЧМСТ) и гормональной регуляции, для возможного использования этих показателей в прогнозе состояния потерпевшего.
Материал и методы исследования. Обследованы пострадавшие с СЧМСТ, всего 58 чел., из них 30 чел. – в состоянии алкогольной интоксикации и с признаками хронического алкоголизма (1 группа), и 28 чел. – без признаков алкоголизма и алкогольной интоксикации (2 группа). Все пациенты были мужского пола, возраст от 31 до 57 лет, в среднем 41,52±1,25 года. У всех пострадавших состояние было квалифицировано как средней степени тяжести. Забор крови проводился при поступлении пациентов в клинику, до оперативного или консервативного лечения и до назначения фармакотерапии. В качестве контрольной группы использовались образцы крови 22 соматически и психически здоровых лиц, соответствующие по полу и возрасту обследуемой группе пациентов, не имеющих хронических заболеваний и не состоящих на диспансерном учете, без признаков перенесенных острых инфекционных заболеваний на момент обследования.
Для оценки апоптоза использовали световую микроскопию, поскольку результаты морфологического анализа хорошо коррелируют с данными других методов оценки апоптоза [3]. Посредством световой микроскопии окрашенных мазков из кондиционированной венозной крови определяли уровень апоптотических и некротически измененных нейтрофилов.
Определение коммитированных к апоптозу (Апо) и некротически измененных нейтрофилов (Нф) производили путем световой микроскопии в тонких мазках венозной крови, окрашенных по Романовскому – Гимзе после предварительного кондиционирования венозной крови по методике, разработанной А. В. Седых [4]. На увеличении × 1000 просматривали тысячу клеток и учитывали (в ‰) измененные Нф, которые дифференцировали по характерным морфологическим признакам: апоптозные – по уменьшению размеров, по конденсированной цитоплазме, по уплотненному бесструктурному хроматину, часто разделенному на несколько округлых телец; некротические – по разрыву цитоплазматической и внутриклеточных мембран, по разрушению органелл, по выходу содержимого цитоплазмы в межклеточное пространство [4, 16]. Исследование проводили в первые сутки после поступления пациента. Определяли количество лейкоцитов, формулу крови и проводили анализ апоптотических форм клеток периферической крови. Вычисляли отношение некротически измененных циркулирующих Нф к апоптозным. Оценка иммунного статуса включала определение относительного и абсолютного содержания различных субпопуляций лимфоцитов методом проточной цитофлюориметрии (FACScan, Becton Dickinson) с помощью моноклональных антител (ТОО «Сорбент», Москва). Кроме того, определяли степень ингибирования экспрессии рецепторов апоптоза (СД95) [14]. Оценку содержания клеток с маркером апоптоза проводили непрямым иммунофлюоресцентным методом с использованием моноклональных антител к антигену CD95 (ТОО «Сорбент», Москва).
Результаты и их обсуждение
Для лимфоцитов с признаками апоптоза характерны деградация ядерного материала и фрагментация хроматина на несколько частей. Уровень спонтанного апоптоза лимфоцитов в мазках, приготовленных сразу после взятия крови, у травмированных лиц с признаками алкоголизма (1 гр.) достоверно отличался от значений, наблюдаемых у травмированных без признаков алкоголизма (2 гр.).
Цитологический анализ мазков крови показал, что у лиц 1 группы уровень спонтанного апоптоза лимфоцитов составляет 5,6±0,7 % (в контрольной группе здоровых лиц 0,9±0,2 %, у лиц 2 группы 2,4±0,4 %, p<0,001). Индекс реализации апоптоза лимфоцитов, т.е. доля клеток с морфологическими признаками апоптоза в процентах от общего числа клеток, экспрессирующих рецепторы готовности к апоптозу у больных алкоголизмом, достоверно выше нормы (16,8±2,4 %, в контроле – 7,7±1,6 %, p>0,05). У лиц 1 группы выявлено повышение экспрессии рецептора CD95 (16,9±0,3 %, во 2 гр. – 11,6±0,3 %, p<0,05).
Показатели концентрации кортизола и ДГЭАС представлены в табл. 1, 2.
Таблица 1
Показатели концентрации гормонов: кортизола и дегидроэпиандростерона-сульфата (ДГЭАС) в трех группах испытуемых (у здоровых лиц, у травмированных больных алкоголизмом и у травмированных лиц без признаков алкоголизма) (M±m)
|
Показатель |
Здоровые лица N = 22 чел. |
Больные с СЧМСТ+А N = 30 чел. |
Больные СЧМСТ N = 28 чел. |
|
Кортизол (нмоль/л) |
315,0±25,4 |
669,2±30,9* |
489,6±35,9 |
|
ДГЭАС (мкг/мл) |
2,2±0,4 |
3,4±0,6 |
2,9±0,5 |
|
ДГЭАС/кортизол |
0,69±0,06 |
0,51±0,03* |
0,59±0,06 |
Примечание:* – р<0,05 по сравнению со здоровыми лицами.
Таблица 2
Корреляционная матрица биологических показателей пострадавших с сочетанной черепно-мозговой и скелетной травмой в сочетании с алкоголизмом
|
Кортизол |
ДГЭАС |
CD95 |
|
|
Кортизол |
1,00 |
0,10 |
0,74* |
|
ДГЭАС |
0,10 |
1,00 |
0,48 |
|
CD95 |
0,74* |
0,48 |
1,00 |
Примечание: * – достоверность уровня различия p<0,05 при значениях коэффициента корреляции r = 0,5-1,0.
У больных СЧМСТ+А выявлено достоверное по сравнению со здоровыми лицами усиление экспрессии рецептора CD95 и статистически значимое увеличение содержания лимфоцитов и нейтрофилов с морфологическими признаками апоптоза, что с большой долей вероятности свидетельствует об усилении процессов апоптоза в мозговой ткани. У больных СЧМСТ+А выявлено статистически значимое повышение концентрации кортизола по сравнению с контрольной группой, что свидетельствует о более выраженном уровне стресса, несмотря на седативный эффект этанола. Выявлены корреляции экспрессии маркера апоптоза с концентрацией кортизола при алкоголизме, что указывает на апоптоз-индуцирующий эффект кортизола. Уровень ДГЭАС достоверно не отличается, а соотношение ДГЭАС/кортизол статистически значимо снижено по сравнению со значениями в группе здоровых лиц, что указывает на снижение протективного эффекта ДГЭА, на дисбаланс про- и антиапоптотических регуляторов. Эти данные показывают большую стрессированность лиц с алкогольными проблемами, меньшую «защиту» с помощью ДГЭАС, соответственно, усиление апоптоза, и объясняют длительность реабилитации у травмированных больных алкоголизмом, а также развитие нозокомиальной пневмонии и более тяжелое ее течение.
Выявленные корреляции экспрессии маркера апоптоза CD95 с концентрацией кортизола при алкоголизме, что свидетельствует о тесной связи механизмов апоптоза с гормонально-метаболическими изменениями/нарушениями, сопутствующими хроническому алкогольному потреблению, и участии кортизола в регуляции экспрессии маркера апоптоза на иммунокомпетентных клетках.
Выводы
1. Диагностика общесоматического состояния пациента с тяжелой сочетанной травмой представляет проблему для травматологии и медицины катастроф. В частности, имеет большое значение для прогноза реабилитации предшествующее хроническое потребление алкоголя. Обзор научных исследований свидетельствует, что анализ проявлений апоптоза иммунокомпетентных клеток периферической крови может являться диагностическим маркером, указывающим на предшествующую алкоголизацию пациента.
2. У пациентов с сочетанной черепно-мозговой и скелетной травмой с алкогольными проблемами в анамнезе выявлены достоверное по сравнению с лицами контрольных групп усиление экспрессии рецептора CD95 и статистически значимое повышение количества лимфоцитов с морфологическими признаками фрагментации ядра.
2. Усиление процессов апоптоза лимфоцитов периферической крови у пациентов с сочетанной черепно-мозговой и скелетной травмой с алкогольными проблемами в анамнезе объясняет снижение устойчивости их иммунной системы по отношению к инфекциям и большую склонность к нозокомиальной пневмонии. Можно предвидеть более тяжелое течение нозокомиальной пневмонии при сопутствующей алкогольной отягощенности.
3. Снижение соотношения ДГЭАС/кортизол у травмированных лиц с алкоголизмом в анамнезе, характеризующее анаболическо-катаболический баланс, свидетельствует об истощении анаболических возможностей организма и может являться неблагоприятным прогностическим признаком в отношении репаративных процессов.
Библиографическая ссылка
Фирсов С.А., Матвеев Р.П., Синкевич Д.И., Верещагин Н.А. ПРОЯВЛЕНИЯ АПОПТОЗА У ПОСТРАДАВШИХ С СОЧЕТАННОЙ ЧЕРЕПНО-МОЗГОВОЙ И СКЕЛЕТНОЙ ТРАВМОЙ ПРИ НАЛИЧИИ АЛКОГОЛЬНЫХ ПРОБЛЕМ В АНАМНЕЗЕ // Современные проблемы науки и образования. 2016. № 2. ;URL: https://science-education.ru/ru/article/view?id=24295 (дата обращения: 20.02.2026).



