В настоящее время острые респираторные заболевания, в первую очередь вирусные инфекции, являются «бичом» педиатрии, а аллергия на бактериальные антигены и вирусы представляет собой не редкое явление [1, 8]. Понятие часто болеющий респираторными заболеваниями ребенок широко распространено. Все это позволяет считать актуальным параллельное обследование детей, уже больных бронхиальной астмой (БА) и часто болеющих детей (ЧБД) в аспекте изучения иммунопатологических механизмов возникновения бронхиальной астмы у часто болеющих детей.
Известно, что о нарушениях механизмов защиты организма в значительной мере свидетельствует бессимптомное носительство условно-патогенной и патогенной флоры, выступающее в качестве маркера вторичной иммунной недостаточности. Одним из важнейших показателей состояния механизмов локальной защиты верхних дыхательных путей (ВДП) является их колонизационная резистентность, которая зависит от характеристик нормофлоры биотопа и состояния неспецифической резистентности организма [4, 12]. Развивающиеся при этом негативные изменения состояния эубиоза и нарушения иммунного статуса приводят к сдвигам в эндоэкологии макроорганизма, являясь базисом для формирования целого ряда донозологических изменений, которые со временем могут трансформироваться в клинически выраженную патологию, что, как правило, и наблюдается у детей с БА и у контингентов ЧБД [6]. Однако эти вопросы остаются недостаточно изученными, в доступной литературе практически отсутствуют данные о цитологических и микробиологических характеристиках отделяемого носоглотки у таких детей, не описана динамика показателей состояния слизистой оболочки ВДП в процессе лечения, в том числе с применением иммунотропных лекарственных средств.
Цель работы – изучение динамики клеточного состава и микробиологических показателей слизистой оболочки носоглотки в ходе лечения часто болеющих детей и детей с бронхиальной астмой.
Материалы и методы лечения. На базе … отделения (лечебного учреждения)… проведено обследование 215 детей, которые были разделены на 3 группы:
- 58 здоровых детей (1 группа – контрольная);
- 74 ребенка (группа 2) – часто болеющие дети;
- 83 ребенка (группа 3) – дети с бронхиальной астмой.
Распределение пациентов по возрасту, полу, средней длительности заболевания приведено в табл.1.
Таблица 1
Распределение пациентов по возрасту и полу и длительности заболевания
|
Параметр |
Группа 1 (контрольная) (n=58) |
Группа 2 (часто болеющие дети) (n=74) |
Группа 3 (дети с бронхиальной астмой) (n=83) |
|
|
Возраст |
13,9±2,1 |
13,7±1,8 |
12,8±2,6 |
|
|
Пол |
Мальчики |
30 (51,7 %) |
39 (52,8 %) |
45 (54,2 %) |
|
Девочки |
28 (48,3%) |
35 (41,3%) |
38 (45,8 %) |
|
|
Длительность заболевания (лет) |
- |
9,9±2,1 |
5,7±3,5 |
|
У детей, включенных в исследование, было выполнено клиническое обследование больных с оценкой общего состояния, уровня контроля БА по АСТ в зависимости от степени тяжести заболевания и лабораторные исследования.
Все пациенты были опрошены с помощью теста контроля астмы – Asthma Control Test (АСТ). АСТ был разработан в 2002 году компанией Quality Metric Incorporated, в 2003 г. представлен на Международном конгрессе по аллергологии и иммунологии, а в 2004 г. появилась валидизированная русскоязычная версия [1].
Оценивали цитологическую картину отделяемого слизистой оболочки носоглотки у обследуемых детей – процентное содержание нейтрофилов и эозинофилов в мазках. Исследование проводили до начала лечения, спустя 3 и 6 мес.
Также выполняли посевы мазков из слизистой носоглотки, оценивали состав микрофлоры у обследуемых детей – до лечения и через 3 месяца.
Лечение больных осуществляли в соответствии с консенсусом «Глобальная инициатива по бронхиальной астме, 2014 (GINA 2014) [5]. Базисная терапия вне обострения у детей с БА включала применение: монтелукаста (сингуляра) 10 мг/сутки – на ночь, или ингаляционно – интала по 2 вдоха 4 раза в день или пульмикорта турубхаллера 200–400 мкг в сутки или беклазон 200–500 мкг/сутки или серетид (тевакомб) сальметерол+флутказон в максимальной суточной дозе 100–250 мкг по флутиказону или симбикорт формотерол+будесонид в максимальной суточной дозе 160–320 по будесониду.
Базисную терапию дополняли иммунокорригирующей терапией препаратом рузам, который представляет собой по химической структуре липопротеин, полученный из термофильного микробного штамма S.aureus (С2) [7]. Рузам назначали больным по 10 инъекций 1 раз в 7 дней в разовой дозе 0,1–0,2 мл, подкожно.
Оценку клинической эффективности терапии осуществляли по частоте обострений БА и количеству случаев ОРВИ в течение года после проведенного лечения, лабораторные показатели оценивали до лечения и через 3 и 6 месяцев после его окончания.
Статистическую обработку данных проводили с помощью пакета программ STATISTICA 8.0. Для определения статистически значимых различий показателей в группах обследуемых пациентов U-критерий Манна – Уитни (тест Колмогорова – Смирнова показал, что распределение значений параметров существенно отличалось от нормального). При уровне p<0.05 результаты оценивались как статистически значимые.
Результаты. Оценка частоты различных жалоб у обследуемых детей показала, что у них выявлялись затруднение дыхания, одышка и удушье (в первую очередь у детей с БА). Частота кашля была выше у детей с БА и составила 74,7 %, тогда как в группе ЧБД – 58,1 %. Заложенность носа у больных группы 2 отмечалась в 40,5 % случаев, тогда как у детей с БА – в 31,3 % случаях. Свистящее дыхание выявлялось только у детей с БА, частота этого признака составила 28,9 %.
Анализ цитологической картины отделяемого слизистой оболочки носа у обследуемых детей показал, что доля нейтрофилов среди всех клеток у детей контрольной группы 1 составила 19,8±2,3 % (рис.1). У детей группы 2 (ЧБД) – значение этого показателя было несколько выше, но достоверно не отличалось от такового в контроле – 22,7±3,0 %. В то же время в группе 3 (дети с бронхиальной астмой) уровень этого показателя был максимальным и составил 35,3±4,6 %, значимо превышая (p<0,05) соответствующие значения в остальных группах.
Оценка количества эозинофилов также показала их минимальное значение у детей контрольной группы 1 - 7,3±1,1 %, в то время как в группах 2 и 3 уровни данного параметра было значимо выше (p<0,05), составив соответственно 15,5±2,8 и 26,4±5,1 %.
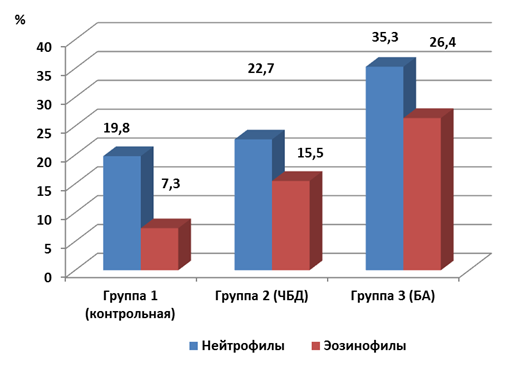
Рис.1. Цитологическая картина отделяемого слизистой оболочки носа у часто болеющих детей и детей с бронхиальной астмой (M±m)
Анализ микрофлоры, высеваемой со слизистых оболочек полости носа и зева у обследуемых детей, показал, что если у детей контрольной группы St. Aureus был выявлен только в 5,2 % случаях, то у часто болеющих детей и детей с БА значение этого показателя было выше более чем в 10 раз (p<0,05) и составило соответственно 51,4 и 60,2 % (табл. 2). Str. Pyogenes был обнаружен в контроле только в 8,6 % случаев, тогда как у детей групп 2 и 3 значительно чаще (p<0,05) – в 29,7 и 37,4 % случаях. Высеваемость Enterococcus faeс. составила у детей контрольной группы 14,3 %, в группе 2 (часто болеющие дети) – 21,6 %, в группе 3 (дети с бронхиальной астмой) – 19,3 %, при этом значимых различий выявлено не было.
Klebsiella pneum. была отмечена в 5,2 % случаях у детей контрольной группы, в группах 2 и 3 – несколько чаще – у 14,9 и 13,3 % детей (p>0,05). Candida albicans был выявлен лишь у 1 ребенка контрольной группы (3,5 %), тогда как в группе 2 (часто болеющие дети) – в 9,5 % случаях, а в группе 3 (дети с бронхиальной астмой) – у 10,8 % детей (p>0,05).
В целом частота выявления монофлоры составила у детей контрольной группы 1 25,9 %, в группе 2 (ЧБД) – 40,5 %. В группе 3 (БА) значение этого показателя было максимальным – 55,4 %, значимо превышающим (p<0,05) таковое в контроле.
Микстфлора редко отмечалась у детей контрольной группы – лишь в 12,1 % случаев, в то время как в группах 2 и 3 уровень этого показателя был в 3,5–5 раз выше (p<0,05) и составил соответственно 59,5 и 44,6 %.
Не было выявлено микрофлоры при посевах отделяемого слизистых оболочек полости носа и зева у большинства детей контрольной группы (62,1 %), тогда как в группах 2 и 3 – не было таких детей.
Таблица 2
Характеристика микрофлоры по результатам микробиологического исследования полости носа и зева у часто болеющих детей и детей с бронхиальной астмой (M±m)
|
Виды микроорганизмов |
Группа 1 (контрольная) (n=58) |
Группа 2 (часто болеющие дети) (n=74) |
Группа 3 (дети с бронхиальной астмой) (n=83) |
|||
|
Абс. |
% |
Абс. |
% |
Абс. |
% |
|
|
St. Aureus |
3 |
5,2 |
38 |
51,4* |
50 |
60,2* |
|
Str. Pyogenes |
5 |
8,6 |
22 |
29,7 |
31 |
37,4 |
|
Enterococcus faec. |
7 |
14,3 |
16 |
21,6 |
16 |
19,3 |
|
Klebsiella pneum. |
3 |
5,2 |
11 |
14,9 |
11 |
13,3 |
|
Candida albicans |
1 |
3,5 |
7 |
9,5 |
9 |
10,8 |
|
Монофлора |
15 |
25,9 |
30 |
40,5 |
46 |
55,4* |
|
Микстфлора |
7 |
12,1 |
44 |
59,5* |
37 |
44,6* |
|
Не выявлено |
36 |
62,1 |
- |
- |
- |
- |
Примечание:
* – различия достоверны (p<0,05) относительно соответствующих значений группы 1 по критерию χ2.
Оценка частоты жалоб больных БА после окончания лечения после начала лечения показала, что у этих детей уменьшилась частота затруднений дыхания, удушья и одышки – до 48,2 %, а спустя 3 мес. – до 26,5 %. В группе ЧБД в эти сроки таких жалоб отмечено не было. В обеих группах уменьшилась и частота кашля, соответственно до 40,5 % и 39,8 % в группах ЧБД и БА после проведенного лечения, спустя 3 мес. значения этих показателей продолжили тенденцию к снижению соответственно до 39,8 и 20,5 %. Заложенность носа была отмечена после окончания лечения у 25,7 % детей группы ЧБД и в 14,5 % случаях у детей с БА. Через 3 мес. эта жалоба была выявлена лишь у 10,8 % пациентов группы 2 (ЧБД) и в 4,8 % случаев в группе 3 (БА).
Сравнение количества обострений показало, что если до лечения у детей с бронхиальной астмой наблюдалось в среднем по 5,2 обострения в течение года, то после проведения курса терапии у этих больных значение данного показателя было почти в 2 раза ниже – 2,7 обострений в год (рис. 2).
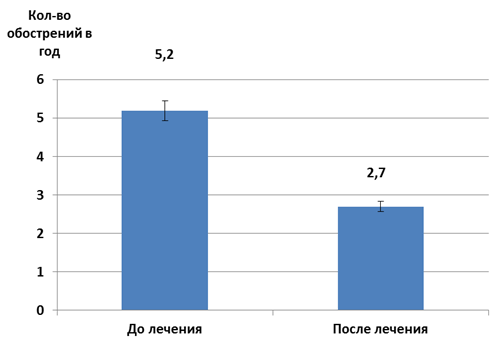
Рис. 2. Частота обострений бронхиальной астмы у обследуемых детей в течение года
Оценка частоты инфекционных заболеваний, в первую очередь ОРВИ, у часто болеющих детей свидетельствовала о том, что уровень этого показателя был значимо ниже (p<0,05) после проведенного лечения, чем до его начала (рис. 3).
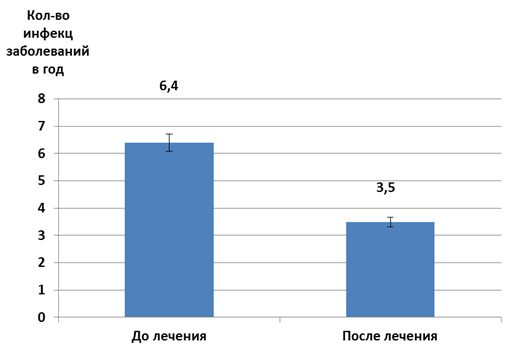
Рис. 3. Частота инфекционных заболеваний у обследуемых больных в течение года
Исследование динамики относительного количества нейтрофилов в отделяемом слизистой оболочки носа показало, что до лечения его значение в группе 2 (ЧБД) было значимо ниже (p<0,05), чем у детей с БА. После окончания лечения у часто болеющих детей значение этого показателя осталось практически на прежнем уровне и составило 21,4±2,6 %, а в группе детей с бронхиальной астмой снизилось до 30,2±3,4 %, при этом было значимо выше (p<0,05), чем во второй группе (рис. 4).
Через 3 мес. количество нейтрофилов у ЧБД повысилось, а у детей с БА несколько снизилось, значения этого показателя не различались и составили в группах 2 и 3 соответственно 26,2±3,1 и 28,5±2,8 %. Спустя 6 мес. от начала лечения уровень данного показателя уменьшился у детей обеих групп, соответственно в группе 2 (часто болеющие дети) – до 24,3±2,5 %, у детей с бронхиальной астмой – до 25,1±1,5 %, последнее значение было достоверно ниже исходного уровня в этой группе.
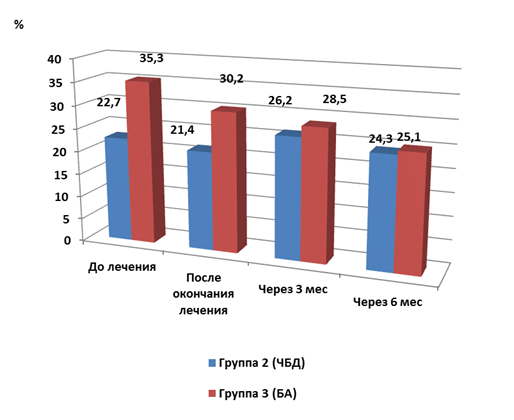
Рис. 4. Динамика содержания нейтрофилов в отделяемом слизистой оболочки носа у обследуемых детей после лечения (M±m)
Оценка количества эозинофилов в отделяемом слизистой оболочки носа обследуемых детей показала, что до лечения его значение в группе 2 (ЧБД) было значимо ниже (p<0,05), чем у детей с БА.
После окончания лечения было выявлено снижение этого показателя в обеих группах: у часто болеющих детей до 9,4±2,1 % (значимо ниже исходного, p<0,05), у детей с бронхиальной астмой до 21,3±4,8 % (рис. 5). Последнее значение было значимо выше (p<0,05), чем у детей группы 2 (ЧБД), но при этом достоверно не отличалось от исходного уровня.
Через 3 мес. было выявлено дальнейшее снижение относительного количества эозинофилов в отделяемом слизистой носа у детей обеих групп. Значения показателя в этот срок исследования были достоверно ниже (p<0,05) соответствующих исходных уровней: в группе 2 (ЧБД) – 7,8±1,8 %, в группе 3 (БА) – 15,8±3,2 %, при этом последнее значение было достоверно выше такового (p<0,05) во второй группе.
Спустя 6 мес. соотношения значений данного параметра были в целом сходными, изменились незначительно по сравнению с предыдущим сроком.
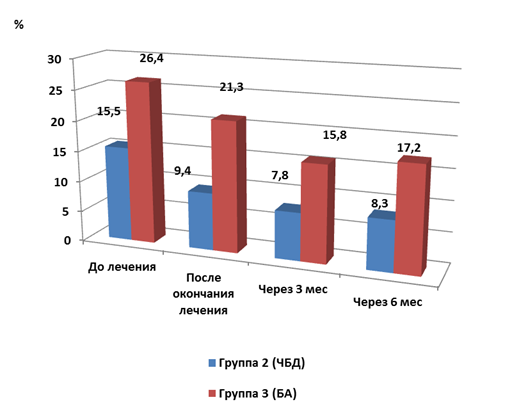
Рис. 5. Динамика содержания эозинофилов в отделяемом слизистой оболочки носа у обследуемых детей после лечения (M±m)
Оценка состояния слизистой оболочки полости носа и зева у часто болеющих детей и детей с бронхиальной астмой через 3 мес. после проведенного лечения была выполнена также по высеваемости различной микрофлоры. Было установлено снижение частоты высеваемости St. Aureus в группе 2 (часто болеющие дети) до 23,0 %, в группа 3 (дети с бронхиальной астмой) до 26,5 %, хотя значения этих показателей достоверно превышали соответствующий уровень в контрольной группе (табл. 3).
Высеваемость Str. Pyogenes составила у детей контрольной группы – 8,6 %, в группах 2 и 3 была выше, соответственно 16,2 % и 20,5 %, при этом значимых межгрупповых различий выявлено не было.
Высеваемость Enterococcus faeс. у детей контрольной группы была на уровне 14,3 %, в группах 2 и 3 не отличалась существенно от этого значения, составив соответственно 8,1 % и 10,8 %. Также не было выявлено значимых межгруповых различий по частоте обнаружения Klebsiella pneum.
Отмечены были единичные случаи обнаружения Candida albicans. В целом частота выявления монофлоры составила у детей контрольной группы 25,9 %, в группе 2 (часто болеющие дети) – 20,3 %, группа 3 (дети с бронхиальной астмой) была выше – 38,6 %, но значимых различий при этом выявлено не было. Оценка частоты выявления микстфлоры показала, что если в контроле значение этого показателя составило 12,1 %, то в группах 2 и 3 его значения по-прежнему были значимо выше (p<0,05), соответственно 32,4 % и 34,9 %. Соответственно в контрольной группе было значимо больше (p<0,05) у детей, у которых не было выявлено никакой микрофлоры – 62,1 %, тогда как в группах 2 и 3 значения этого показателя составили соответственно 47,3 и 25,5 %.
Таблица 3
Характеристика микрофлоры по результатам микробиологического исследования полости носа и зева у часто болеющих детей и детей с бронхиальной астмой через 3 мес. после проведенного лечения (M±m)
|
Виды микроорганизмов |
Группа 1 (контрольная) (n=58) |
Группа 2 (часто болеющие дети) (n=74) |
Группа 3 (дети с бронхиальной астмой) (n=83) |
|||
|
Абс. |
% |
Абс. |
% |
Абс. |
% |
|
|
St. Aureus |
3 |
5,2 |
17 |
23,0* |
22 |
26,5* |
|
Str. Pyogenes |
5 |
8,6 |
12 |
16,2 |
17 |
20,5 |
|
Enterococcus faec. |
7 |
14,3 |
6 |
8,1 |
9 |
10,8 |
|
Klebsiella pneum. |
3 |
5,2 |
3 |
4,1 |
5 |
6,0 |
|
Candida albicans |
1 |
3,5 |
1 |
1,4 |
2 |
2,4 |
|
Монофлора |
15 |
25,9 |
15 |
20,3 |
32 |
38,6 |
|
Микстфлора |
7 |
12,1 |
24 |
32,4* |
29 |
34,9* |
|
Не выявлено |
36 |
62,1 |
35 |
47,3 |
22 |
25,5* |
Примечание:
* – различия достоверны (p<0,05) относительно соответствующих значений группы 1 по критерию χ2.
Заключение. Известно, что ключевым звеном патогенеза БА является обратимая обструкция дыхательных путей, обусловленная хроническим воспалением и гиперреактивностью, которые возникают в результате контакта с провоцирующим агентом [3, 9, 10, 12]. К настоящему времени установлено, что изменения в организме больного БА в значительной мере обусловлены локальной аккумуляцией клеток воспаления, в первую очередь эозинофилов, а также гиперплазией бокаловидных клеток с преобладанием фенотипа, продуцирующего вязкий секрет [11, 13].
С этими положениями согласуются полученные данные, полученные в ходе нашего исследования. Так, у детей с БА выявлены повышенные уровни нейтрофилов и эозинофилов при анализе цитологической картины отделяемого слизистой оболочки носа. У часто болеющих детей значения этих показателей были увеличены в меньшей степени. Анализ микрофлоры слизистых оболочек полости носа и зева у обследуемых больных показал высокую частоту высеваемости St. Aureus, Str. Pyogenes и высокую общую частоту обнаружения микстфлоры у ЧБД и детей с БА.
Исследование динамики цитологических показателей показало значительное снижение частоты обнаружения эозинофилов в отделяемом слизистой оболочки носа обследуемых детей обеих групп и существенное снижение высеваемости различной микрофлоры.
Ряд исследователей подчеркивают, что чем чаще ребенок с бронхиальной астмой болеет ОРВИ, тем в большей степени у него отмечается персистенция различных возбудителей, что в свою очередь определяет частоту заболеваемости острыми респираторными инфекциями. Все это сказывается на цитокиновом статусе ЧБД и детей с аллергическими заболеваниями, у них отмечается недостаточность интерферона-гамма, сопровождающая увеличением уровней медиаторов фагоцитарных реакций – интерлейкинов, в частности 8, и фактора некроза опухоли – альфа [2, 6]. Однако в отличие от здоровых детей интенсивность продукции и, соответственно, функционирования этих цитокинов у этих групп детей нельзя признать полноценной.
В целом полученные данные свидетельствуют о том, что для ранней диагностики нарушений функции иммунной системы у рассматриваемых контингентов детей и повышения эффективности их лечения необходимо совершенствовать подходы с учетом современных представлений о молекулярно-клеточных основах патологии верхних дыхательных путей, для чего следует применять на практике методы оценки состояния слизистой оболочки верхних дыхательных путей у ЧБД и детей с БА с использованием данных цитологических и микробиологических исследований.
Библиографическая ссылка
Калматов Р.К. ЦИТОЛОГИЧЕСКИЕ И МИКРОБИОЛОГИЧЕСКИЕ ХАРАКТЕРИСТИКИ СЛИЗИСТОЙ ОБОЛОЧКИ НОСОГЛОТКИ У ЧАСТО БОЛЕЮЩИХ ДЕТЕЙ И ДЕТЕЙ С БРОНХИАЛЬНОЙ АСТМОЙ // Современные проблемы науки и образования. 2016. № 2. ;URL: https://science-education.ru/ru/article/view?id=24293 (дата обращения: 07.01.2026).



