Оценка влияния сильвинотерапии на физико-химические и биохимические параметры слюны у пациентов с хроническим генерализованным катаральным гингивитом
Необходимо отметить, что человек, имеющий врожденные или приобретенные дефекты лицевого скелета, страдает не только вследствие тяжести патологического процесса, но и в результате несовершенства проведенных первоначально методов хирургического протетического лечения [1,3,6]. Бесспорно, что исправляющие и восстановительные вмешательства являются значительно более сложными в хирургической практике. Трудность проблем реконструктивной хирургии обусловлена исключительным многообразием форм, ведущих к обезображиванию лица, а также нарушением функций, при отсутствии совершенных и в то же время простых технологий реабилитации больных [4,5]. Несмотря на вышеуказанные проблемы в реконструктивной хирургии, исследования в этой области продолжаются. Возможность создания ячеистых материалов со сложной пространственной структурой минимизирует количество изделий с бездефектным построением, являясь инновационным направлением, используемым в медицине.
Цель исследования. Провести оценку возможности врастания тканей в ячейки титанового имплантата, тканевого субстрата и определить зависимость этого процесса от размера ячеек.
Материалы и методы исследования. Для изучения репаративных свойств тканей, врастающих в ячейки имплантатов (титана ВТ-5) в динамике, были изготовлены по технологии визуализации трехмерных систем компьютерного моделирования (САD-cистема) [2,7] их образцы с размером ячеек в 250 мкм, 550 мкм и 850 мкм. (рис.1).

Рис. 1. Имплантат из титана марки ВТ-5, имеющий ячеистую структуру
(ячейки Вигнера – Зейтца)
Исследование проводили на 12 беспородных белых крысах, возраст которых не превышал 3-х месяцев, масса их – от 180 г до 200 г. Соотношение животных в зависимости от величины ячеек показано в таблице.
Соотношение животных в зависимости от величины ячеек и времени
|
Размер ячеек имплантатов |
Сроки и количество имплантаций |
|||
|
1 мес. |
3 мес. |
Всего |
||
|
1 |
250 мкм |
2 |
2 |
4 |
|
2 |
550 мкм |
2 |
2 |
4 |
|
3 |
850 мкм |
2 |
2 |
4 |
Эксперимент выполнен в соответствии [Приложение к приказу Министерства здравоохранения СССР от 12.08.1977 г. N 755] с «Европейской конвенцией о защите позвоночных животных, используемых для экспериментов или в иных научных целях» от 18.III.1986. Текст изменен в соответствии с положениями протокола (ETS № 170), после его вступления в силу 2 декабря 2005 года. Имплантаты, основу которых составляет ячеистая структура, были введены в область основания хвоста животного, что является продолжением позвоночного столба. По мнению Ruimerman R. (2010), структура позвонков также имеет костное и пористое вещество, являясь идентичной строению нижней челюсти.
Из 12 белых беспородных крыс нами выделено 3 группы животных. Трем испытуемым из первой группы внедрены имплантаты с размером ячеек 250 мкм в искусственно произведенный дефект в область основания хвоста. Трем животным из второй группы внедрены имплантаты с размером ячеек в 550 мкм, третьей группе – в 850 мкм. Животных помещали в фиксатор (рестрейнер) для лабораторных животных, таким образом, чтоб хвост его по основание выступал из фиксатора. После антисептической обработки операционного поля с помощью инсулинового шприца производили блокаду нервного ствола введением 1 % раствора лидокаина в межпозвонковую область в объеме от 0,5 до 0,7 мл, а также в окружающие мягкие ткани от 1,0 мл до 1,5 мл (рис. 2).

Рис. 2. Блокада нервного ствола у основания хвоста животного
После рассечения кожи, подкожной клетчатки длиной до 2-х см и надкостницы проводили отслоение ее от кости позвонков, обнажали позвонки с хрящевыми дисками. Осторожно с помощью пилящего инструмента хрящевые диски резецировали у рядом стоящих позвонков (рис. 3).
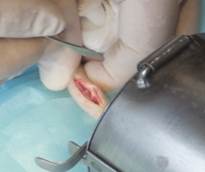
Рис. 3. Рассечение тканей послойно и подготовка ложа под имплантат
Имплантаты 4-м животным помещали между фрагментами позвонков, фиксировали жестко с помощью костного шва тонкой проволокой, подтягивали фрагменты позвонков к ячеистой структуре имплантата. Мягкими тканями закрывали имплантат и ушивали проленом 0,3 мм. Линию швов покрывали марлевой повязкой с мазью «Левомиколь». У четырех животных имплантаты вводили без резекции хрящевого отдела позвонков хвоста: после антисептической обработки операционного поля и блокады раствором лидокаина 1 % до 5,0 мл осуществляли разрезы кожи и подкожной клетчатки с надкостницей. Распатором надкостницу отделяли от кости позвонка, удаляли кортикальный слой с кости позвонка. Имплантат вводили между губчатым слоем позвонка и надкостницей без дополнительной фиксации, надкостницу и мягкие ткани ушивали проленом – 0,3мм. Линию швов покрывали марлевой повязкой с мазью «Левомеколь», пришитой к коже.
Все животные содержались в одинаковых условиях – в одной клетке одно животное. При наблюдении за животными на начальном этапе эксперимента (1–3 месяца) выявлено: животные активны, аппетит не нарушен, температурная реакция в норме, линии швов в норме. На коже в области хвостов крыс – визуализируются рубцы тонкие, розового цвета; отторжения имплантатов не наблюдали. Интенсивность и характер новообразованных тканевых структур в ячейках имплантатов оценивали после выведения животных из эксперимента. Из ячеек имплантатов ткани выделяли с помощью стоматологического экскаватора, полученные тканевые структуры фиксировали в 10 %-ном нейтральном формалине, заливали в парафин, срезы окрашивали гематоксилин-эозином и по ван Гизону. Приготовлены и исследованы 36 препаратов, которые разделены на 3 группы, соответственно размерам ячеек, указанных выше, а также изготовлены шлифы для определения соединения «кость-имплантат» (12).
Полученные результаты и обсуждение
При исследовании первой группы препаратов обнаружено, что в них преобладала рыхлая соединительная ткань с наличием одиночных мелких сосудов, в виде тонких тяжей проникающая в ячеистую структуру имплантата от образующейся внешней общей соединительнотканной капсулы. Последняя имела однородное строение с большим содержанием коллагеновых волокон по отношению к тканям ячеек (рис. 4).
![]()
 2
2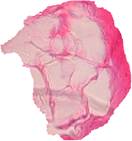 3 1 2
3 1 2  3 1
3 1
Рис. 4. Общая капсула (1); тяжи рыхлой соединительной ткани (2);
ячейки имплантата (3)
Во второй группе препаратов также имелась общая соединительнотканная капсула с элементами жировой и мышечной ткани и наличием сети более крупных сосудов. От общей капсулы отходят значительно плотные по структуре и строению тяжи соединительной ткани (рис. 5).
![]()
![]()

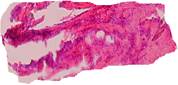
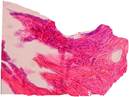
1 2
Рис. 5. Тяжи плотной соединительной ткани (1), отходящие от общей капсулы (2) и внедряющиеся в ячейки имплантатов. Окраска гематоксилин-эозин. Ув. х 100
В третьей группе препаратов общая капсула состоит из рыхлой и плотной соединительной ткани, жировых структур и пронизана крупными сосудами (3). От нее отходят толстые тяжи, состоящие из такой же плотной соединительной ткани, содержащей мелкие очаги грубоволокнистой кости (рис. 6).
![]()

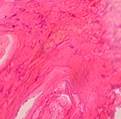 1
1
2
Рис. 6. Грубоволокнистая соединительная ткань (1), образовавшаяся в ячейках. Грубоволокнистая костная ткань; показаны ее балки (2).
Окраска: гематоксилин-эозин. Ув.х70

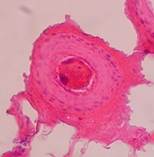
1 2
Рис. 7. Крупный кровеносный сосуд (1) в соединительной ткани (2), окружающей имплантат. Окраска гематоксилин-эозином. 200

![]() 1
1 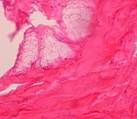 2
2
Рис. 8. Очаги жировой ткани (1), образовавшейся в соединительнотканной капсуле вокруг имплантата (2). Окраска гематоксилин-эозином. Ув. х 70
Было установлено, что в параоссальных пространствах капсулы, покрывающей ячеистую поверхность имплантата, у 2 животных встречались мелкие инкапсулированные инородные тела – микрофрагменты металла, вокруг которых наблюдалась мононуклеарная реакция, которая отвечает неспецифическому продуктивному воспалению низкой активности, как следствие процесса биодеструкции материала (рис. 9).
 1
1
Рис. 9. Микрофрагменты металла (1), вокруг которых наблюдалась мононуклеарная реакция. Окраска гематоксилин-эозином. Ув. х 70
На шлифах соединение «кость-имплантат» установлено, что ячейки размером 250 мкм заполнены соединительной тканью лишь на периферии; в центре таковая отсутствовала или тонким слоем покрывала только ребра ячеек. В ячейках в 550 мкм по периферии определялись фрагменты костных трабекул, переходящих в соединительную ткань, располагающуюся в центре имплантата и заполняющую просвет ячеек. В ячейках в 850 мкм отдельные костные трабекулы видны уже по периферии имплантата, распространяющиеся в центр ячеистых структур.
Выводы. В результате патогистологичеких исследований и просмотров шлифов «кость-имплантат» установлено:
1. В ячейках, размерами 250 мкм, преобладает рыхлая соединительная ткань, пронизанная одиночными мелкими сосудами.
2. В ячейках, размерами 550 мкм, в окружающей имплантат соединительной ткани (капсула) имеются вкрапления жировой и мышечной тканей, пронизанных сетью более крупных кровеносных сосудов. От капсулы отходят значительно плотные, однородные по структуре и строению тяжи плотной и рыхлой соединительной ткани.
3. В ячейках, размерами 850 мкм, общая капсула содержит прослойки жировой ткани с наличием еще более крупных кровеносных сосудов. От капсулы отходят толстые тяжи плотной соединительной ткани, в которой содержатся мелкие очаги грубоволокнистой кости.
4. В соединении «кость-имплантат» на полученных шлифах установлено, что ячейки, размером 250 мкм, заполнены лишь на периферии рыхлой соединительной тканью, ячейки 850 мкм содержат костные трабекулы по периферии имплантата, распространяющиеся в центр ячеистых структур.
Библиографическая ссылка
Штраубе Г.И., Четвертных В.А., Василюк В.П. МОРФОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯ ТКАНЕЙ, УДАЛЕННЫХ ИЗ ЯЧЕИСТОЙ СТРУКТУРЫ ТИТАНОВЫХ ИМПЛАНТАТОВ, ПОДСАЖЕННЫХ В КОСТЬ ЖИВОТНЫХ // Современные проблемы науки и образования. 2016. № 1. ;URL: https://science-education.ru/ru/article/view?id=24090 (дата обращения: 07.01.2026).



