Для выделения и очистки лизоцима наиболее часто используется метод жидкостной ионообменной хроматографии на катионитах. Самыми распространенными катионитами являются амберлит и карбоксиметилцеллюлоза (КМЦ) [2, 6]. В ряде методик используется аффинная хроматография, где в качестве сорбента выступает хитин [4].
Поскольку каждый из методов имеет определённые сложности, достоинства и недостатки, в ходе работы представилось актуальным провести сравнительное исследование эффективности данных сорбентов для хроматографического выделения и очистки лизоцима.
В качестве объекта исследования использовали двухстворчатых моллюсков семейства перловицы (Unionidae), вид Unio pictorum, являющихся типичными представителями гидробиоценозов среднего течения р. Урал в районе г. Оренбурга. Моллюсков собирали вручную и определяли их видовую принадлежность общепринятыми в гидробиологии методами [2, 5].
В качестве сорбента использовали хитин и карбоксиметилцеллюлозу (КМЦ). Хитин является наиболее доступным сорбентом, методика получения которого является достаточно простой и хорошо воспроизводимой. Кроме того, хитин позволяет работать с большими объемами биологической жидкости, по простой схеме элюции с небольшой трудоёмкостью. В данном случае отсутствует засолённость получаемых препаратов фермента, что значительно снижает погрешность метода, исключая необходимость обессоливания [3]. В отличие от хитина, КМЦ – сорбент дорогостоящий, для реализации данного метода необходимо выполнение более сложной и продолжительной схемы элюции. При использовании в качестве сорбента КМЦ, в элюатах присутствуют соли, что требует последующего обессоливания, сопряжённого, как правило, с большей потерей препарата [2].
Материалы и методы
Материалом для исследования послужили гомогенаты тканей пресноводного двустворчатого моллюска U. pictorum, полученные при растирании на холоду с прокаленным кварцевым песком в фосфатном буферном растворе (рН=6,2). Далее гомогенаты подвергали многократному замораживанию и оттаиванию.
В целях освобождения от балластных белков проводили этап рН-обработки: отделённый центрифугированием от тканей супернатант обрабатывали 0,1М ацетатом аммония (рН=4,5), инкубацию проводили при 4⁰С в течение 17 часов, затем раствор центрифугировали при 13000 оборотов/минуту в течение 10 минут. Осадок отбрасывали.
Для ионнобменной хроматографии использовали колонку (2,0×20см), заполненную сорбентом карбоксиметилцеллюлоза (BUDAPEST∙HUNGARY) с номинальной ёмкостью 0,70±0,10 мэкв/г, уравновешенную 0,05М ацето-аммонийным буферным раствором (рН=5,8) и соединённую с перистальтическим насосом со скоростью протекания жидкости через колонку 0,1 мл/мин. На колонку наносили 30 мл очищенного экстракта, нейтрализованного до рН=5,8. Далее колонку промывали 150мл 0,1М ацетата аммония – для освобождения от сопутствующих не связавшихся белков. Лизоцим десорбировали 0,8М ацетатом аммония (рН=4,5). Собирали фракции объёмом 2мл; во всех определяли лизоцимную активность. Для дальнейших исследований отбирали наиболее активные [1, 2].
При проведении афинной хроматографии в качестве сорбента использовали хитин, полученный из панцирей речных раков [3].
В целях уменьшения сорбции посторонних белков проводили предварительную подготовку экстрактов. Учитывая тот факт, что лизоцим устойчив в пределах рН 3,0–5,0, экстракты сначала подкисляли 5%-ной уксусной кислотой до рН 4,0 и выдерживали на холоду 10 мин, осадок удаляли центрифугированием. Затем рН супернатанта доводили до 8,5 2н раствором NaOH и выпавший осадок отделяли центрифугированием в том же режиме. После центрифугирования получали осветленные препараты.
В работе использовали хроматографическую колонку (2,0×20см), заполненную хитиновым сорбентом, суспензированным в 0,1М фосфатном буфере (рН 8,0 – 8,5). Прозрачный экстракт объемом 30 мл наносили на колонку, уравновешенную 0,1М фосфатным буфером (рН 8,5). После нанесения всего объема экстракта колонку промывали тем же буфером, объемом 200 мл, до исчезновения в элюатах белка. Затем промывали 100 мл дистиллированной воды для удаления солей. Лизоцим элюировали 5%-ной уксусной кислотой, объемом 100 мл, путем резкого изменения рН среды. Собирали фракции объемом 5 мл (20 фракций), во всех фракциях определяли лизоцимную активность [5].
Лизоцимную активность элюатов определяли в суспензиях тест-культуры M. lysodeikticus (штамм № 2665 ГИСК им. Л.А Тарасевича) с исходной оптической плотностью D540 =0,40 при 27⁰С и длине оптического пути 10мм спектрофотометрическим методом на цифровом спектрофотометре PD – 303 UV [2].
О лизоцимной активности полученных препаратов судили по изменению светопропускания опытной взвеси M. lysodeikticus по сравнению с исходной, расчёт производили по формуле:
![]()
Еа – единица лизоцимной активности, Еа/мл;
ΔD540 – изменение оптической плотности опытной взвеси M. lysodeikticusво время инкубации;
τ – время инкубации, 15минут;
0,001 – снижение величины оптической плотности раствора за 1 минуту;
V – объём препарата лизоцима, 1 мл.
За единицу литической активности (Еа/мл) элюата принимали такое его количество, которое вызывало снижение исходной оптической плотности раствора на 0,001 за 1 минуту.
Удельную литическую активность выражали в условных единицах на мг белка (Е (уд.акт.), ед./мг белка). Содержание белка в исследуемых элюатах определяли по методу М. Брэдфорда [6].
Статистическая обработка данных проводилась с использованием компьютерной программы «Microsoft Excel 2010» [5].
Результаты и их обсуждение. Для выделения и очистки лизоцима U. pictorum методом ионообменной хроматографии на КМЦ подготовленную колонку предварительно стандартизировали яичным лизоцимом фирмы «Ферейн» с концентрацией белка 1 мкг/мл. Результаты хроматографии представлены на рисунке 1. Яичный лизоцим элюировался в данных условиях хроматографии во фракциях №11 – 13.
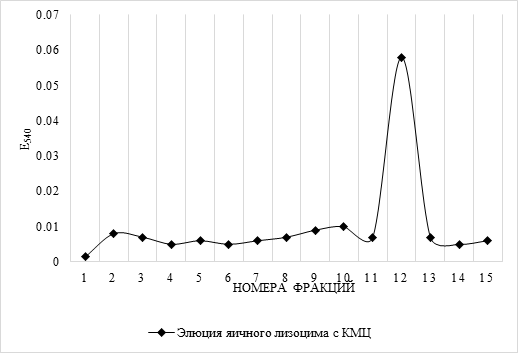
Рис. 1. Элюция яичного лизоцима с карбоксиметилцеллюлозы (КМЦ)
Следует отметить, что наибольшая лизоцимная активность элюатов регистрировалась в этих же фракциях.
Результаты хроматографии лизоцима моллюсков на КМЦ отображены на рисунке 2. Белок выходил преимущественно одним пиком – во фракциях №8 – 10: в них же фиксировалась лизоцимная активность в отношении культуры M. lysodеikticus.
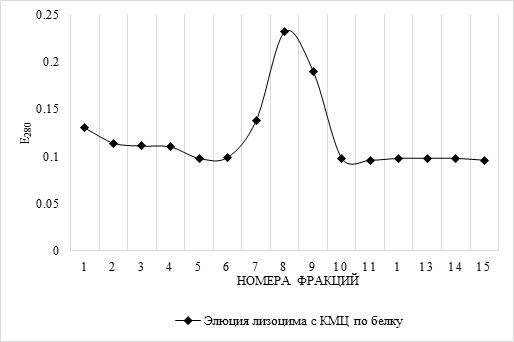
Рис. 2. Кривая элюции лизоцима с карбоксиметилцеллюлозы (КМЦ) (по белку)
Анализ полученных данных показывает, что лизоцим моллюсков U.pictorum менее основный по сравнению с яичным лизоцимом. Наибольшая концентрация белка в случае яичного лизоцима фиксируется в 12 фракции с изоэлектрической точкой, равной pI≈11,0, а активные элюаты лизоцима моллюсков во фракциях №8 – 10. Следовательно, лизоцим моллюсков имеет более низкое значение изоэлектрической точки.
Для идентификации лизоцима в полученных элюатах проводили спектрофотометрическое исследование в диапазоне 240 – 320 нм. Значения экстинкции элюатов практически совпадают со значениями экстинкции препарата яичного лизоцима, что подтверждает наличие фермента в опытных элюатах.
Для выделения и очистки лизоцима U.pictorum методом аффинной хроматографии на хитине подготовленную колонку также предварительно стандартизировали яичным лизоцимом фирмы «Ферейн» с концентрацией белка 1 мкг/мл. Результаты хроматографии отображены на рисунке 3. Яичный лизоцим элюировался в данных условиях хроматографии во фракциях №11 – 13.
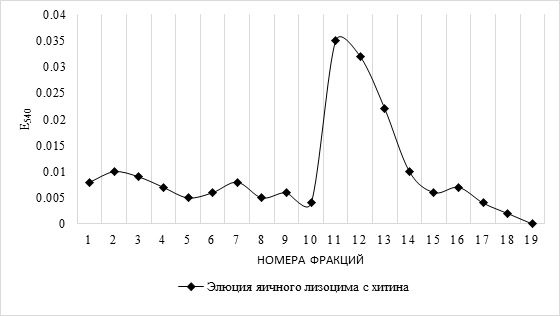
Рис. 3. Кривая выхода элюции яичного лизоцима с хитина
Результаты хроматографии лизоцима моллюсков приведены на рисунке 4. Белок постоянно выходил одним пиком – фракции №8 – 12: лизоцимная активность по отношению к культуре M. Lysodеikticus фиксировалась в этих же фракциях.
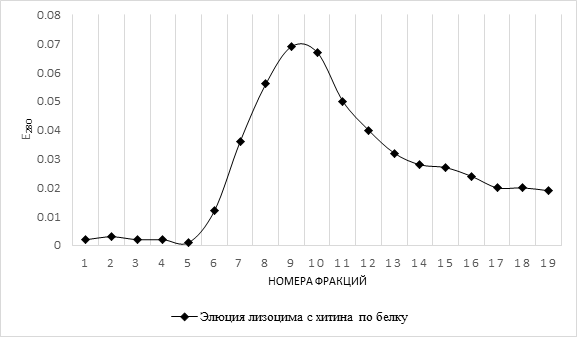
Рис. 4. Кривая выхода элюции лизоцима с хитина по белку
Для идентификации лизоцима в полученных элюатах проводили спектрофотометрическое исследование в диапазоне 240 – 320 нм. Кривая экстинкции элюатов совпадает с кривой экстинкции препарата яичного лизоцима.
Спектрофотометрическое исследование элюатов в диапазоне от 240 до 320 нм подтверждает присутствие лизоцима моллюсков в исследуемых фракциях.
Согласно проведенным исследованиям, возможно оценить эффективность используемых сорбентов. Результаты ионообменной и аффинной хроматографии экстрактов моллюсков U. pictorum показали хорошую воспроизводимость исследуемых методов: белок постоянно выходил одним пиком – во фракциях №8 – 12 при хроматографии на хитине, и – во фракциях №8 – 10 при хроматографии на КМЦ. Активность фермента была локализована в этих же пробах.
По методу М. Брэдфорда была определена концентрация белков экстрактов моллюсков (400 мкг/мл); всего было нанесено 30 мл препарата, то есть 12000 мкг белка. В элюатах определяли концентрацию белка по Варбургу и Кристиану: в случае хроматографии на КМЦ концентрация белков в элюатах составила 200 мкг/мл, так как активность локализована в 6 мл, было выделено 1200 мкг белка из 12000 мкг белка, нанесенного на колонку. В случае хроматографии на хитине концентрация белков в элюатах составила 40 мкг/мл. Активность была локализована в 25 мл, следовательно, было выделено 1000 мкг белка. Таким образом, степень очистки лизоцима моллюсков при использовании в хроматографии сравниваемых сорбентов приблизительно одинаковая: 1200 мкг при хроматографии на КМЦ и 1000 мкг - на хитине.
Выводы
В зависимости от цели получения препарата лизоцима можно использовать разные методы его выделения и очистки. При необходимости большого объема препарата в качестве сорбента можно использовать хитин. Если задача эксперимента состоит в выделении препарата высокой концентрации, то в качестве сорбента следует использовать КМЦ. Однако для выделения лизоцима моллюсков среди сорбентов наиболее подходящим является хитин, так как лизоцим пресноводных двустворчатых моллюсков чувствителен к ионной силе раствора, при увеличении которой определение активности исследуемого фермента существенно усложняется и замедляется.
Библиографическая ссылка
Карнаухова И.В., Ширяева О.Ю., Шукшина С.С., Соловых Г.Н., Осинкина Т.В. ИЗУЧЕНИЕ НЕКОТОРЫХ НАИБОЛЕЕ ДОСТУПНЫХ МЕТОДОВ ВЫДЕЛЕНИЯ И ОЧИСТКИ ЛИЗОЦИМА ПРЕСНОВОДНЫХ ДВУСТВОРЧАТЫХ МОЛЛЮСКОВ // Современные проблемы науки и образования. 2015. № 6. ;URL: https://science-education.ru/ru/article/view?id=23719 (дата обращения: 06.01.2026).



