Рак пищевода занимает 8-е место в структуре злокачественных новообразований в мире [8]. В настоящее время в мире ежегодно регистрируется около 480 тысяч новых случаев этого заболевания, при этом смертность: 400 тысяч смертей от рака пищевода каждый год [7].
Прогноз онкологических заболеваний, как и возможность применения иммунотерапии в комплексном лечении, не в последнюю очередь зависит от состояния локального иммунитета [1]. При диагностическом гистологическом исследовании опухолей пищевода в них нередко отмечается лимфоцитарная инфильтрация, однако, ее роль в течении и прогнозе заболевания остается дискуссионной. Происхождение ее также неясно, так как пищевод, в отличие от желудка, толстого кишечника, бронхов, не содержит MALT или BALT. В последнее время в литературе встречаются сообщения об ассоциации рака пищевода с присутствием некоторых вирусов, прежде всего, ВПЧ, что отчасти может объяснять лимфоцитарную инфильтрацию [6, 9, 10].
Целью данной работы является изучение клеточных факторов локального иммунитета при раке пищевода с различными характеристиками опухолей и организма-опухоленосителя.
Материалы и методы
Объектом изучения были фрагменты ткани опухоли и перитуморальной области 25 пациентов, прооперированных по поводу рака пищевода (6 женщин и 19 мужчин в возрасте от 40 до 77 лет), оперированных в отделении абдоминальной онкологии №1 Ростовского научно-исследовательского онкологического института за период с 2014 по 2015 годы. Все случаи заболевания были первичными, неоадъювантного лечения не проводилось. Преимущественное поражение верхнегрудного отдела пищевода выявлено у 1 больного, среднегрудного – у 12 больных, нижнегрудного – у 11 больных, у одного больного выявлено поражение абдоминального отдела пищевода. Распределение больных по распространенности опухолевого процесса представлено в таблице 1.
Таблица 1
Распределение пациентов по стадиям опухолевого процесса
|
Стадия |
IA |
IB |
IIA |
IIB |
IIIA |
IIIB |
IIIC |
|
Количество больных |
2 |
4 |
6 |
2 |
7 |
1 |
3 |
|
% |
8 |
16 |
24 |
8 |
28 |
4 |
12 |
После предварительной подготовки всем больным по показаниям было выполнено оперативное вмешательство на органах брюшной полости и грудной клетки. Выбор объема операции определялся локализацией и размерами опухоли; распространенностью – стадией опухолевого процесса; наличием отдаленных метастазов; морфологическими характеристиками новообразования; возрастом и общем состоянием больных.
В зависимости от локализации и формы роста опухоли и объема поражения были выполнены следующие объемы операций: 24 больным с локализацией рака в среднегрудном, нижнегрудном и абдоминальном отделах пищевода выполнено оперативное вмешательство в объеме – субтотальная резекция пищевода, проксимальная резекция желудка с одномоментной внутриплевральной пластикой пищевода желудком. Одному больному с диагнозом рак верхнегрудного отдела пищевода выполнена экстирпация пищевода с формированием эзофаго и гастростомии (операция типа Добромыслова-Торека). Всем больным (25) стандартно выполняли двухзональную лимфадиссекцию.
При гистологическом исследовании был выявлен плоскоклеточный рак у 7 больных без ороговения, у 18 с ороговением. У 8 больных определялась низкодифференцированная степень дифференцировки опухоли, у 12 – умереннодиффернцированная, у 5 – высокодифференцированная.
Исследование факторов локального клеточного иммунитета проводили не позднее, чем через час после хирургического лечения на свежем послеоперационном материале. Фрагменты опухолевой ткани, перитуморальной зоны (ПЗ, визуально неизмененной ткани, прилежащей к опухоли) и линии резекции (ЛР, ткани, удаленной от опухоли на расстояние 2-4 см дистально и проксимально, гомогенизировали с помощью дезагрегирующего устройства BD Medimachine. В гомогенатах тканей определяли популяционный и субпопуляционный состав лимфоцитов на проточном цитометре FACSCantoII (BD) с панелью антител T-, B-, NK (CD45, CD3, CD4, CD8, CD19, CD16/56), включая Т-клетки с TCR- рецептором αß и γδ; рассчитывали уровни NKT (CD3+CD16/56+), DN (CD3+CD4-CD8-); дополнительно оценивали количественное содержание Т-регуляторных (T-regs) клеток (CD4+CD25+CD127dim). Несмотря на то, что наиболее распространенным методом определения последних является подсчет клеток с фенотипом CD4+CD25brightFoxP3+, в литературе есть данные о приемлемости для этой цели фенотипа CD4+CD25+CD127dim [5].
Результаты выражали в процентах от общего количества лимфоцитов, для TCRαß TCRγδ – в процентах от CD3+, а для T-regs в процентах от CD3+CD4+ клеток. Статистическую обработку данных выполняли с помощью параметрических и непараметрических методов (t-критерий Стьюдента, критерий Уилкоксона, метод непрямых разностей).
Результаты
Проводили сравнение полученных показателей: в опухоли, ПЗ и ЛР; в зависимости от пола больных; в зависимости от степени дифференцировки опухоли.
Результаты представлены в таблицы 2, 3 и на рисунке 1.
Таблица 2
Характеристика факторов локального клеточного иммунитета у больных раком пищевода
|
Субпопуляции лимфоцитов, % |
Образцы тканей (n=25) |
||
|
Опухоль |
Перитуморальная зона |
Линия резекции |
|
|
CD3+ |
76,5±2,7 |
66,5±5,1 |
60,6±5,7 |
|
CD3+CD4+ |
47,8±6,06* ** |
29,1±5,76 |
23,6±4,26 |
|
CD3+CD8+ |
27,3±4,3 |
26,5±3,1 |
26,4±4,7 |
|
TCRαß |
92,3±2,43 |
89,4±3,45 |
88,0±2,22 |
|
TCRγδ |
7,05±2,38 |
9,36±3,0 |
10,4±2,2 |
|
CD16+/56+ |
8,0±2,9 |
8,4±2,8 |
13,1±3,0 |
|
CD19+ |
10,1±1,4 |
8,0±2,1 |
8,7±2,0 |
|
T regs (CD4+ СD25+CD127dim) |
19,1±2,8* ** |
8,1±2,0 |
3,8±1,1 |
Примечание. * - статистически достоверные отличия от ткани ЛР; ** - статистически достоверные отличия от ткани ПЗ (р<0,05)
Как видно из таблицы 2, обнаружен ряд статистически достоверных различий по содержанию исследованных субпопуляций лимфоцитов в тканях опухоли и немалигнизированных образцах (ПЗ и ЛР). Так, в опухолевой ткани выше, чем в ткани ЛР, оказалось содержание CD3+CD4+ и T regs, также имеющих рецептор CD4, которые могут рассматриваться по иммунофенотипу как часть общей Т-хелперно-индукторной субпопуляции. Среди Т-лимфоцитов преобладают Т-клетки с фенотипом TCRαß, как в крови, но не в ткани толстой кишки, где их соотношение обратное. Уровни остальных исследованных субпопуляций не имеют статистически значимых различий между образцами тканей.
Некоторые гендерные различия исследованных характеристик представлены в таблице 3.
Таблица 3
Сравнительная характеристика факторов локального иммунитета у мужчин и женщин, больных раком пищевода
|
Показатели, % |
Образцы тканей |
|||||
|
Опухоль |
ПЗ |
ЛР |
||||
|
мужчины |
женщины |
мужчины |
женщины |
мужчины |
женщины |
|
|
CD3+ |
77,6±6,1 |
84,8±3,9* |
61,8±7,5 |
70,3±14,5 |
60,2±7,4 |
60,2±12,4 |
|
Продолжение таблицы 3 |
||||||
|
CD3+CD4+ |
37,0±3,9* ** *** |
52,5±5,5* *** |
24,4±3,6 |
34,4±10,2 |
20,5±3,4 |
27,5±6,7 |
|
CD3+CD8+ |
29,7±4,1 |
23,9±2,4 |
28,1±4,6 |
25,6±7,8 |
28,0±5,7 |
24,3±5,6 |
|
CD19+ |
8,4±3,4 |
12,2±3,6 |
11,5±4,2 |
7,9±3,1 |
10,7±3,5 |
7,8±3,1 |
|
CD16/56+ |
10,1±3,7 |
4,0±0,9* |
10,9±3,4 |
5,1±2,1* |
13,2±3,8 |
14,1±6,3 |
|
NKT (CD3+CD16/56+) |
5,4±1,1 |
4,7±1,9 |
6,1±1,9 |
5,9±1,9 |
6,7±1,4 |
6,2±2,7 |
|
DN CD3+CD4-CD8- |
10,5±2,1 |
8,1±3,4 |
8,7±1,4 |
6,9±3,1 |
11,0±3,6 |
9,8±4,9 |
|
T regs (CD4+ CD25+CD127dim) |
21,0±2,7* ** |
18,3±3,6* |
5,1±0,7 |
11,2±6,1 |
4,3±0,9 |
3,2±1,8 |
Примечания: * - статистически достоверные отличия от ткани ЛР; ** - статистически достоверные отличия от ткани ПЗ; *** - статистически достоверные различия в зависимости от пола больных
У женщин выявлены различия по уровням CD3+ клеток, которые были выше в опухоли по сравнению с тканью ЛР, и NК-клеток, которые, напротив, были ниже, чем в ЛР. Обнаружено также более высокое содержание CD3+CD4+ лимфоцитов в опухолевой ткани у женщин по сравнению с мужчинами.
Сравнительная характеристика содержания лимфоцитов исследованных субпопуляций в опухолях различной степени дифференцировки представлена на рисунке 1. Несмотря на выраженную индивидуальную вариабельность полученных данных, удалось выявить ряд статистически достоверных различий.
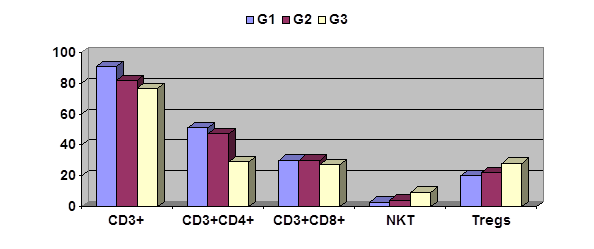
Рисунок 1. Содержание лимфоцитов некоторых субпопуляций в ткани опухолей с различной степенью дифференцировки (%).
Как видно из рисунка 1, в высокодифференцированных опухолях (G1) содержится статистически достоверно больше зрелых Т-лимфоцитов (CD3+), а также CD3+CD4+ клеток, чем в низкодифференцированных (G3); умеренно-дифференцированные опухоли (G2) занимают промежуточное положение. Описанная разница особенно демонстративна для CD3+CD4+ клеток, составляя 51,0±2,7% для G1, 46,9±5,8% для G2 и 25,8±6,8% для G3; последний показатель статистически значимо ниже двух первых (р<0,05). Следует отметить, что соответствующие данные по проценту T regs в опухолевой ткани не имели столь выраженных различий (рисунок 1), то есть их уровень высок вне зависимости от степени дифференцировки опухоли. Напротив, уровни NКТ-лимфоцитов были статистически достоверно выше в низкодифференцированных опухолях G3 (9,3±2,1% против 4,1±1,1% при опухолях G2 и 2,8±0,7% в высокодифференцированных опухолях G1; р<0,05). Содержание CD3+CD8+ и В-клеток в опухолях с различной степенью дифференцировки не различаются.
Заключение
Итак, удалось обнаружить некоторые различия показателей локального клеточного иммунитета в тканевых образцах больных раком пищевода. Опухоль отличается от прилежащих к ней немалигнизированных тканей более высоким содержанием хелперно-индукторных и Т-регуляторных лимфоцитов. Отмечены некоторые гендерные различия, свидетельствующие о том, что у женщин в локальные иммунные реакции более интенсивно вовлечено адаптивное звено клеточного иммунитета, а у мужчин – врожденное, связанное с NК-клетками. Однако, учитывая малочисленную группу больных женского пола, эти наблюдения можно рассматривать как предварительные. Установленные различия субпопуляционного состава лимфоцитов в опухолях с различной степенью дифференцировки позволяют предположить более выраженное нарушение Т-хелперно-индукторной субпопуляции при, по-видимому, компенсаторном повышении лимфоцитов минорной субпопуляции NКТ в образцах ткани низкодифференцированного рака. В целом, полученные данные соответствуют полученным нами ранее на других локализациях [2, 3, 4], что предполагает общность механизмов взаимодействия опухоли и иммунной системы организма опухоленосителя при различных злокачественных новообразованиях. Возможно, CD3+CD4+ клетки, мигрируют из крови через опухолевые сосуды с повышенной проницаемостью и адгезивными свойствами эндотелия, при этом происходит отбор минорной субпопуляции T regs, обладающих проонкогенными и иммуносупрессивными свойствами, для заселения опухолевой ткани.
Рецензенты:
Каймакчи О.Ю., д.м.н., ассистент кафедры онкологии Ростовского государственного медицинского университета, г. Ростов-на-Дону;
Николаева Н.В., д.м.н., ассистент кафедры онкологии Ростовского государственного медицинского университета, г. Ростов-на-Дону.
Библиографическая ссылка
Кит О.И., Максимов А.Ю., Колесников Е.Н., Трифанов В.С., Златник Е.Ю., Новикова И.А., Селютина О.Н., Закора Г.И., Базаев А.Л. ФАКТОРЫ ЛОКАЛЬНОГО ИММУНИТЕТА ПРИ РАКЕ ПИЩЕВОДА РАЗНОЙ СТЕПЕНИ ДИФФЕРЕНЦИРОВКИ // Современные проблемы науки и образования. 2015. № 6. ;URL: https://science-education.ru/ru/article/view?id=23527 (дата обращения: 20.02.2026).



