Мировая распространенность сахарного диабета (СД) 2 типа, как хронического неинфекционного заболевания, приобрела масштабы пандемии. В 2013 году от причин, связанных с СД, в мире умерли 5,1 млн человек. Ассоциированные с диабетом и его осложнениями заболеваемость, снижение качества жизни и смертность определяют исключительную значимость мер, направленных на предупреждение развития СД в целом и его контроль. По неутешительным прогнозам Международной федерации диабета, к 2035 г. численность пациентов с СД 2 типа увеличится еще на 55% [2].
Хорошо известно, что течение СД характеризуется развитием и прогрессией макро- и микрососудистых поражений [1]. Показано, что у пациентов с СД обнаруживается быстропрогрессирующая форма атеросклеротических изменений, причиной которой является дисфункция эндотелия [3]. Так, исследования последних 25 лет показали, что эндотелий – это не пассивный барьер между органами и тканями, а активный орган, дисфункция которого является патогенетическим компонентом практически всех сердечно-сосудистых заболеваний и СД. Эндотелий активно участвует в реализации воспалительных реакций, аутоиммунных процессов, развитии тромбозов, сепсиса и др [9]. На сегодняшний день понимание этого феномена является принципиально важным и значимым подходом к решению проблемы предупреждения и лечения СД и его осложнений, приводящих к значительному снижению качества жизни, инвалидизации и преждевременной смерти пациентов с этим заболеванием.
Сегодня активно обсуждается вопрос влияния половых гормонов на функцию эндотелия. Известно, что снижение уровня тестостерона (Т) у мужчин приводит к развитию эректильной дисфункции, непосредственно связанной с нарушением функции эндотелия сосудов кавернозных тел [10]. Изучено и влияние андрогенного дефицита на поражение других органов-мишеней, ведущее за собой развитие артериальной гипертензии, ишемической болезни сердца, тромбофлебита и др. С другой стороны, ряд исследований показывает, что повышенный риск кардиометаболических осложнений и прогрессирующее развитие андрогенного дефицита имеют патогенетическую связь с цитокиновым дисбалансом [4]. Цитокины, являясь эндогенными биологически активными медиаторами, регулируют межклеточные и межсистемные взаимодействия, определяют выживаемость клеток, стимуляцию или подавление их роста, дифференциацию, функциональную активность клеток и процессы их апоптоза. В настоящее время висцеральное ожирение, встречающееся у больных с СД в 90% случаев [5], расценивается как результат хронического воспаления в жировой ткани. Различные маркеры хронического воспаления, такие как С-реактивный белок, цитокины интерлейкин-6 (ИЛ-6) и фактор некроза опухоли альфа (ФНО-α), молекулы межклеточной адгезии - ICAM, е-селектин и др. повышаются в плазме крови и, возможно, являются предикторами дальнейших кардиоваскулярных событий.
Принимая во внимание сложный, многофакторный генез и прогрессирующий характер метаболических осложнений у больных СД, не вызывает сомнений необходимость поиска ранних маркеров нарушения биохимической активности эндотелия и дисбаланса провоспалительных цитокинов.
Целью исследования являлась оценка влияния половых гормонов на биохимические маркеры эндотелиальной дисфункции и уровень провоспалительных цитокинов у больных СД 2 типа.
Материалы и методы.
В исследовании принимали участие 88 мужчин в возрасте 40-65 лет с СД 2 типа (средний возраст - 53,0±6,4 года). Протокол исследования был одобрен Локальным Независимым Этическим Комитетом (ЛНЭК) при Ростовском Государственном медицинском университете. Все пациенты до выполнения процедур исследования подписали форму информированного согласия, одобренную ЛНЭК.
У всех обследуемых определяли антропометрические показатели: рост, массу тела, окружность талии (ОТ), окружность бедер (ОБ) – с дальнейшим расчетом индекса массы тела (ИМТ) и соотношения ОТ/ОБ, а также измеряли артериальное давление (АД). У пациентов производили забор крови из локтевой вены утром натощак после 12-ти часового голодания с последующим определением лабораторных показателей углеводного и липидного обмена (уровень гликемии натощак, гликированный гемоглобин (HbA1C), липидограмма), а также измерением уровня общего Т. В качестве биохимических маркеров эндотелиальной дисфункции изучали концентрации ICAM-1, VCAM-1, p-селектина, e-селектина, резистина, определяли уровни провоспалительных цитокинов ФНО-α, ИЛ-6 в сыворотке крови.
Для исследования биохимических показателей использовали анализатор Bayer ADVIA 1650, Siemens (Германия). Исследование общего Т производили иммуноферментным методом с использованием тест систем “Elisa” компании DRG Diagnostics (Германия).
Все пациенты были разделены на две группы, сопоставимые по возрасту и уровню АД. В первую группу вошли 47 пациентов с нормальным уровнем Т без клинических симптомов гипогонадизма, во вторую - 41 мужчина с возрастным гипогонадизмом. Группы были сформированы в соответствии с диагностическим критериями возрастного гипогонадизма, рекомендованными Европейской Ассоциацией Урологов 2015.
Все переменные были проверены на нормальность распределения по критерию Колмогорова-Смирнова. Параметрические данные представлены как среднее арифметическое и стандартное отклонение (М±SD). Параметрические данные анализировались с использованием критерия Стьюдента. Непараметрические данные представлены в виде медианы, нижнего и верхнего квартиля Me [LQ; UQ]. Непараметрические данные были проанализированы с использованием теста Манна — Уитни для двух независимых групп. Статистический анализ проводили с использованием пакета прикладных программ Статистика 11. Результаты считали статистически значимыми при р ≤ 0,05.
Результаты.
Анализ полученных данных показал, что пациенты с возрастным гипогонадизмом имели достоверно более высокий ИМТ, ОТ и ОБ. Кроме того, уровни HbA1c, триглицеридов (ТГ), липопротеидов очень низкой плотности (ЛПОНП) были статистически выше у пациентов второй группы (табл. 1). Это указывает на ухудшение контроля углеводного и липидного обменов в условиях андрогенного дефицита.
Табл.1. Показатели углеводного и липидного обменов.
|
Критерий |
Группа 1 |
Группа 2 |
Р критерий |
|
ИМТ, кг/м2 |
30,0 [22,7; 33,1] |
31,5 [29,5; 36,9]* |
0,023 |
|
ОТ, см |
107,0 [101,0; 115,0] |
111,5 [102,0; 127,0]* |
0,049 |
|
ОБ, см |
108,0 [102,5; 115,0] |
115,0 [108,0; 120,0]* |
0,047 |
|
САД, мм.рт.ст |
139,0 [130,0; 151,0] |
141,0 [136,0; 150,0] |
0,329 |
|
ДАД, мм.рт.ст |
84,0 [80,0; 91,0] |
83,0 [79,0; 92,0] |
0,692 |
|
ОХ, ммоль/л |
5,4 [4,9; 6,9] |
5,7 [4,7; 6,3] |
0,088 |
|
ТГ, ммоль/л |
1,7 [1,2; 2,3] |
2,0 [1,6; 3,0]* |
0,031 |
|
ЛПВП, ммоль/л |
1,4 [1,3; 1,6] |
1,5 [1,4; 1,6] |
0,091 |
|
ЛПОНП, ммоль/л |
0,7 [0,6; 1,0] |
0,9 [0,7; 1,4]* |
0,034 |
|
HbA1C, % |
7,5 [6,3; 9,3] |
8,4 [7,0; 11,7]* |
0,049 |
Примечание: * - статистическая значимость различий между группами ≤ 0,05
Наше исследование не выявило статистически значимых различий в концентрациях e-селектина, р-селектина и VCAM-1 между двумя группами. Это может отражать незначительное влияние низких концентраций Т на данные маркеры эндотелиальной дисфункции. Полученные нами данные отличаются от результатов крупного проспективного исследования EURODIAB, в котором принимали участие больные СД 1 типа, где было показано, что именно уровни воспалительных маркеров VCAM-1 и e-селектина были связаны с показателями дисфункции эндотелия [8].
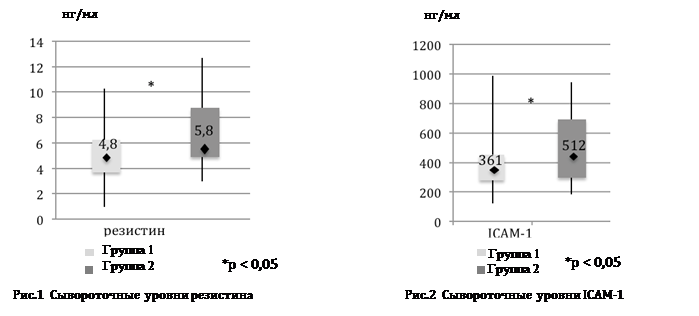
В тоже время, во второй группе выявили достоверно более высокие уровни резистина (р = 0,01) и ICAM-1 (р = 0,04) по сравнению с первой группой (рис.1 и 2). Так, у пациентов с дефицитом Т уровень резистина был на 17%, а ICAM-1 на 29,5% выше, чем у эугонадных мужчин с СД 2 типа.
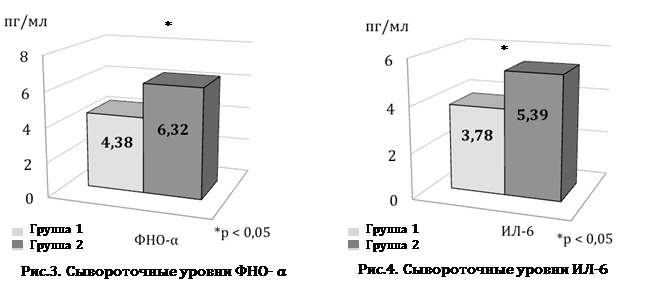
Анализ содержания провоспалительных цитокинов выявил, что сывороточный уровень ФНО-α был достоверно выше на 44,3% у мужчин с возрастным гипогонадизмом по сравнению с пациентами без андрогенного дефицита (рис. 3). Имеются данные о том, что ФНО-α у больных СД 2 типа может приводить к развитию инсулинорезистентности [6], которая способствует прогрессированию заболевания и развитию сосудистых осложнений.
Кроме того, сывороточные уровни ИЛ-6 были выше (р=0,01) на 42,6% у пациентов с возрастным гипогонадизмом по сравнению с пациентами с нормальным уровнем Т (рис. 4). Это может говорить о тесной связи между уровнем данного цитокина и Т. Учитывая то, что ИЛ-6 активирует процессы липолиза в висцеральной жировой ткани, а также способствует прогрессирующему развитию жирового гепатоза и системного атеросклероза [7], можно расценивать повышение показателя ИЛ-6 как предиктор метаболических осложнений.
![]()
![]()
Выводы
Дефицит Т у мужчин с СД 2 типа связан с биохимическими процессами, отражающими наличие эндотелиальной дисфункции.
Одновременное повышение уровня маркеров эндотелиальной дисфункции и провоспалительных цитокинов указывает на вероятность возрастания сердечно-сосудистого риска у мужчин с дефицитом половых гормонов и СД 2.
Выявление значительно повышенной концентрации резистина, ICAM-1, ФНО-α, ИЛ-6 у больных с СД 2 типа и дефицитом половых гормонов может служить основой для изучения их роли в качестве предикторов развития сердечно-сосудистых заболеваний и других сосудистых осложнений на ранней стадии их формирования.
Благодарности
Работа выполнена при поддержке Российского научного фонда, в рамках гранта № 14-25-00052.
Рецензенты:
Яковлев А.А., д.м.н., профессор, зав.кафедрой гастроэнтерологии и эндоскопии с курсом клинической фармакологии ФПК и ППС ГБОУ ВПО РостГМУ Минздрава России, г.Ростов-на-Дону;
Кастанаян А.А., д.м.н., профессор, зав.кафедрой внутренних болезней №2 с основами физиотерапии ФПК и ППС ГБОУ ВПО РостГМУ Минздрава России, г.Ростов-на-Дону.
Библиографическая ссылка
Дзантиева Е.О., Хрипун И.А., Воробьев С.В., Гусова З.Р., Пузырева В.П., Ибишев Х.С., Белоусов И.И., Черный А.А., Коган М.И. ВЛИЯНИЕ ПОЛОВЫХ ГОРМОНОВ НА ФОРМИРОВАНИЕ ЭНДОТЕЛИАЛЬНОЙ ДИСФУНКЦИИ И ДИСБАЛАНС ЦИТОКИНОВ У МУЖЧИН С САХАРНЫМ ДИАБЕТОМ 2 ТИПА // Современные проблемы науки и образования. 2015. № 6. ;URL: https://science-education.ru/ru/article/view?id=23526 (дата обращения: 06.01.2026).



