На инфузионную терапию при ОРДС существует довольно много противоречивых взглядов. Большинство авторов склоняются к мнению, что инфузионная нагрузка должна быть минимизирована до уровня, необходимого для обеспечения потребности в жидкости [5]. Коллоидные растворы рекомендуется использовать только на начальном этапе терапии шоковых состояний для восполнения объема циркулирующей крови [4]. В настоящее время довольно интенсивноизучается такое направление инфузионной терапии, как применение гиперосмолярных солевых растворов (как изолированно, так и в сочетании с коллоидами). В экспериментальных работах было установлено, что внутривенное введение гиперосмолярных солевых растворов изменяет проницаемость капилляров и стабилизирует капиллярный барьер лёгких [4, 7]. Было показано, что комбинация гипертонического раствора натрия хлорида с растворами ГЭК предотвращает нарушение оксигенирующей функции легких и улучшает доставку кислорода в позднем периоде шока [4]. Механизм протекторного действия гипертонических растворов при шоке связан с тем, что эти препараты предохраняют легочную ткань от повреждения пероксидом водорода, тромбином, фактором некроза опухолей и другими химическими и биологическими агентами, усиливая их отток из легочного интерстиция [3, 1]. Учитывая роль данных факторов в патогенезе ОРДС, можно предположить, что комбинированные гиперосмолярные растворы могут оказаться эффективными на ранних стадиях развития ОПЛ/ОРДС, связанного с непосредственным воздействием повреждающего агента на легочную ткань.
Цель работы
Оценка влияния гипертонического раствора хлорида натрия и препарата ГиперХАЕС на уровень летальности, оксигенацию и кислотно-основное состояние крови у крыс при остром повреждении лёгких.
Методика исследования
Эксперимент проводили на белых беспородных крысах обоего пола массой 220–300 г. (питомник «Столбовая», ФГБУ «Научный центр биомедицинских технологий» РАМН). Все исследования выполнялись с соблюдением норм и правил проведения экспериментов с участием животных (решение ЛЭК ФГБОУ ВПО «МГУ им.Н.П.Огарева» от 12.07.2013 г., протокол № 72). В эксперимент было включено 64 крысы (40 самцов и 24 самки). Животных разделили на 4 группы по 16 особей (10 самцов и 6 самок) в каждой. Всем крысам под уретановым внутрибрюшинным наркозом (400 мг/кг) производили моделирование острого повреждения легких путем интратрахеального введения 0,1 мл/кг ацетона. Всем животным после моделирования ОПЛ/ОРДС с целью профилактики инфекционных осложнений вводили цефтриаксон в дозе 100 мг/кг внутримышечно 1 раз в сутки в течение 6 дней. Животные 1-ой группы (контроль) другого лечения не получали. Животным опытных групп проводили терапию, которая заключалась в однократном внутривенном введении исследуемых препаратов через 1 ч после интратрахеального введения ацетона. Крысам 1-ой опытной группе вводили дексаметазон (раствор для инъекций 0,4%, KRKA, Словения) в дозе 6 мг/кг, во 2-й – 7,5% раствор хлорида натрия в объёме 4 мл/кг (получали разбавлением 10 % раствора натрия хлорида, ООО «БиоХимФарм», Россия), в 3-й – препарат ГиперХАЕС (раствор гидроксиэтилкрахмала для инфузий 6%, ФрезениусКабиДойчландГмбХ, Германия) в дозе 4 мл/кг. Животным контрольной группы не вводили физиологический раствор, потому что в данном случае физиологический раствор, вводимый в дозах, сопоставимых с объёмами других, исследованных средств (гипертонический раствор хлорида натрия и ГиперХАЕС) не будет являться индифферентным агентом, а оказывает собственное весьма выраженное действие. В дозе 4мл/кг физиологический раствор изменяет объём циркулирующей крови и может усилить интерстициальный отёк лёгких за счёт фильтрации в лёгочный интерстиций в условиях повышенной капиллярной проницаемости. Животные забивались на 7-е сутки после начала эксперимента под уретановым наркозом. Для оценки эффективности изучаемых методов терапии фиксировали летальность на протяжении 6 сут от момента моделирования ОПЛ/ОРДС, определяли процент снижения смертности. Процент снижения смертности рассчитывали следующим образом: D(C)=(Ск-Со)/Ск*100, где Ск и Со – смертность в контрольной и опытной группах соответственно. Также определяли частоту дыхания (ЧД), показатели кислородного статуса и кислотно-основного состояния. Показатели кислотно-основного состояния определяли в капиллярной крови на анализаторе Easy blood gas (Израиль), сатурацию гемоглобина (SpO2) оценивали с помощью пульсоксиметра для экспериментальных исследований животных BiopacSystems МР 150 (CША). Регистрировались: парциальное давление кислорода (рО2) и углекислого газа (рСО2), водородный показатель (рН), а также избыток (дефицит) оснований (base excess – ВЕ). Показатели регистрировали до интратрахеального введения ацетона, через 1 ч, 24 ч и 6 сут после моделирования ОПЛ/ОРДС.
Статистическую обработку результатов проводили с использованием t-критерия Стьюдента и критерия Хи-квадрат. Значимыми считали различия при р< 0,05. По ходу изложения статистические показатели обозначены следующими символами: М – среднее значение; m – ошибка среднего, р0 – отличие от аналогичного показателя на исходном этапе; рk – отличие от аналогичного показателя контрольной группы.
Результаты и обсуждение
Летальность. Летальность в группах экспериментальных животных представлена на рис 1. Целесообразность отдельной оценки летальности на ранних сроках наблюдения связана с тем, что при выбранной методике эксперимента на 1-е сутки, как правило, смерть животных наступает на фоне токсического отека легких, профилактика и купирование которого во многом определяют эффективность последующей терапии.
После аспирации ацетона в первые сутки в контрольной группе (без лечения) погибли 62,5 % животных. Летальность у животных, которым вводили дексаметазон, составила 31,3%, в группах с введением 7,5% раствора NaCl и ГиперХАЕС – 43,8% и 25% соответственно (pk<0,001 во всех группах).
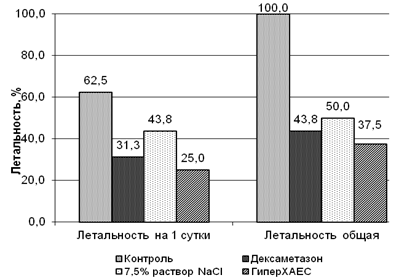
Рис. 1. Летальность животных на фоне исследованных схем терапии
Снижение частоты летальных исходов на 1-е сутки в опытных группах позволяет предположить, что все использованные схемы в той или иной степени предупреждают развитие токсического отека легких, индуцированного аспирацией ацетона.
На момент окончания эксперимента (6-е сутки) в контрольной группе все животные погибли. Летальность в группе, где применялся дексаметазон, составила 43,8 %, а после введения 7,5% раствора NaCl и раствора ГиперХАЕС летальность составила 50 и 37,5% соответственно (pk<0,001 для всех групп). На 6-е сутки эксперимента во всех опытных группах уровень летальности достоверно отличался от такового в контроле, а различия по летальности между группами, с применением схем терапии были статистически незначимыми.
Результаты исследования оксигенирующей функции легких представлены в таблице 1. Аспирация ацетона приводила к развитию тяжелой гипоксемии у всех животных. Уровень рО2 уменьшался до 43,7±3,2 – 50,9 ± 2,0 мм рт. ст., аSpО2 – до 72,3±2,2 – 77,0±6,6 % (во всех группах изменения статистически достоверны, p0<0,01-0,05). Гипоксемия, развивавшаяся непосредственно после аспирации ацетона, носила вентиляционный характер, поскольку сопровождалась гиперкапнией и дыхательным ацидозом. Уровень рСО2 составлял 46,8±5,8 – 55,8±8,0 мм рт. ст. (для всех групп p0<0,01-0,05). Гиповентиляция наиболее вероятно развивалась в результате бронхообструкции и токсического угнетения дыхательного центра. Динамика параметров оксигенации на фоне исследуемых схем терапии различалась. Наиболее выраженными нарушения оксигенации были в контрольной группе. Через сутки после моделирования ОПЛ/ОРДС гиповентиляция купировалась, уровень рСО2 снижался до 29,5±5,9 мм рт. ст., но при этом отмечалась выраженная гипоксемия и связанный с ней метаболический ацидоз (рО2=55,8±0,8 мм рт. ст., рН=7,289±0,002 ед., ВЕ= -11,3±1,8 ммоль/л). В контрольной группе до 6-х суток наблюдения не дожило ни одно животное. Для группы животных, получавших дексаметазон, на всех этапах наблюдения характерным было значимое увеличение частоты дыхания. Увеличение частоты дыхания сопровождалось гипокапнией. Уже через 1 ч после введения дексаметазона регистрировалось тахипноэ до 106±6,8 в мин. Это приводило к снижению рСО2 до 21,5±8,5 мм рт. ст. и переходу респираторного ацидоза в респираторный алкалоз (рН=7,468±0,007 ед.). Уровень pО2 при этом оставался низким (57,2±2,8 мм рт. ст., p0<0,05). Спустя 24 часа тахипноэ и гипокапния сохранялись, содержание кислорода возросло до 72,4±2,2 мм рт. ст. (p0<0,05). На 6-е сутки на фоне гипервентиляции регистрировалось уменьшение pО2 до 55,5±1,0 мм рт. ст., а также снижение рН и BE до 7,356±0,9 ед. и -9,3±1,6 ммоль/л (р<0,05). Животные в группах, которым вводили инфузионные растворы, имели схожие изменения кислородного статуса крови. Спустя 1 час после введенияисследуемых препаратов ЧД и показатели КОC восстанавливались до нормы, однако гипоксемия сохранялась: уровень рО2 составил 58,5±2,5 и 55,4±1,6 мм рт. ст.
Таблица 1
Показатели оксигенации и кислотно-основного состояния крови крыс на фоне исследованных схем терапии (M+m)
|
Группа |
Показатель |
Значения показателей на этапах исследования |
|||||
|
Исходный этап |
1 ч после аспирации ацетона |
1 ч после начала лечения |
24 ч после начала лечения |
6-е сутки после начала лечения |
|||
|
Контроль |
ЧД , дых/мин 1 |
85,7±6,1 |
54,4±7,55 * |
56,4±7,0* |
88,2±7,5 |
- |
|
|
рО2, мм рт.ст. 2 |
77,3±0,9 |
43,7±3,2 *** |
45,9±2,8*** |
55,8±0,8** |
- |
||
|
рСО2, мм рт.ст3. |
33,1±2,3 |
55,8±8,9 |
54,7±11,2 |
29,5±5,9 |
- |
||
|
рН, ед. 4 |
7,371±0,006 |
7,224±0,009 *** |
7,223±0,001*** |
7,289±0,002*** |
- |
||
|
SрO2, % 5 |
95,7±0,63 |
73,4±1,2 *** |
78,4±1,67*** |
86±2,16** |
- |
||
|
ВЕ, ммоль6/л |
-5,5±0,36 |
-4,0±0,56 |
-4,7±1,0 |
-11,3±1,8 |
- |
||
|
Дексаметазон 6 мг/кг |
ЧД, дых/мин |
82,7±5,2 |
60,8±2,3 |
106,1±6,8* xxx |
106,1±9,5* |
101,0±6,48 |
|
|
рО2, мм рт.ст. |
80,1±3,4 |
48,7±3,0 *** |
57,2±2,8***xx |
72,4±2,2 |
55,5±1,0*** |
||
|
рСО2, мм рт.ст. |
31,5±8,1 |
49,0±9,1 |
21,5±8,5 |
24,7±4,3 |
27,4±4,0 |
||
|
рН, ед. |
7,364±0,003 |
7,229±0,008 * |
7,468±0,007 |
7,398±0,009 |
7,356±0,009 |
||
|
SрO2, % |
97,2±1,1 |
72,3±2,2 |
86,8±2,16***xx |
94±1,34 |
85,8±1,32*** |
||
|
|
ВЕ, ммоль/л |
-6,7±0,25 |
-6,5±0,89 |
-7,5±0,56 |
-8,8±1,8 |
-9,3±1,6 |
|
|
Раствор натрия хлорида 7,5% 4 мл/кг |
ЧД, дых/мин |
83,1±2,1 |
56,5±2,5 *** |
80,6±7,4 x |
73,2±6,7 |
90,7±16,6 |
|
|
рО2, мм рт.ст. |
79,3±2,9 |
49,1±3,8*** |
58,5±2,5***xx |
71,6±1,7 |
61,1±1,3** |
||
|
рСО2, мм рт.ст. |
32,9±9,13 |
51,8±8,4 |
40,5±8,5 |
36,4±3,9 |
27,3±6,0 |
||
|
рН, ед. |
7,361±0,009 |
7,192±0,006* |
7,301±0,005 |
7,289±0,002 * |
7,286±0,006* |
||
|
SрO2, % |
96,1±3,6 |
74,3±10,1*** |
87,6±1,29***xx |
93,7±3,16 |
89±0,2** |
||
|
ВЕ, ммоль/л |
-6,2±1,1 |
-7,3±1,2 |
-5,7±2,1 |
-8,2±3,0 |
-12,4±3,1** |
||
|
ГиперХАЕС 4 мл/кг |
ЧД, дых/мин |
73,1±2,0 |
51,7±11,2 |
89±6,3xx |
80±2,85 |
71,8±13,03 |
|
|
рО2, мм рт.ст. |
77,3±2,1 |
50,9±2,0** |
55,4±1,6** |
64,5±0,5** |
55,8±2,5** |
||
|
рСО2, мм рт.ст. |
39,5±9,0 |
46,8±5,8 |
37,9±5,7 |
29,7±5,7 |
38,8±5,8 |
||
|
рН, ед. |
7,359±0,001 |
7,246±0,005* |
7,334±0,009 |
7,329±0,008 |
7,220±0,004* |
||
|
SрO2, % |
95,4±5,0 |
77,0±6,6** |
85,75±1,98** |
90,7±2,33** |
86±5,3** |
||
|
ВЕ, ммоль/л |
-5,4±0,65 |
-6,2±0,8 |
-5,1±0,54 |
-9,4±0,9 |
-10,5±1,6* |
||
Примечание: 1 – ЧД – частота дыхания; 2 – рО2 – парциальное давление кислорода; 3 – рСО2 – парциальное давление углекислого газа, 4 – рН – водородный показатель, 5 – SpO2– сатурация гемоглобина; 6 – ВЕ (baseexcess) – избыток (дефицит) оснований; * – р0<0,05; ** – р0<0,01; *** – р0<0,001; x – рk<0,05; xx – рk<0,01; xxx – рk<0,001;
в группах натрия хлорида 7,5% и ГиперХАЕСа соответственно.
В данных группах не регистрировалось выраженного тахипноэ, уровень рСО2 оставался в рамках нормальных значений на всех этапах наблюдения. В группе животных, получавших хлорид натрия, уровень рО2 на 6-е сутки был наибольшим и составил 61,1±1,3 мм рт. ст., а в группе ГиперХАЕСа рО2 составило 55,8±2,5 мм рт. ст. Также у большинства животных, получавших гипертонические растворы, регистрировался метаболический ацидоз (рН=7,286±1,6 ед. на фоне введения хлорида натрия 7,5% и 7,220±1,0 ед. на фоне ГиперХАЕСа; ВЕ =-12,4±3,1 и -10,5±1,6 ммоль/л соответственно). Метаболический ацидоз к моменту окончания эксперимента во всех исследованных группах, вероятно, развивался из-за накопления недоокисленных продуктов на фоне длительной системной гипоксии. В группе, получавшей дексаметазон, в отличие от групп, получавших гипертонические растворы (хлорид натрия и ГиперХAEC), ацидоз был компенсированным за счет гипервентиляции, и сдвиг рН в кислую сторону был не столь выраженным.
Анализируя полученные результаты, нужно отметить, что все исследуемые схемы улучшают результаты лечения ОПЛ/ОРДС, снижают общую смертность и смертность на ранних этапах лечения. Они препятствуют на ранних этапах развития ОПЛ прогрессированию токсического отека легких и снижают степень гиповентиляции. На поздних этапах они уменьшают выраженность интерстициальной легочной гидратации и связанных с ней диффузионных нарушений. Механизмы эффектов исследованных схем могут быть различными.
Что касается дексаметазона, то механизм его действия достаточно хорошо изучен: он уменьшает продукцию и эффекты провоспалительных цитокинов, пирогенов, коллагеназы, эластазы и активаторов плазминогена. Кроме того, он угнетает взаимодействие Т- и В-лимфоцитов, тормозит выделение гистамина из тучных клеток.
Терапевтический эффект хлорида натрия 7,5% и ГиперХAECа не столь ясен. На настоящий момент имеется несколько теорий, объясняющих легочно-протективный эффект этих препаратов. При геморрагическом шоке он обусловлен более ранним восстановлением системного кровообращения, и соответственно, меньшим гипоксическим повреждением органов-мишеней, в том числе и легких [4]. При первичном легочном повреждении, которое имело место в использованной модели, одним из возможных путей реализации протекторного эффекта может быть увеличение скорости циркуляции внеклеточной воды в легких, что, в свою очередь, приводит к снижению эффективной концентрации в тканевой жидкости легких различных агентов, индуцирующих повреждение альвеоло-капиллярной мембраны [4].
Учитывая, что повреждающий агент действует относительно кратковременно, можно предположить, что купирование токсического повреждения в момент максимальной активности повреждающих факторов предупреждает дальнейшее прогрессирование патологических изменений в легких. Очевидно, механизмы терапевтического эффекта гипертонических растворов требуют дальнейшего изучения, однако результаты экспериментов свидетельствуют о перспективности применения растворов натрия хлорида 7,5% и ГиперХАЕСа для профилактики ОРДС на ранних стадиях воздействия провоцирующего фактора.
Выводы
При экспериментальном, остром респираторном дистресс-синдроме у крыс дексаметазон, 7,5% раствор хлорида натрия и ГиперХАЕС достоверно снижают общую смертность на 56, 50 и 63% (pk<0,001), а также смертность в первые сутки после моделирования патологии на 50, 30 и 60 % соответственно (pk<0,001).
У крыс с экспериментальным острым респираторным дистресс-синдромом применение 7,5% раствора хлорида натрия и ГиперХАЕСа сопровождается эквиэффективным улучшением оксигенации крови через 1 час после начала терапии в виде достоверного увеличения рО2 на 21 – 27% (pk<0,05) и сатурации гемоглобина на 9–12% (pk <0,05).
Рецензенты:Зорькина А.В., д.м.н., профессор, зав. кафедрой поликлинической терапии и функциональной диагностики, МГУ им. Н.П. Огарёва, г. Саранск.
Котляров А.А., д.м.н., профессор, зав. кафедрой внутренних болезней, ИАТЭ НИЯУ «МИФИ» Минобрнауки России, г. Обнинск.
Библиографическая ссылка
Куликов О.А., Инчина В.И., Зырняева Н.Н., Заборовский А.В., Минаева О.В., Кокорев А.В., Фирстов С.А. ВЛИЯНИЕ ГИДРОКСИЛИРОВАННОГО КРАХМАЛА И ГИПЕРОСМОЛЯРНЫХ КРИСТАЛЛОИДНЫХ КРОВЕЗАМЕНИТЕЛЕЙ НА ПОКАЗАТЕЛИ ОКСИГЕНАЦИИ ПРИ ОСТРОМ ПОВРЕЖДЕНИИ ЛЁГКИХ // Современные проблемы науки и образования. 2015. № 6. ;URL: https://science-education.ru/ru/article/view?id=23400 (дата обращения: 07.01.2026).



