Сосудистые осложнения при ТХПН могут объясняться действием двух различных, но взаимосвязанных процессов, именуемых атеросклерозом и артериосклерозом. При этом развитие атеросклероза обусловлено в большей степени действием «традиционных» факторов риска. Артериосклероз у больных на гемодиализе развивается на фоне нарушения фосфорно-кальциевого обмена и нестабильного волюметрического статуса и характеризуется повышенной жесткостью сосудистой стенки [3]. В качестве критерия оценки эластических свойств сосудистой стенки используется скорость пульсовой волны (СПВ). Существуют ограниченные данные о выживаемости больных, находящихся на программном ГД, в зависимости от изменения показателя СПВ [7].
Другим малоисследованным фактором риска ССС у диализных пациентов является дисбаланс вегетативной нервной системы, в частности снижение вариабельности сердечного ритма (ВСР), что является риском возникновения фатальных желудочковых аритмий в общей популяции и у некоторых категорий больных [8].
Выявление новых факторов риска ССС у больных, находящихся на программном ГД, при помощи неинвазивных доступных методов имеет большую научно-практическую значимость, поскольку может способствовать совершенствованию подходов к лечению данной категории пациентов и позволит улучшить отдаленные результаты диализной терапии.
Цель исследования
Оценить выживаемость больных, находящихся на программном ГД, в зависимости от показателей СПВ и ВСР.
Материал и методы исследования
В исследование были включены 83 пациента с ТХПН, находящихся на программном ГД. Исследование проводилось с января 2011 г. по декабрь 2014 г. Пациенты наблюдались на базе БУЗОО «ГКБ № 1 им. Кабанова А.Н.» в отделении амбулаторного диализа. В исследование не были включены пациенты с сахарным диабетом, тяжелыми нарушениями ритма и систолической дисфункцией левого желудочка (ФВ менее 55%). ГД проводился по стандартной программе (3 раза в неделю по 4–4,5 ч) на аппаратах «искусственная почка» Innova фирмы «Gambro» с использованием бикарбонатного диализирующего раствора. Всем пациентам выполнялось общеклиническое исследование, включавшее расспрос, физикальные, лабораторные и инструментальные методы исследования. Исследование ВСР осуществлялось на аппаратно-программном комплексе «ВНС-микро» («НейроСофт», Иваново). Пациентам была выполнена 5-минутная ЭКГ в положении лежа и в ортостазе. Рассчитывались временные (SDNN, RMSSD, pNN50) и частотные (TP, LF, HF, VLF, LF/HF) показатели ВСР [6]. Исследование жесткости сосудистой стенки артерий осуществлялось с помощью прибора Pulse Trace PCA 2000. Оценивалась СПВ, регистрируемая при фотоплетизмографии [2]. Статистический анализ осуществлялся с использованием пакета STATISTICA 6.0 (русифицированная версия) и возможностей программы Microsoft Excel. Результаты считались значимыми при р<0,05. Характер распределения признаков определялся визуально и методом Шапиро—Уилка. Рассчитывались средние величины и стандартное отклонение (М±s) при нормальном распределении признака, медиана и квартили (Ме (Р25; Р75)) при распределении, отличном от нормального. Для сравнения переменных использовались непараметрические методы статистической обработки данных: U-критерий Манна—Уитни для сравнения двух независимых групп. Анализ выживаемости проводился по кривым Каплана—Майера.
Результаты исследования и их обсуждение
В исследовании приняли участие 83 пациента, из них 43 (52%) мужчины и 40 (48%) женщин в возрасте 56 (43–61) лет. Длительность ГД составила 37 (14–66) месяцев. Характеристика пациентов представлена в таблице 1.
Таблица 1
Характеристика пациентов по основным клиническим,
лабораторным и инструментальным показателям (n=83)
|
Показатель |
Значение |
|
Длительность АГ, мес. |
132 (84; 240) |
|
Систолическое АД, мм рт. ст. |
140 (120; 150) |
|
Диастолическое АД, мм рт. ст. |
80 (70;90) |
|
ИМТ, кг/м2 |
25,2 (22,3; 29,3) |
|
Гемоглобин, г/л |
105 (92; 115) |
|
Альбумин, г/л |
39,5 (37; 42) |
|
Креатинин, мкмоль/л |
670 (570; 780) |
|
Фосфор, ммоль/л |
1,65 (1,32; 1,9) |
|
Хс общ., ммоль/л |
4,5 (3,7; 5,6) |
|
Паратиреоидный гормон, |
24,9 (13,0; 64,9) |
|
Индекс относительной толщины стенки ЛЖ |
0,42 (0,38; 0,51) |
|
Индекс массы миокарда ЛЖ, г/м2 |
190,95±57,2 |
|
Фракция выброса ЛЖ, % |
66,3±5,74 |
|
СПВ, м/с |
9,3 (8,2; 10,7) |
|
ТРо, мс2 |
578 (184; 888) |
Примечание: ГД – гемодиализ, ЛЖ – левый желудочек; КДОИ – конечный диастолический объем, индексированный к площади поверхности тела, КСОИ — конечный систолический объем, индексированный к площади поверхности тела, СПВ – скорость пульсовой волны, ТРо – показатель общей мощности (total power) спектра ВСР в ортостазе
Из представленных данных следует, что пациенты, находящие на программном гемодиализе, имели повышенные уровни креатинина, паратиреоидного гормона, фосфора, пониженный уровень гемоглобина, что характерно для данной популяции и отражает изменение гомеостаза, связанное с нарушением функции почек. Подавляющее большинство пациентов имели эхокардиографические признаки гипертрофии ЛЖ. Значение СПВ превышало должные значения (СПВдолжн.7,58 (7,12; 8,24), р=0,013), кроме того, отмечалось существенное снижение показателя общей мощности спектра ВСР в ортостазе.
В течение четырехлетнего периода наблюдения умерло 28 (33,7%) больных. В структуре причин смерти преобладали ССС (18 случаев / 64,3%) – ОНМК (7 / 8,4%), внезапная сердечная смерть (6 / 7,2%), острый инфаркт миокарда (4/4,8%), окклюзирующий атеросклероз сосудов нижних конечностей, осложненный гангреной (1 / 1,2%). С целью выявления факторов, оказавших влияние на смерть от ССС у больных, находящихся на гемодиализе, был выполнен сравнительный анализ между группами умерших от ССС (подгруппа 1) и остальными пациентами (подгруппа 2). Между подгруппами не было статистически значимых различий по возрасту, ИМТ, стажу диализа и АГ, уровню АД, показателям гемоглобина, альбумина, фосфора и паратиреоидного гормона. Подгруппа умерших от ССС больных имела статистически значимо более низкий уровень общего холестерина и более высокие значения СПВ. Кроме того, у больных, умерших от ССС, большинство показателей ВСР в ортостазе были достоверно более низкими (табл. 2).
Таблица 2
Сравнительный анализ между подгруппами больных
|
|
Подгруппа 1, n=18 |
Подгруппа 2, n=65 |
p |
|
Возраст, лет |
54,5 (44; 60) |
55 (43; 61) |
0,981 |
|
ИМТ |
24,6 (23,0; 30,7) |
25,2 (22,1; 29,2) |
0,854 |
|
Стаж диализа, мес. |
40,5 (20,0; 82,5) |
34 (9; 56) |
0,097 |
|
Длит. АГ, мес. |
200±125,1 |
159±101,3 |
0,222 |
|
АД сист., мм рт. ст. |
150 (120; 160) |
140 (120; 150) |
0,109 |
|
АД диаст. мм рт. ст. |
90 (80; 90) |
80 (70; 90) |
0,052 |
|
Гемоглобин , г/л |
105 (86; 119) |
106 (95; 115) |
0,851 |
|
Альбумин, г/л |
39 (36; 42,4) |
40 (37; 43) |
0,433 |
|
Фосфор, ммоль/л |
1,72±0,45 |
1,60±0,45 |
0,391 |
|
Хс общ., ммоль/л |
4,0±1,0 |
5,0±1,4 |
0,001 |
|
ПТГ, пмоль/л |
23,0 (19; 33,5) |
22,7 (6,1; 65,5) |
0,585 |
|
СПВ, м/с |
10,7(9,3; 12,1) |
9,2 (8,0; 10,2) |
0,009 |
|
SDNN, мс |
15 (12; 18) |
21 (15; 29) |
0,018 |
|
TP, мс2 |
275 (171; 447) |
514 (230; 861) |
0,026 |
|
VLF, мс2 |
144 (121; 215) |
271 (136; 318) |
0,092 |
|
LF, мс2 |
108 (26,8; 164) |
76,1 (51,6; 227,5) |
0,273 |
|
HF, мс2 |
33,5 (23; 37,7) |
73,1 (28,7; 195) |
0,013 |
|
LF/HF |
3,1 (0,7; 5,3) |
1,3 (0,7; 2,6) |
0,060 |
|
SDNNo, мс |
11,0 (9,0; 20) |
25,0 (17,0; 32,0) |
0,001 |
|
TPo, мс2 |
169 (113; 664) |
579 (265; 1021) |
0,002 |
|
VLFo, мс2 |
121 (95,7; 624) |
371 (170; 641) |
0,009 |
|
LFo, мс2 |
34 (16,6; 62,2) |
91,5 (36,3; 224,5) |
0,002 |
|
HFo, мс2 |
13,4 (2,9; 26,8) |
41,2 (12,2; 142) |
0,006 |
|
LF/HFo |
2,5 (2,2; 4,4) |
2,7 (1,1; 5,9) |
0,557 |
Из показателей ВСР при фоновой записи не все параметры частотного анализы имели статистически значимые различия в подгруппах больных, поэтому для анализа выживаемости был выбраны показатель общей мощности спектра в ортостазе (ТРо). Другие показатели частотного анализа ВСР в ортостазе не использовались, так как параметры VLFo, LFo, HFo являются составляющими ТРо, а SDNNо высоко коррелирует с ТРо, является временным показателем и имеет вспомогательное значение при коротких (5-минутных) записях ЭКГ. Также для проведения анализа выживаемости был взят показатель СПВ. Предварительно больные были разделены в зависимости от значений СПВ и ТРо по квартилям.
Анализ выживаемости по кривым Каплана—Майера в зависимости от СПВ показал, что больные верхнего квартиля (СПВ>10,7 м/с) имели достоверно более низкую выживаемость по сравнению с больными первого и второго квартилей (СПВ<9,3 м/с) (рис. 1).
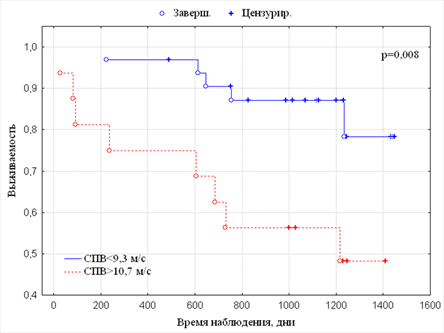
Рис. 1. Выживаемость больных, находящихся на программном гемодиализе, в зависимости от СПВ
При построении кривых Каплана—Майера в зависимости от ТРо отмечено, что больные первого и второго квартилей (ТРо<578 мс2) имели достоверно более низкую выживаемость, чем больные верхнего квартиля (ТРо>888 мс2) (рис. 2).
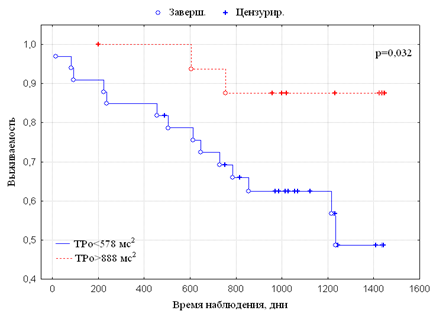
Рис 2. Выживаемость больных, находящихся на программном гемодиализе, в зависимости от показателя общей мощности спектра ВСР в ортостазе (ТРо)
Таким образом, проведенный анализ выживаемости демонстрирует, что повышение СПВ и снижение показателя общей мощности спектра ВСР в ортостазе ассоциируются с достоверным увеличением смертности больных, находящихся на программном ГД, от сердечно-сосудистых событий.
В исследовании применены неинвазивные и доступные в клинической практике методы инструментального обследования больных на программном гемодиализе, относящихся к категории очень высокого сердечно-сосудистого риска: СПВ оценена по контурному анализу периферической пульсовой волны, регистрируемой при фотоплетизмографии; исследование ВСР проведено при 5-минутной записи ЭКГ, при этом показана высокая диагностическая значимость выполнения ортостатической пробы. Результаты исследования показали высокую прогностическую значимость показателей СПВ и ТРо в аспекте сердечно-сосудистой выживаемости больных, находящихся на программном ГД.
Заключение
Применение результатов неинвазивных методов исследования позволяет оценить выживаемость больных, находящихся на программном гемодиализе, с учетом показателей функционального состояния сердечно-сосудистой системы. Предложенные методы могут быть использованы для дополнительного обследования данной категории больных.
Рецензенты:Совалкин В.И., д.м.н., профессор, заведующий кафедрой госпитальной терапии с курсом эндокринологии ГБОУ ВПО «Омский государственный медицинский университет» Минздрава России, г. Омск;
Викторова И.А., д.м.н., профессор, заведующая кафедрой внутренних болезней и поликлинической терапии ГБОУ ВПО «Омский государственный медицинский университет» Минздрава России, г. Омск.
Библиографическая ссылка
Билевич О.А., Овсянников Н.В. ОЦЕНКА ВЫЖИВАЕМОСТИ БОЛЬНЫХ, НАХОДЯЩИХСЯ НА ПРОГРАММНОМ ГЕМОДИАЛИЗЕ, В ЗАВИСИМОСТИ ОТ ПОКАЗАТЕЛЕЙ ФУНКЦИОНАЛЬНОГО СОСТОЯНИЯ СЕРДЕЧНО-СОСУДИСТОЙ СИСТЕМЫ // Современные проблемы науки и образования. 2015. № 6. ;URL: https://science-education.ru/ru/article/view?id=23372 (дата обращения: 07.02.2026).



