У пациентов с сочетанной травмой при реконструктивных операциях методами выбора анестезии являются общая ингаляционная анестезия, тотальная внутривенная анестезия и регионарная анестезия [1,3,5,6,8]. В послеоперационном периоде анальгезия проводится, как правило, с использованием центральных анальгетиков [4].
Вопрос целесообразности применения НПВП в качестве средства упреждающей анальгезии после реконструктивных операций у больных с сочетанной травмой, а также вопрос эффективности самой концепции упреждающей анальгезии в настоящее время по-прежнему остаётся открытым [7]. В доступной нам литературе мы не нашли данных о применении с этой целью у данной категории больных декскетопрофена.
Цель исследования: изучить влияние упреждающей анальгезии декскетопрофеном на динамику болевого синдрома в послеоперационном периоде в зависимости от выбранного метода анестезии.
Материалы и методы исследования: обследовано 120 пациентов обоего пола в возрасте от 18 до 65 лет, средний возраст 34 (29-45) года. Все больные в зависимости от применения упреждающей анальгезии были разделены на 2 группы по 60 человек, каждая из которых в свою очередь, была поделена на 3 подгруппы по 20 человек каждая, в зависимости от вида выбранной анестезии.
Группа 1А – ингаляционная анестезия (ИА). Для проведения ингаляционной анестезии использовали наркозно дыхательный аппарат “GE Avance” (США). Индукцию проводили с помощью дипривана, фентанила и недеполяризующего миорелаксанта рокурония бромида в рекомендуемых дозировках. Для ИА применяли севофлуран по общепринятой методике.
Группа 1Б – региональная анестезия (РА). Обезболивание проводили по методике комбинированной спино - эпидуральной анестезии (КСЭА). Для выполнения спинальной анестезии использовали бупивакаин в расчете на рост, а для продленной эпидуральной анестезии применяли ропивакаин в рекомендуемых дозировках.
Группа 1В – тотальная внутривенная анестезия (ТВВА). Применяли диприван, фентанил и недеполяризующий релаксант рокурония бромид в рекомендуемых дозировках.
Группа 2А – упреждающая анальгезия (УА) с использованием декскетопрофена в дозировке 50 мг в/в. Ингаляционную анестезию проводили по методике, аналогичной группе 1А.
Группа 2Б – упреждающая анальгезия (УА) с использованием декскетопрофена в дозировке 50 мг в/в. Регионарную анестезию проводили по методике, как в группе 1Б.
Группа 2В – упреждающая анальгезия с использованием декскетопрофена в дозировке 50 мг в/в. Тотальную внутривенную анестезию проводили по той же методике, что и в группе 1В.
Послеоперационное обезболивание проводилось по принятой в клинике методике: трамадолом по 100 мг х 3 раза в день, при необходимости добавлялся промедол по 20 мг внутримышечно.
Обследование проводилось на 4 этапах. 1-й этап - перед операцией, 2-й этап – после формирования анестезии, непосредственно после разреза кожи, 3-й этап – после перевода пациента в палату, 4-й этап – на следующий день через 24 часа после операции. Изучались бальная оценка выраженности боли по ВАШ, уровень кортизола крови с помощью иммуноэлектрохемилюминесцентного (ИЭХЛ) метода на анализаторе “Hitachi Elecsys 2010” (Германия) и показатели гемодинамики (СрАД, ЧСС) на мониторе пациента “Кардекс МАР-03” (Россия).
Статистическая обработка полученных результатов произведена с помощью параметрических и непараметрических методов статистики. Средние значения представлены в виде М±m или Me (P25 – P75). Нормальность выборки проверена с помощью стандартного отклонения от среднего значения. Достоверность различия сравниваемых значений проверена с помощью критерия Стьюдента или критерия Вилкоксона. Достоверным считали различие значений при р≤0,05.
Результаты исследования и их обсуждение
При анализе выраженности боли по ВАШ было установлено, что у всех больных в 1-й и 2-й группах перед операцией имелся умеренно-выраженный болевой синдром. Средние значения в группах составляли от 1,95±0,08 до 2,35±0,1 баллов.
В 1-й группе минимальные значения баллов послеоперационной боли на 3-м этапе отмечали у пациентов в группе 1В (ТВВА) – 0,6±0,01 балла и у пациентов в группе 1Б (регионарная анестезия). В тоже время на 4-м этапе меньшие значения баллов отмечали у больных в группе 1Б – 3,75±0,15, а у больных в группе 1В – большие значения – 5,75±0,2 баллов. Вместе с тем у больных в группе 1А (ингаляционная анестезия) на 3-м этапе отмечали большие значения баллов по ВАШ – 4,45±0,2, а на 4-м этапе – бальная оценка достоверно не отличалась от значений выраженности боли у пациентов в группе 1В. Наименьшая суммарная доза аналгетиков использовалась у пациентов в группе 1Б – трамадола 4500 мг, промедола 20 мг. В группах 1А и 1В по 6000 мг и 5000 мг трамадола, 140 и 160 мг – соответственно. Таким образом, динамика послеоперационной боли после регионарной анестезии характеризовалась меньшими значениями выраженности боли и требовала меньшего применения аналгетиков.
При сравнении интенсивности боли по ВАШ на этапах исследования было установлено, что в группе 2А (ингаляционная анестезия + декскетопрофен 50 мг) на 3-м этапе выраженность боли составила 2,9±0,03 балла, а на 4-м этапе – 3,1 ±0,03. В то время, как в 1А группе 4,45±0,2 и 5,1±0,25 баллов, соответственно. Суммарная доза аналгетиков также оказалась меньше: трамадола - 4000 мг, промедола - 60 мг. Что меньше, чем в группе 1А - трамадола на 33%, промедола на 57%. (таблица 1).
Таблица 1
Суммарная доза аналгетиков в группах
|
Группа |
Суммарная доза трамадола, мг |
Суммарная доза промедола, мг |
|
1А |
6000 |
140 |
|
1Б |
4500 |
20 |
|
1В |
5000 |
160 |
|
2А |
4000 |
60 |
|
2Б |
4000 |
- |
|
2В |
4000 |
80 |
Следовательно, применение декскетопрофена для упреждающей аналгезии улучшило эффективность послеоперационного болеутоления у больных с ингаляционной анестезией (рис. 1).
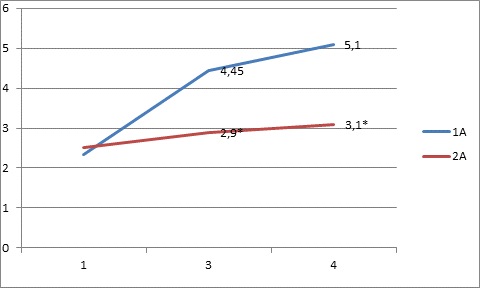
* - результат достоверно отличается от результата в контрольной группе на данном этапе исследования
Рис. 1. Динамика боли в баллах по ВАШ у больных в группах 1А и 2А на 1, 3 и 4 этапах исследования
В группе 2Б (регионарная анестезия +декскетопрофен 50 мг) на 3-м этапе выраженность боли составила 0,3±0,01 балла, причём 18 больных не отмечали наличие боли. На 4-м этапе болевой синдром отмечался у всех больных, но выраженность боли составила 2,8±0,01 баллов. В то время, как в группе 1Б на 3-м и 4-м этапах - 1,1±0,05 и 3,75±0,15 баллов соответственно. Суммарная доза аналгетиков в группе 2Б составила трамадола - 4000 мг, что было на 12% меньше, а промедол – не назначался. Следовательно, в группе 2Б также отмечали улучшение эффективности послеоперационного обезболивания (рис. 2).
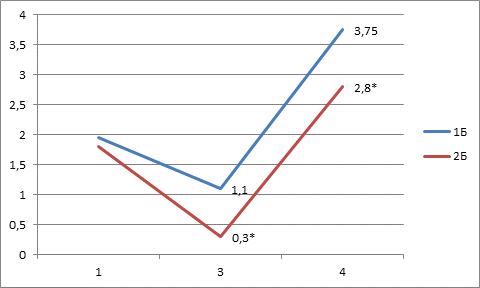
* - результат достоверно отличается от результата в контрольной группе на данном этапе исследования
Рис. 2. Динамика боли в баллах по ВАШ у больных в группах 1Б и 2Б на 1, 3 и 4 этапах исследования
В группе 2В (ТВВА+декскетопрофен 50 мг) на 3-м этапе выраженность боли составила 0,4 ±0,02 балла, причём у 8 больных болевой синдром отсутствовал. На 4-м этапе боли были у всех пациентов от 2 до 4 баллов, в среднем 2,98±0,1. В то время, как в группе 1В на 3-м этапе 0,6±0,01 баллов и на 4-м этапе – 5,75±0,2 баллов (рис. 3).
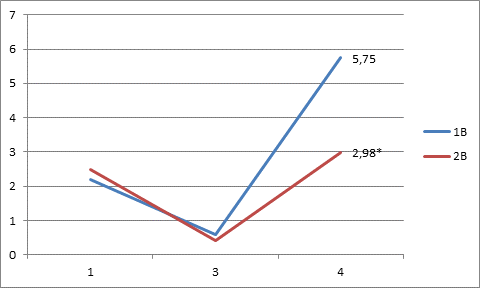
* - результат достоверно отличается от результата в контрольной группе на данном этапе исследования
Рис. 3. Динамика боли в баллах по ВАШ у больных в группах 1В и 2В на 1, 3 и 4 этапах исследования
Таким образом, на 4-м этапе отмечается существенное снижение выраженности боли. Суммарная доза аналгетиков в группе 2В составила трамадола 4000 мг, что меньше, чем в группе 1В на 20%, и промедола 80 мг, что меньше, чем в группе 1В на 50%. Следовательно, в группе 2В также отмечали улучшение эффективности послеоперационного болеутоления.
При анализе изменений уровня кортизола крови у больных в 1-й группе было выявлено, что на 2-м этапе исследования (операционного пособия) различия в уровне кортизола у пациентов вне зависимости от метода анестезии незначительны и не превышают исходных значений. В то же время после операции уровень кортизола значительно увеличивается (на 83,1%) и наиболее высокий в группе 1В (ТВВА), значительно снижается (на 72,8%) и остаётся наименьшим в группе 1Б (регионарная анестезия), а в группе 1А меняется незначительно по сравнению с исходными значениями до операции (на 14,1%).
Во 2-й группе отмечали снижение уровня кортизола начиная со 2-го этапа исследования у больных после регионарной анестезии (группа 2Б) и ингаляционной анестезии (группа 2 А), в то время, как у больных после ТВВА (группа 2В) отмечали увеличение уровня кортизола на 3-м этапе исследования, аналогично больным группы 1В.
При сравнении значений уровня кортизола крови у больных после ингаляционной анестезии в группах 1А и 2А было установлено, что в группе 2А на 2-м этапе в отличие от контрольной группы регистрировали значительное снижение уровня кортизола крови и составляло 306,1±12,9 ммоль/л, что было на 62,7% меньше, чем у больных в группе 1А, на 3-м этапе — 259,8±11,4 ммоль/л, что было на 59,6% меньше, чем в группе 1А, на 4-м этапе 408,7±15,3 ммоль/л, что было на 25,1% меньше, чем в группе 1А (рис. 4). Таким образом, добавление декскетопрофена существенно снизило уровень хирургического стресса у пациентов после ингаляционной анестезии.
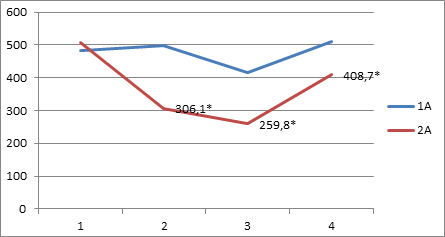
* - результат достоверно отличается от результата в контрольной группе на данном этапе исследования
Рис. 4. Изменения значений кортизола крови (ммоль/л) у больных в группах 1А и 2А
У пациентов после регионарной анестезии в группе 2Б в сравнении с группой 1Б регистрировали меньшее значение кортизола крови на 2-м этапе - 295,2±11,7 ммоль/л, что было на 30,5% меньше, чем в контроле, на 3-м этапе — 107,8±5,4 ммоль/л, что было на 28,7% меньше, на 3-м этапе 172,1±8,2 ммоль/л, что было на 27,9 % меньше, чем в контроле (рис. 5).
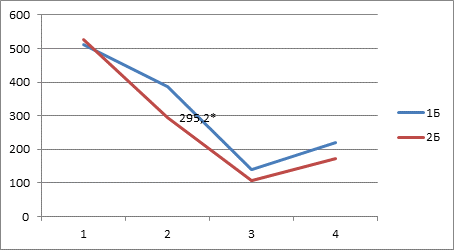
* - результат достоверно отличается от результата в контрольной группе на данном этапе исследования
Рис. 5. Изменения значений кортизола крови (ммоль/л) у больных в группах 1Б и 2Б
У пациентов после ТВВА в группе 2В динамика уровня кортизола крови была аналогичной контрольной группе, но значения уровня кортизола были меньше на всех этапах исследования. На 2-м этапе значения кортизола составили 389,9±12,8, что было на 16,9% меньше, чем у пациентов в группе 1В, на 3-м этапе – 788,8±30,2, что было на 7,5% меньше, чем в контроле, на 4-м этапе – 509,9±24,28 ммоль/л, что было на 35,2% меньше, чем в группе 1В.
Таким образом, добавление декскетопрофена существенно снижало уровень кортизола у пациентов после всех видов анестезии, но более благоприятные изменения отмечали в группе больных после ингаляционной анестезии.
При изучении показателей гемодинамики были выявлены следующие изменения СрАД и ЧСС на этапах исследования.
У пациентов с ингаляционной анестезией (группа 1А) на 2-м этапе исследования регистрировали в сравнении с исходными значениями снижение СрАД на 14,1% и ЧСС на 3,9%, на 3-м этапе СрАД оставалось сниженным по сравнению с исходным значением, ЧСС достоверно не изменялась. В то же время на 4-м этапе отмечали увеличение по сравнению с исходными значениями СрАД на 10,3% и ЧСС на 5,2% (таблица 2).
Таблица 2
Изменения СрАД и ЧСС у больных в группах на этапах исследования
|
Группа больных |
Показатель |
Этапы исследования |
|||
|
1-й |
2-й |
3-й |
4-й |
||
|
1А |
СрАД |
103,1±4,9 |
88,4±4,7* |
101,5±5,2 |
113,7±3,4* |
|
ЧСС |
94, 2±4,6 |
90,3±6,3 |
91,2±4,2 |
99,4±2,4 |
|
|
1Б |
СрАД |
104,8±5,6 |
91,2±4,1* |
98,4±4,4 |
101,2±4,5 |
|
ЧСС |
95,6±2,3 |
82,6±3,2* |
87,4±3,2 |
85,1±2,9* |
|
|
1В |
СрАД |
103,9±3,2 |
97,2±4,4 |
99,1±3,3 |
109,7±3,8 |
|
ЧСС |
93,4±2,8 |
86,2±2,2 |
98,8±3,8 |
103,2±3,1* |
|
|
2А |
СрАД |
105,3±4,8 |
87,4±4,2* |
89,4±4,1* |
90,4±4,5*# |
|
ЧСС |
92,6±3,7 |
85,5±3,5 |
87,7±5,5 |
89,3±3,7# |
|
|
2Б |
СрАД |
105,5±6,1 |
90,9±5,5* |
96,3±4,6 |
98,4±4,3 |
|
ЧСС |
93,9±4,6 |
83,3±4,3* |
85,8±4,1 |
83,3±3,6* |
|
|
2В |
СрАД |
103,8±3,9 |
86,6±3,9* |
87,3±4,3*# |
93,6±4,6*# |
|
ЧСС |
92,1±5,3 |
85,3±3,4 |
88,7±4,1 |
88,3±4,3# |
|
* - показатель достоверно отличается от исходного значения (р≤0,05)
# - показатель достоверно отличается от значения в контрольной группе (р≤0,05)
У пациентов с регионарной анестезией (группа 1Б) отмечали снижение значений СрАД и ЧСС на 2-м этапе на 14,5% и 13,6% соответственно, на 3-м этапе отмечали увеличение СрАД на 7,7% и ЧСС на 6,1% в сравнении с предыдущим значением, но оставались ниже, чем исходные значения, а на 4-м СрАД приближалось к исходным значениям, а ЧСС оставалась меньше исходных значений на 10,1%.
У пациентов с ТВВА (группа 1В) на 2-м этапе регистрировали уменьшение Ср АД на 5,8%, ЧСС – на 5,3%. На 3-м этапе СрАД приближалось к исходного значения, ЧСС превышала исходные значения на 6,3%, а на 4-м этапе СрАД превышало исходный показатель на 7,4%, а ЧСС – на 10,7%.
Таким образом, у больных после ТВВА отмечали признаки повышения симпатической активности в виде увеличения СрАД и ЧСС в сравнении с исходными значениями. У больных после ингаляционной анестезии отмечали умеренное повышение симпатической активности после пробуждения, которая сохранялась к 4-му этапу исследования, а у пациентов с регионарной анестезией регистрировали снижение симпатической активности уже во время операции и эта тенденция сохранялась до 4-го этапа исследования.
У пациентов в группе 2А отмечали снижение СрАД на 2-м этапе на 17,1%, на 3-м этапе – на 16,7%, на 4-м этапе – на 14,2% от исходных значений. ЧСС на этапах исследования практически не изменялась. В то время, как, в контрольной группе на 4-м этапе отмечали увеличение СрАД на 10,3%, таким образом, на 4-м этапе исследование регистрировали различие в цифрах СрАД между группами на 20,6%, а по ЧСС – на 10,1%.
У пациентов в группе 2Б отмечали снижение СрАД и ЧСС на всех этапах исследования: СрАД на 2-м этапе на 13,8%, на 3-м этапе – на 8,5%, на 4-м этапе – на 5,7% от исходного значения, ЧСС на 2-м этапе - на 11,3%, на 3-м этапе – на 9,5%, на 4-м этапе – на 10,7%. Указанные изменения достоверно не отличались от изменений в контроле (группа 1Б).
У пациентов в группе 2В значения СрАД и ЧСС были меньше, чем исходные значения на 2-м этапе – на 6,7% и 7,5%, на 3-м этапе – на 5,8% и 4,3%, на 4-м этапе – на 9,6% и 4,5%, соответственно. В то время, как в группе 1В на 3-м этапе исследования значения ЧСС и СрАД достоверно не отличались от исходных, а на 4-м этапе были выше таковых СрАД на 7,4% и ЧСС – на 10,7%. В результате на 4-м этапе исследования различия в значениях СрАД и ЧСС между группами 1В и 2В составили 17,6% и 11,1%, соответственно.
Таким образом, применение упреждающей анальгезии декскетопрофеном у пациентов после ингаляционной анестезии на 4-м этапе исследования сопровождается существенным различием СрАД на 17,6% и ЧСС на 11,1%, а после внутривенной анестезии на 20,6% и 10,1%, соответственно. Данный факт свидетельствует об уменьшении симпатической активности у больных после упреждающей анальгезии.
Выводы:
1. У всех больных после использования декскетопрофена в дозе 50 мг независимо от применённого вида анестезии регистрировались более благоприятная динамика выраженности боли, уровня кортизола крови, СрАД и ЧСС в ближайшем послеоперационном периоде.
2. У больных с упреждающей анальгезией декскетопфеном после общей (ингаляционной или внутривенной) анестезии регистрировали в большей степени снижение интенсивности боли, потребности в анальгетиках, уровне кортизола крови, СрАД и ЧСС в сравнении с контрольными группами, чем у пациентов после регионарной анестезии.
Рецензенты:
Бояринов Г.А., д.м.н., профессор, заведующий кафедрой “Анестезиологии и Реаниматологии ФПКВ”, ГБОУ ВПО "Нижегородская государственная медицинская академия" МЗ РФ, г. Нижний Новгород;
Загреков В.И., д.м.н., заведующий отделением анестезиологии-реанимации, ведущий научный сотрудник, ФГБУ «Приволжский федеральный медицинский исследовательский центр» Минздрава России, г. Нижний Новгород.
Библиографическая ссылка
Военнов О.В., Карельский М.В., Трофимов А.О., Калентьев Г.В. ВЛИЯНИЕ УПРЕЖДАЮЩЕЙ АНАЛЬГЕЗИИ ДЕКСКЕТОПРОФЕНОМ НА ДИНАМИКУ ПОСЛЕОПЕРАЦИОННОГО БОЛЕВОГО СИНДРОМА У БОЛЬНЫХ С СОЧЕТАННОЙ ТРАВМОЙ ПОСЛЕ РЕКОНСТРУКТИВНЫХ ОПЕРАЦИЙ В ЗАВИСИМОСТИ ОТ МЕТОДА АНЕСТЕЗИИ // Современные проблемы науки и образования. 2015. № 6. ;URL: https://science-education.ru/ru/article/view?id=23091 (дата обращения: 06.01.2026).
DOI: https://doi.org/10.17513/spno.130-23091



