Вопрос выбора метода анестезии после реконструктивных операций у больных с сочетанной травмой в настоящее время по-прежнему остается открытым [3]. Это обусловлено, в том числе, неизученностью влияния метода анестезии на выраженность послеоперационного болевого синдрома, состояние гемодинамики и общей стрессорной реакции организма [2].
Цель исследования
Изучить выраженность болевого синдрома в послеоперационном периоде в зависимости от выбранного метода анестезии.
Материалы и методы исследования
Обследованы 60 пациентов обоего пола в возрасте от 18 до 65 лет, средний возраст 34 (29–45) года. Все больные в зависимости от выбранного метода анестезии были разделены на 3 группы по 20 человек.
Группа 1А – ингаляционная анестезия (ИА). Для проведения ингаляционной анестезии использовали наркозно-дыхательный аппарат «GE Avance» (США). Индукцию проводили с помощью дипривана, фентанила и недеполяризующего миорелаксанта рокурония бромида в рекомендуемых дозировках. Для ИА применяли севофлуран по общепринятой методике.
Группа 1Б – региональная анестезия (РА). Обезболивание проводили по методике комбинированной спинно-эпидуральной анестезии (КСЭА). Для выполнения спинальной анестезии использовали бупивакаин в расчете на рост, а для продленной эпидуральной анестезии применяли ропивакаин в рекомендуемых дозировках.
Группа 1В – тотальная внутривенная анестезия (ТВВА). Применяли диприван, фентанил и недеполяризующий релаксант рокурония бромид в рекомендуемых дозировках.
Во всех группах проводили одинаковую премедикацию: внутривенно вводили атропин 0,1%-ный раствор из расчета 0,1 мг/кг массы тела и диазепам 10 мг.
По возрасту, полу, длительности и характеру оперативных вмешательств больные групп были сопоставимы между собой.
Выполняемые реконструктивные вмешательства: блокируемый интрамедуллярный остеосинтез бедренной кости.
Средняя длительность операции 95±11 мин, средняя длительность анестезии 125±7 мин.
Послеоперационное обезболивание проводилось по принятой в клинике методике: трамадолом по 100 мг х 3 раза в день, при необходимости добавлялся промедол по 20 мг внутримышечно.
Обследование проводилось на 4 этапах. 1-й этап — перед операцией, 2-й этап – после формирования анестезии, непосредственно после разреза кожи, 3-й этап – после перевода пациента в палату, 4-й этап – на следующий день через 24 ч после операции. Изучались балльная оценка выраженности боли по ВАШ, уровень кортизола крови с помощью иммуноэлектрохемилюминесцентного (ИЭХЛ) метода на анализаторе «Hitachi Elecsys 2010» (Германия) и показатели гемодинамики (СрАД, ЧСС) на мониторе пациента «Кардекс МАР-03» (Россия).
Статистическая обработка полученных результатов произведена с помощью параметрических и непараметрических методов статистики. Средние значения представлены в виде М±m или Me (P25 – P75). Нормальность выборки проверена с помощью стандартного отклонения от среднего значения. Достоверность различия сравниваемых значений проверена с помощью критерия Стьюдента или критерия Вилкоксона. Достоверным считали различие значений при р≤0,05.
Результаты исследования и их обсуждение
При анализе выраженности боли по ВАШ было установлено, что у всех больных в 1-й и 2-й группах перед операцией имелся умеренно выраженный посттравматический болевой синдром. Значения выраженности боли составляли от 1 до 3 баллов. Средние значения в группах составляли от 1,95±0,16 до 2,35±0,2 баллов.
В группе 1А (ингаляционная анестезия) на 3-м этапе исследования выраженность боли составляла в среднем 4,45±0,4 баллов, а на 4-м этапе исследования в среднем 5,1±0,5 баллов. Данный факт свидетельствует о сохранении болевого синдрома в послеоперационном периоде, несмотря на проведение послеоперационного обезболивания. У 13 больных в группе для обезболивания применяли только трамадол, а у 7 больных потребовалось дополнительное назначение промедола. В итоге суммарная доза трамадола составила 6000 мг, а суммарная доза промедола — 140 мг (табл. 1).
У больных в группе 1Б (регионарная анестезия) на 3-м этапе исследования болевой синдром был менее интенсивный, чем в группе 1А, и выраженности боли составляла в среднем 1,1±0,1 баллов. Однако на 4-м этапе исследования выраженность боли составляла в среднем 3,75±0,3 балла. Наличие болевого синдрома потребовало введения трамадола у 5 больных в дозе 300 мг/сут, а у 15 больных — 200 мг/сут. Суммарная доза трамадола в группе составила 4500 мг. Назначение промедола потребовалось всего в 1 случае, и суммарная доза его в группе составила 20 мг.
У больных в группе 1В (ТВВА) на 3-м этапе исследования болевой синдром отмечали только в 10 случаях, и выраженность боли в баллах составила в среднем 0,6±0,05 балла. На 4-м этапе исследования отмечали нарастание интенсивности боли до 4–7 баллов. Среднее значение составило 5,75±0,5 балла. Суммарная доза трамадола составила 5000 мг. В 8 случаях потребовалось введение промедола. Его суммарная доза составила 160 мг.
Таблица 1
Суммарная доза аналгетиков в группах
|
Группа |
Суммарная доза трамадола, мг |
Суммарная доза промедола, мг |
|
1А |
6000 |
140 |
|
1Б |
4500 |
20 |
|
1В |
5000 |
160 |
Таким образом, из всех обследованных больных меньшие значения баллов послеоперационной боли на 3-м этапе отмечались у пациентов в группе 1В (ТВВА) – 0,6±0,05 балла и у пациентов в группе 1Б (регионарная анестезия). В то же время на 4-м этапе меньшее значение баллов отмечали у больных в группе 1Б – 3,75±0,3, а у больных в группе 1В – большие значения (5,75±0,5 баллов). Вместе с тем у больных в группе 1А (ингаляционная анестезия) на 3-м этапе отмечали большие значения баллов по ВАШ – 4,45±0,4, а на 4-м этапе балльная оценка достоверно не отличалась от значений выраженности боли у пациентов в группе 1В. Наименьшая суммарная доза анальгетиков использовалась у пациентов в группе 1Б – трамадола 4500 мг, промедола 20 мг. В группах 1А и 1В — по 6000 мг и 5000 мг трамадола, 140 и 160 мг соответственно (рис. 1). Таким образом, динамика послеоперационной боли после регионарной анестезии характеризовалась меньшими значениями выраженности боли и требовала меньшего применения аналгетиков.
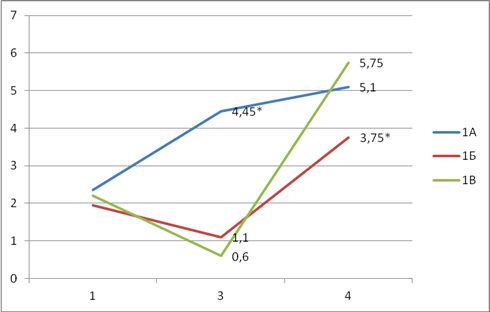
* — результат достоверно отличается от других результатов на данном этапе исследования
Рис. 1. Динамика боли в баллах по ВАШ у обследованных больных на 1-м, 3-м и 4-м этапах исследования
В группе 1А (ингаляционная анестезия) отмечалась следующая динамика значений кортизола крови. На 1-м этапе – 482,1±21,8, на 2-м – 497,9±12,4, на 3-м — 414,9±18,1, на 4-м – 511,5±15,6 ммоль/л.
В группе 1Б (регионарная анестезия) отмечалось достоверное снижение уровня кортизола начиная со 2-го этапа исследования: на 2-м этапе с 512,8±24,2 до 387,8±10,7, на 3-м этапе до 139,2±5,8 и на 4-м до 219,5±7,6 ммоль/л.
В группе 1В (ТВВА) отмечалось, напротив, увеличение значений кортизола крови начиная с третьего этапа: на 1-м этапе 464,6±21,3, на 2-м 455,6±20,8, на 3-м 850,9±32,5, на 4-м 688,9±30,2 ммоль/л.
Как следует, наибольшие значения уровня кортизола крови отмечали у больных в группе 1В, что свидетельствовало о наличии хирургической стрессовой реакции у больных. В группе 1А уровень кортизола незначительно увеличился, а в группе 1Б существенно снизился, что свидетельствовало о блокировании хирургической стрессовой реакции (рис. 2).
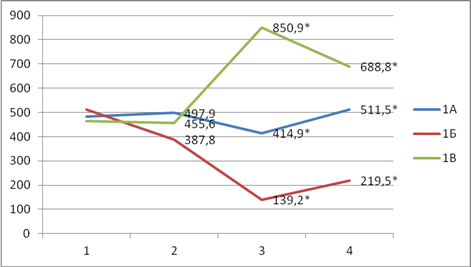
* — результат достоверно отличается от результатов в других группах на данном этапе исследования
Рис. 2. Изменения значений кортизола крови (ммоль/л) у обследованных больных
Как следует из рисунка 2, у всех больных вне зависимости от вида анестезии на 2-м этапе исследования различия в уровне кортизола незначительны и не превышают исходных значений, что свидетельствует об адекватности анестезии. В то же время после операции уровень кортизола значительно увеличивается (на 83,1%) и наиболее высок в группе 1В (ТВВА), значительно снижается (на 72,8%) и остается наименьшим в группе 1Б (регионарная анестезия), а в группе 1А меняется незначительно по сравнению с исходными значениями до операции (на 14,1%).
При сопоставлении графиков динамики выраженности боли, дозы использованных наркотических анальгетиков и значений кортизола крови можно отметить, что у больных после ингаляционной анестезии уровень кортизола после операции мало отличался от начальных значений, в то же время интенсивность боли на следующий день после операции была выражена, что требовало в 35% случаев промедола. У больных после регионарной анестезии значительно снижался уровень кортизола и интенсивность боли не была выраженной, что потребовало введения промедола всего лишь в 10% случаев. У больных после тотальной внутривенной анестезии увеличение кортизола крови совпадало с увеличением выраженности боли в послеоперационном периоде, что потребовало введения промедола в 40% случаев. По всей видимости, применение регионарной анестезии, а затем центральной анальгезии в большей степени позволяет блокировать выработку кортизола, нежели центральная анестезия и анальгезия, что лишний раз указывает на необходимость многокомпонентного обезболивания.
При изучении показателей гемодинамики были выявлены следующие изменения СрАД и ЧСС на этапах исследования.
У пациентов с ингаляционной анестезией (группа 1А) на 2-м этапе исследования регистрировали в сравнении с исходными значениями снижение СрАД на 14,1% и ЧСС на 3,9%, на 3-м этапе СрАД увеличивалось на 14,7% в сравнении с предыдущим значением, оставалось сниженным по сравнению с исходным значением, ЧСС достоверно не изменялась. В то же время на 4-м этапе отмечали увеличение по сравнению с исходными значениями СрАД на 10,3% и ЧСС на 5,2% (табл. 2).
Таблица 2
Изменения СрАД и ЧСС у больных в группах на этапах исследования
|
Группа больных |
Показатель |
Этапы исследования |
|||
|
1-й |
2-й |
3-й |
4-й |
||
|
1А |
СрАД |
103,1±5,9 |
88,4±4,7* |
101,5±5,2 |
113,7±5,4 |
|
ЧСС |
94, 2±4,6 |
90,3±6,3 |
91,2±4,2 |
99,4±2,4 |
|
|
1Б |
СрАД |
104,8±5,6 |
91,2±4,1* |
98,4±4,4 |
101,2±4,5 |
|
ЧСС |
95,6±2,3 |
82,6±3,2* |
87,4±3,2 |
85,1±2,9* |
|
|
1В |
СрАД |
103,9±3,2 |
97,2±4,4 |
99,1±3,3 |
109,7±3,8 |
|
ЧСС |
93,4±2,8 |
86,2±2,2* |
98,8±3,8 |
103,2±3,1* |
|
* — показатель достоверно отличается от исходного значения (р≤0,05)
У пациентов с регионарной анестезией (группа 1Б) отмечали снижение значений СрАД и ЧСС на 2-м этапе на 14,5% и 13,6% соответственно, на 3-м этапе отмечали увеличение СрАД на 7,7% и ЧСС на 6,1% в сравнении с предыдущим значением, но эти показатели оставались ниже, чем исходные значения, а на 4-м этапе СрАД приближалось к исходным значениям, а ЧСС оставалась меньше исходных значений на 10,1%.
У пациентов с ТВВА (группа 1В) на 2-м этапе регистрировали уменьшение Ср АД на 5,8%, ЧСС – на 5,3%. На 3-м этапе СрАД приближалось к исходному значению, ЧСС превышала исходные значения на 6,3%, а на 4-м этапе СрАД превышало исходный показатель на 7,4%, а ЧСС – на 10,7%.
Таким образом, у больных после ТВВА отмечали признаки повышения симпатической активности в виде увеличения СрАД и ЧСС в сравнении с исходными значениями. У больных после ингаляционной анестезии отмечали умеренное повышение симпатической активности после пробуждения, которая сохранялась к 4-му этапу исследования, а у пациентов с регионарной анестезией регистрировали снижение симпатической активности уже во время операции, и эта тенденция сохранялась до 4-го этапа исследования.
Выводы:
1. Во время проведения наиболее травматичного этапа реконструктивной операции у больных с сочетанной травмой вне зависимости от вида анестезии не было отмечено повышения уровня кортизола крови, увеличения СрАД и ЧСС, что свидетельствовало об адекватности анестезии.
2. У больных с сочетанной травмой в послеоперационном периоде реконструктивных операций вне зависимости от вида анестезии через 24 ч после операции, несмотря на проведение обезболивания трамадолом и промедолом, сохраняется болевой синдром различной степени выраженности.
3. У больных после ингаляционной анестезии в палате, несмотря на невысокие значения кортизола крови, отсутствие тахикардии и артериальной гипертензии, отмечали раннее появление болевого синдрома, который сохранялся через 24 ч и сопровождался умеренной тахикардией и гипертензией.
4. У больных после регионарной анестезии в послеоперационном периоде отмечали снижение уровня кортизола крови, отсутствие боли после перевода в палату, тахикардии и артериальной гипертензии. Тем не менее через 24 ч у них сохранялся умеренный болевой синдром без тахикардии и артериальной гипертензии.
5. У больных после ТВВА в послеоперационном периоде в палате, несмотря на повышение уровня кортизола, болевой синдром, тахикардия и артериальная гипертензия отсутствовали, но через 24 ч на фоне высокого уровня кортизола регистрировали выраженный болевой синдром, умеренную тахикардию и гипертензию.
Рецензенты:Бояринов Г.А., д.м.н., профессор, заведующий кафедрой «Анестезиологии и реаниматологии ФПКВ», ГБОУ ВПО «Нижегородская государственная медицинская академия» МЗ РФ, г. Нижний Новгород;
Загреков В.И., д.м.н., заведующий отделением анестезиологии-реанимации, ведущий научный сотрудник, ФГБУ «Приволжский федеральный медицинский исследовательский центр» Минздрава России, г. Нижний Новгород.
Библиографическая ссылка
Карельский М.В., Военнов О.В., Трофимов А.О., Калентьев Г.В. СРАВНИТЕЛЬНАЯ ОЦЕНКА ДИНАМИКИ ПОСЛЕОПЕРАЦИОННОГО БОЛЕВОГО СИНДРОМА У БОЛЬНЫХ С СОЧЕТАННОЙ ТРАВМОЙ ПОСЛЕ РЕКОНСТРУКТИВНЫХ ОПЕРАЦИЙ В ЗАВИСИМОСТИ ОТ МЕТОДА АНЕСТЕЗИИ // Современные проблемы науки и образования. 2015. № 6. ;URL: https://science-education.ru/ru/article/view?id=23060 (дата обращения: 07.02.2026).
DOI: https://doi.org/10.17513/spno.130-23060



