Считается, что основным патогенетическим звеном токсического действия ДХЭ на организм является поражение печени, поскольку именно этот орган играет ведущую роль в процессе его превращения. Воздействие хронической интоксикации ДХЭ на нервную систему изучено недостаточно. Нервная ткань характеризуется высоким содержанием и разнообразием липидных соединений, которые определяют ее морфологическую гетерогенность, метаболизм и функциональную активность. Фосфолипиды являются главными липидными компонентами клеточных мембран, они создают достаточно стойкие двухслойные мембранные структуры, обладающие в то же время необходимой текучестью и обеспечивающие нормальную работу белковых мембранных структур, регулирующих проницаемость ионов и веществ. Фосфолипиды являются предшественниками вторичных мессенджеров и биологически активных соединений, участвующих в механизмах синаптической трансмиссии, процессах адаптации и патогенезе различных заболеваний центральной нервной системы [15, 23]. Важную роль в обеспечении нормального функционирования нервных клеток играет мембранно-связанный фермент – Nа,К-АТФаза, участвующий в регуляции распределения катионов натрия и калия между клеткой и межклеточным пространством и определяющий биоэлектрические свойства мембран нервных клеток. Вместе с тем комплексная оценка повреждений клеточных мембран головного мозга с учетом деятельности мембранно-зависимых ферментных систем при хронической интоксикации ДХЭ в доступной нам литературе не встречается.
В связи с вышеизложенным целью настоящей работы являлось выяснение некоторых патогенетических механизмов нарушения состояния клеточных мембран головного мозга крыс при хронической интоксикации ДХЭ путем исследования изменения фосфолипид-фосфолипидных соотношений и активности интегрального ионтранспортного белка - Nа,К-АТФазы.
Материалы и методы исследования
Эксперименты выполнены на 48 здоровых половозрелых неинбредных белых крысах-самцах массой 180–220 г, разделенных на 3 группы: 1-я – контрольная (n=16), 2-я и 3-я – животные с моделированной интоксикацией дихлорэтаном (n=16 в каждой группе) соответственно на 30-е и 60-е сутки исследования. Эксперименты проводились в соответствии с требованиями приказов № 1179 МЗ СССР от 10.10.83 г., № 267 МЗ РФ от 19.06.03 г. «Правила проведения работ с использованием экспериментальных животных», «Правила по обращению, содержанию, обезболиванию и умерщвлению экспериментальных животных». Хроническая интоксикация дихлорэтаном достигалась ежедневным энтеральным введением токсиканта в растворе оливкового масла в дозе 5 мг/кг (0,01 LD 50) в течение 60 суток. Контрольные животные получали внутрижелудочно равный объем оливкового масла. Животных умерщвляли методом краниоцервикальной дислокации под легким эфирным наркозом. Объектом исследования служили большие полушария головного мозга. Эксперименты выполнялись в осенне-зимний период времени. Забор биологического материала производился в утренние часы. Тестирование осуществляли на 30-е и 60-е сутки.
Экстракцию липидов из полушарий головного мозга производили по методу Folch J. Для разделения фосфолипидов на классы использовали метод восходящей хроматографии в тонком слое силикагеля в системе растворителей хлороформ: метанол: 7н аммиак в объемных соотношениях 60:35:5, предложенной Скидморе и Энтенманом [26]. Хроматограммы проявляли парами йода. Идентификацию фракций фосфолипидов (ФЛ) проводили при помощи качественных (цветных) реакций, измерением величины Rf. Фосфолипиды, содержащие свободные аминогруппы – фосфатидилэтаноламин (ФЭ) и фосфатидилсерин (ФС), определяли с помощью нингидрина, холинсодержащие фосфолипиды (фосфотидилхолин, лизофосфатидилхолин, сфингомиелин) определяли при помощи реактива Драгендорфа. Для определения монофосфоинозитидов использовали аммиачный раствор серебра, состоящий из равных объемов 0,1 н AgNO3 и 1 н NH3, а для обнаружения фосфатидов использовали хлорид железа (FeCl3) и сульфосалициловую кислоту [6]. Минерализацию липидного фосфора проводили в среде хлорной кислоты с последующим проведением «цветной» реакции с образованием молибденовой сини [11]. Содержание фосфолипидов выражали в мкг липидного фосфора на 1 г влажной ткани с последующим определением коэффициентов их соотношений. Суммарные ФЛ вычисляли по сумме отдельных фракций.
Получение мембранных препаратов больших полушарий головного мозга крыс проводили из 10% гомогенатов на среде выделения, содержащей 0,03 М сахарозы с 0,01 М триса и 0,005 М ЭДТА (рН 7,5) методом дифференциального центрифугирования. Активность Na,K-АТФазы в мембранах оценивали, измеряя количество неорганического фосфата, который освобождается в ходе гидролиза АТФ. Общую АТФазную активность определяли в среде следующего состава (в мМ): трис – 50, NaCl – 100, KCl – 20, MgCl2 – 3, АТФ – 3 (рН 7,5) и 40–50 мкг мембранного белка в 1 мл конечного объема. Реакцию начинали внесением субстрата и инкубировали 15 мин при 37оС, останавливали реакцию добавлением холодного раствора трихлоруксусной кислоты (конечная концентрация 5%). При определении активности Mg2+-АТФазы среда инкубации содержала те же компоненты и дополнительно 1мМ уабаина для ингибирования активности Na,K-АТФазы. Активность Na,K-АТФазы рассчитывали как разность между общей и Mg2+-зависимой АТФазной активностью [18]. Содержание белка определяли по Лоури. Количественное определение фосфата проводили методом Ратбуна и Бетлаха, который позволяет определять неорганический фосфат в присутствии АТФ.
Ориентировочно-исследовательские реакции оценивали по тесту «открытое поле» [5], а неврологические нарушения — по методу [2].
Обработку полученных результатов проводили с применением методов вариационной статистики. После проверки нормальности распределения изучаемых параметров в сравниваемых группах определяли средние величины (М), ошибку средних величин (m) при соответствии распределения признака закону нормального распределения с расчетом сравнения групп показателей по критерию Стьюдента (t). Минимальный уровень статистически значимых различий верифицировали при р<0,05. Взаимосвязь признаков оценивали с помощью корреляционного анализа по Спирмену. Математическую обработку выполняли на компьютере с применением стандартных пакетов программы Statistica 6.0 и программного обеспечения Microsoft Excel.
Результаты исследования и их обсуждение
Для нервной ткани характерно высокое содержание фосфолипидов. В мозге фосфолипиды составляют 65–70% суммарного веса всех липидов. Являясь важным структурным компонентом плазматических мембран, фосфолипиды регулируют активный и пассивный трансмембранный транспорт веществ, определяют чувствительность клеток к действию лигандов, детерминируют активность мембранно-связанных ферментных систем [4, 19]. Анализ полученных результатов, представленный в таблице 1, свидетельствует о значительных качественных и количественных изменениях в фосфолипидном составе полушарий головного мозга крыс на 30-е сутки хронической интоксикации ДХЭ на фоне незначительного уменьшения содержания суммарных фосфолипидов (СФЛ). Разделение смеси фосфолипидов полушарий головного мозга крыс экспериментальных групп показало наличие семи компонентов: фосфатидилхолина (ФХ), фосфатидилэтаноламина (ФЭ), фосфатидилсерина (ФС), сфингомиелина (СМ), лизофосфатидилхолина (ЛФХ), фосфатидных кислот (ФК), монофосфоинозитида (МФИ).
Таблица 1
Содержание отдельных представителей фосфолипидов в больших полушариях головного мозга крыс при хронической интоксикации ДХЭ (M±m)
|
Исследуемый показатель |
Группы животных |
||||
|
1-я группа, (n=16) |
2-я группа, (n=16) |
3-я группа, (n=16) |
|||
|
Суммарные фосфолипиды, мкг Р на г. влажной ткани |
2167,5±26,95 |
2006,7±69,45* |
1785,1±29,0*^ |
||
|
Фракции ФЛ |
|
||||
|
ЛФХ |
мкг Р на 1 г влажной ткани |
54,4±4,3 |
63,3±4,29 |
70,2±4,93 |
|
|
в % от липидного фосфора |
2,52±0,21 |
3,14±0,13* |
3,93±0,26*^ |
||
|
ФХ |
мкг Р на 1 г влажной ткани |
944,04±28,7 |
809,9±36,3 |
779,66±25,26 |
|
|
в % от липидного фосфора |
43,53±1,05 |
40,33±1,06 |
43,7±1,3 |
||
|
ФЭ |
мкг Р на 1 г влажной ткани |
622,78±14,7 |
484,46±19,9 |
452,15±16,29 |
|
|
в % от липидного фосфора |
28,72±0,49 |
24,13±0,51* |
25,35±0,89* |
||
|
ФС |
мкг Р на 1 г влажной ткани |
218,85±11,9 |
288,3±12,23 |
167,3±11,87 |
|
|
в % от липидного фосфора |
10,14±0,64 |
14,38±0,41* |
9,36±0,62^ |
||
|
СМ |
мкг Р на 1 г влажной ткани |
168,03±11,17 |
180,13±8,47 |
168,38±7,4 |
|
|
в % от липидного фосфора |
7,74±0,49 |
9,0±0,37 |
9,44±0,41* |
||
|
МФИ |
мкг Р на 1 г влажной ткани |
118,13±6,56 |
130,06±8,6 |
89,76±7,63 |
|
|
в % от липидного фосфора |
5,49±0,29 |
6,5±0,4 |
5,02±0,4^ |
||
|
ФК |
мкг Р на 1 г влажной ткани |
40,93±2,63 |
50,55±3,94 |
57,64±5,4 |
|
|
в % от липидного фосфора |
1,89±0,11 |
2,52±0,18* |
3,22±0,28* |
||
|
Коэффициент ЛФХ/ФХ, усл.ед. |
0,059±0,0054 |
0,078±0,003* |
0,091±0,007* |
||
|
Коэффициент ФХ/СМ, усл.ед. |
5,84±0,5 |
4,57±0,3* |
4,73±0,33 |
||
|
Коэффициент ФЭ/ФС, усл.ед. |
2,92±0,2 |
1,69±0,062* |
2,8±0,22^ |
||
|
Коэффициент ФХ/ФК, усл.ед. |
23,54±1,24 |
16,7±1,44* |
14,35±1,3* |
||
|
Коэффициент ФЭ+ФС/ФХ+СМ, усл. ед. |
0,76±0,066 |
0,78±0,022 |
0,66±0,029*^ |
||
|
|
|
|
|
|
|
Примечание: * — достоверно (p<0,05) по сравнению с первой (контрольной) группой в процентном соотношении от липидного фосфора
^ — достоверно (p<0,05) 3-я группа по сравнению со 2-й группой в процентном соотношении от липидного фосфора
При изучении фосфолипидного спектра наблюдалось перераспределение состава ФЛ в сторону накопления ЛФХ, СМ, ФС и снижения доли ФХ и ФЭ. Анализ фосфолипидного состава выявил снижение содержания легкоокисляемой фракции фосфатидилхолина (ФХ) на 7,4% (р>0,05) с одновременным ростом образования ЛФХ на 24,6% (р<0,05), который является специфическим маркером фосфолипазной активности. Увеличение коэффициента ЛФХ/ФХ на 32,2% (р<0,05) свидетельствует об интенсификации процессов деацилирования фосфолипидов, при котором образуются неэстерифицированные жирные кислоты, вступающие в окислительные процессы, связанные с активацией ПОЛ и образованием малонового диальдегида. Недостаток ФХ в наружном слое мембран эритроцитов компенсировался за счет повышения количества СМ. Сфингомиелин является медленно обменивающимся ФЛ головного мозга, не содержащим полиеновые кислоты. В силу высокой насыщенности сфингомиелина в кластеры, которые образует этот фосфолипид в мембране, встраивается большое количество холестерина, что влечет за собой уменьшение проницаемости клеточной мембраны, нарушение процессов активного транспорта, переноса веществ [13]. При интоксикации ДХЭ коэффициент ФХ/СМ, характеризующий уровень перераспределения фосфолипидных фракций внутри мембранного бислоя, составил 4,57 условных единиц. Снижение этого коэффициента на 21,7% (р<0,05) в сравнении с группой здоровых животных свидетельствует об уменьшении жидкостных свойств и увеличении микровязкости липидной фазы мембраны.
Фосфолипидные фракции ФЭ и ФС характеризуют внутренний монослой мембраны. Количество ФЭ уменьшилось на 16,0% (р<0,001), а содержание ФС возросло на 41,8% (р<0,001). Расчет коэффициента ФЭ/ФС показал, что при интоксикации ДХЭ его величина составляет 1,69 усл.ед., что ниже показателей контрольной группы на 42,1% (р<0,001). Увеличение ФС на фоне снижения содержания ФХ и ФЭ является защитно-приспособительной реакцией клеток, обеспечивающей регуляцию микровязкости липидного компонента мембраны [1, 7, 20]; в какой-то мере увеличение ФС частично нивелировало потерю ФХ и ФЭ. Повышение количества ФС возможно за счет реакции обмена азотистыми основаниями между ФХ, ФЭ и ФС, осуществляемыми холин-специфической и этанол-специфической фосфатидилсеринсинтетазами [7]. В условиях нашего эксперимента снижается коэффициент соотношений ФХ/ФК на 29,1% (р<0,01), что свидетельствует о существенном подавлении процессов синтеза мембранных глицеролипидов. Известно, что ФК обладают высокой скоростью метаболизма и играют значительную роль в биосинтезе других фосфолипидов [7]. Поэтому повышение ФК является как следствием деградации фосфолипидов, так и результатом нарушения синтетических процессов. Следует отметить повышенное содержание МФИ в головном мозге у крыс на 30-е сутки хронической интоксикации ДХЭ. Монофосфоинозитид, участвуя в фосфатозитидном цикле, влияет на организацию холинорецептора и тем самым отвечает за синаптическую передачу нервного импульса [4, 24]. Выявленная модификация фосфолипидного матрикса клетки свидетельствует о структурно-функциональной несостоятельности цитоплазматической мембраны.
Таким образом, на 30-е сутки хронической интоксикации ДХЭ у крыс развиваются адаптационные изменения в фосфолипидном спектре головного мозга, однако при этом превалирует деградация фосфолипидов. Полагают, что деградация фосфолипидного состава является одной из причин повышения ХС в мембране при патологии. В результате повышенной активности фосфолиполиза и свободно-радикального окисления происходит разрушение фосфолипидных молекул, вследствие чего уменьшается их содержание в мембране, они замещаются на молекулы ХС [8].
На 60-е сутки хронической интоксикации ДХЭ направленность изменений в фосфолипидном составе полушарий головного мозга была однотипной с 30-ми сутками интоксикации, но эти изменения были более выраженными. Уменьшение содержания суммарных фосфолипидов составило 17,64% (р<0,05). Однако снижение содержания ФЭ сопровождалось одновременным уменьшением количества ФС на 34,6% (р<0,001) относительно 2-й группы животных. Данное обстоятельство можно связать с тем, что они наиболее быстро подвергаются окислению свободными радикалами при усилении процессов перекисного окисления липидов. Снижение содержания ФС, а также значительное накопление ФК свидетельствуют о делипидизации мембран, что можно трактовать как срыв защитно-приспособительных реакций. Содержание монофосфоинозитида на 60-е сутки хронической интоксикации ДХЭ снизилось на 22,77% (р<0,05) относительно животных 2-й группы. Фосфоинозитиды и их метаболиты принимают участие в реализации действия нейромедиаторов на молекулярном уровне, а также являются одним из поставщиков арахидоновой кислоты и эйкозаноидов и тем самым играют важную роль в обеспечении нормального функционирования нервных клеток [17, 21, 25].
Важным показателем, характеризующим лабильность липидного бислоя, служит коэффициент асимметрии (ФЭ+ФС)/(ФХ+СМ). Отношение суммы фосфолипидов с меньшей насыщенностью жирных кислот, которые располагаются преимущественно во внутреннем монослое липидного бислоя мембран, к фосфолипидам с большей насыщенностью, которые располагаются во внешнем монослое, позволяет получить представления о жидкостности мембраны. На 60-е сутки хронической интоксикации ДХЭ значение коэффициента асимметрии ниже контрольной величины на 13,2% (р<0,05), что обусловливает повышение насыщенности липидного бислоя и увеличение микровязкости.
В результате структурной модификации липидного слоя мембраны изменяется конформация встроенных в них белков. Известно, что активность и свойства транспортных АТФаз плазматических мембран в значительной степени определяются структурными особенностями липидного матрикса, в который погружены молекулы фермента [16]. Исходя из этого нами была проведена оценка активности липидзависимых и мембраносвязанных ферментных систем – ионтранспортных АТФаз клеточных мембран головного мозга. Результаты, представленные в таблице 2, свидетельствуют о снижении активности Na,K-АТФазы на 16,42% (р<0,05) на 30-е сутки интоксикации ДХЭ с одновременным повышением общей АТФазной активности и деятельности Мg АТФаз. На 60-е сутки хронической интоксикации ДХЭ активность Na,K-АТФазы снизилась на 20,16% (р<0,05), при этом наблюдалось заметное ингибирование общей АТФазной активности и деятельности Мg АТФаз. Возрастание содержания лизофракций в мембранах делает возможным переход липидного бислоя в монослой с нарушением проницаемости мембраны для ионов Nа+ и К+, образованием гидрофильных каналов и солюбилизацией ферментов [14]. Дезорганизация липидного слоя мембраны может явиться причиной утраты способности клеток регулировать ионный гомеостаз. Проведенный нами корреляционный анализ выявил корреляционную связь между активностью Na,K-АТФазы и содержанием ЛФХ ( r=–0,89, р=0,003) на 60-е сутки хронической интоксикации ДХЭ.
Таблица 2
АТФазная активность мембран из больших полушарий головного мозга крыс при хронической интоксикации ДХЭ (M±m)
|
Исследуемый показатель |
Группы животных |
||
|
1-я группа (n=16) |
2-я группа (n=16) |
3-я группа (n=16) |
|
|
АТФаза (общая), мкмоль Рi · мг белка-1 · ч -1 |
18,81±0,5 |
19,65±0,73 |
16,11±0,56*^ |
|
Мg-АТФаза мкмоль Рi · мг белка-1 · ч -1 |
12,66±0,52 |
14,51±0,52* |
11,2±0,57^ |
|
Na,К-АТФаза мкмоль Рi · мг белка-1 · ч -1 |
6,15±0,3 |
5,14±0,35* |
4,91±0,36* |
Примечание: * — достоверно (p<0,05) по сравнению с 1-й (контрольной) группой
^ — достоверно (p<0,05) 3-й группы по сравнению со 2-й группой
Na+,K+насос формирует на мембране нервной клетки электрохимический градиент, энергия которого используется для процессов возбуждения, транспорта аминокислот, сахаров и других метаболитов через плазматическую мембрану. Ингибирование фермента снижает трансмембранные градиенты ионов, вызывает чрезмерное поступление в нейроны Nа+ с последующим притоком Cl¯ и воды, что приводит к клеточному отеку [12]. Изменения биоэлектрических свойств мембран нервных клеток создают предпосылки для развития функциональных расстройств со стороны ЦНС. В серии экспериментов были оценены неврологические отклонения и ориентировочно-исследовательская деятельность у крыс при хронической интоксикации ДХЭ. При оценке неврологического статуса крыс особое внимание уделяется поведенческим реакциям животных, изменениям рефлекторной деятельности, координационно-двигательным расстройствам. При этом отражается состояние различных уровней центральной нервной системы. Иерархия уровней включает спинной мозг (рефлекс сгибания), продолговатый мозг (роговичный рефлекс), средний мозг (рефлекс равновесия, зрачковые реакции) и кору головного мозга (реакция постановки лап на опору, хватание, тесты для исследования равновесия). Динамика показателей неврологического статуса показана на рисунке 1, из которого следует, что у животных на 30-е сутки хронической интоксикации ДХЭ развивается неврологический дефицит легкой степени. При углублении интоксикации на 60-е сутки действия ДХЭ неврологический дефицит становится более выраженным, увеличиваясь до 32,13±4,77 баллов (р<0,05).
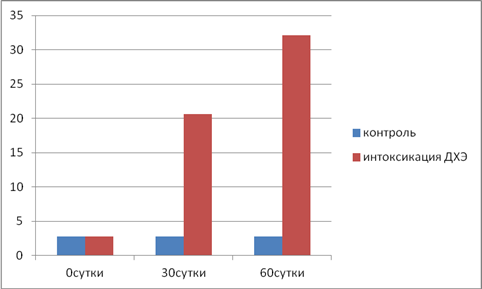
Рис. 1. Показатели неврологического статуса (баллы) у крыс при хронической интоксикации ДХЭ (n=8 в каждой группе)
Ориентировочно-исследовательская деятельность крыс на 30-е сутки хронической интоксикации ДХЭ характеризуется угнетением всех ее составляющих (рис. 2, 3). Возрастает продолжительность латентного периода с 5,5±0,94 до 13,25 с (р<0,05), снижается горизонтальная (количество пересеченных линий) и вертикальная (количество вертикальных стоек) двигательная активность на 20,55% (р<0,05) и 19,0% (р<0,05) соответственно, количество обследованных норок уменьшается в 1,63 раза (р<0,05), наблюдаются значительные изменения в эмоциональном компоненте (груминг). На 60-е сутки хронической интоксикации ДХЭ изменения в ориентировочно-исследовательской активности у крыс были однонаправленными с 30-ми сутками, но более выраженными.
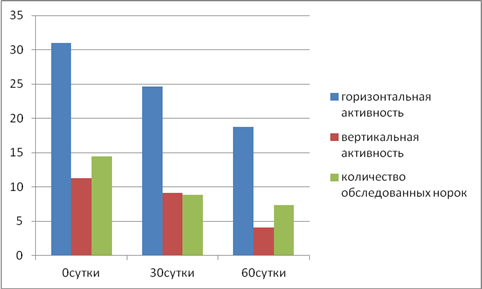
Рис. 2. Показатели горизонтальной, вертикальной активности и количество обследованных норок у крыс при хронической интоксикации ДХЭ (n=8 в каждой группе)
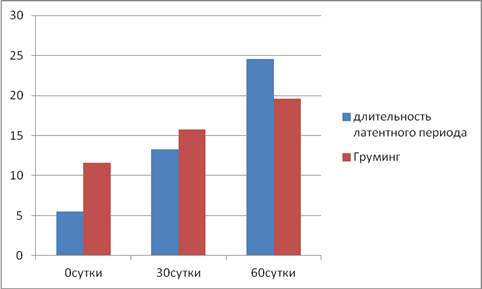
Рис. 3. Показатели длительности латентного периода и груминга (секунд) у крыс при хронической интоксикации ДХЭ (n=8 в каждой группе)
Таким образом, полученные нами данные позволяют считать, что клеточные мембраны головного мозга при хронической интоксикации ДХЭ претерпевают существенные изменения. В результате структурных нарушений мембран нервных клеток могут изменяться их функциональные свойства, способность регулировать ионный гомеостаз, что в конечном счете может привести к значительным метаболическим и функциональным расстройствам. Выявленные нарушения клеточных мембран являются важным звеном в патогенезе нейротоксического действия ДХЭ при хронической интоксикации. Степень выраженности структурно-функциональных изменений мембран зависит от длительности патологического процесса.
Рецензенты:Миннебаев М.М., д.м.н., профессор кафедры патофизиологии ГБОУ ВПО «Казанский государственный медицинский университет», г. Казань;
Фролов Б.А., д.м.н., профессор, зав. кафедрой патофизиологии ГБОУ ВПО «Оренбургская государственная медицинская академия», г. Оренбург.
Библиографическая ссылка
Срубилин Д.В., Еникеев Д.А., Мышкин В.А., Хусаинова К.Р., Сазонова М.Р. ИЗМЕНЕНИЯ ЛИПИДНОЙ ФАЗЫ И АКТИВНОСТИ Nа,K-АТФАЗЫ В БОЛЬШИХ ПОЛУШАРИЯХ ГОЛОВНОГО МОЗГА КРЫС ПРИ ХРОНИЧЕСКОЙ ИНТОКСИКАЦИИ ДИХЛОРЭТАНОМ // Современные проблемы науки и образования. 2015. № 6. ;URL: https://science-education.ru/ru/article/view?id=22886 (дата обращения: 07.02.2026).



