Байкалин – биологически активный флавоноид, выделенный из корней шлемника байкальского, лекарственного растения, которое используется с древних времен для лечения воспаления, лихорадки и аллергических заболеваний [6]. Ранее нами была продемонстрирована высокая эффективность экстракта из корней шлемника байкальского в качестве гепато- и нефропротектора [1,2]. Поэтому изучение фармакокинетики байкалина необходимо для оценки его биологической активности в органах-мишенях, что может способствовать более детальному изучению механизмов действия байкалина.
Целью настоящего исследования является изучение фармакокинетики и распределения байкалина в печени и почках.
Материалы и методы
В работе использовали сухой экстракт корней шлемника байкальского (СЭ ШБ) производства ShenzhenNaturactive (КНР) с содержанием байкалина 95% и водорастворимую форму сухого экстракта (СЭ-2-ГП-β-ЦД), которую получали с использованием 2-гидроксипропил-β-циклодекстрина.
Эксперименты проведены на 108 крысах-самцах линии Wistar с массой 220–240 г. СЭ-2-ГП-β-ЦД вводили внутрибрюшинно в дозе 15 мг/кг. СЭ ШБ вводили перорально в дозе 300 мг/кг. Контрольной группе животных вводили воду очищенную в таком же объеме. Распределение байкалина у крыс изучали в печени и почках.
Забор проб крови и органов при внутрибрюшинном введении проводился через 10, 20, 30 минут и через 1, 2, 4, 6, 8 и 10 часов после введения СЭ-2-ГП-β-ЦД, а при пероральном введении – через 15, 30 минут и через 1, 2, 4, 6, 8 и 10 часов после введения СЭ ШБ.
Образцы крови центрифугировали, сыворотку крови замораживали и хранили при -18°С до проведения количественного анализа. Для изолирования байкалина из сыворотки крови использовали следующую методику: к 100 мкл сыворотки крови добавляли 1 мл раствора аммония сульфата насыщенного и 3 мл ацетонитрила. Содержимое центрифугировали со скоростью 3000 об/мин в течение 5 минут. Надосадочную жидкость помещали в выпарительную чашку и удаляли растворитель при комнатной температуре. Сухой остаток, полученный после испарения экстрагента, растворяли в 5 мл 96% этанола.
Внутренние органы замораживали и хранили при -18°С до проведения количественного анализа. Для изолирования байкалина из внутренних органов использовали следующую методику: навеску объекта измельчали до размера кусочков 0,5x0,5x0,5 см и заливали водой, подкисленной щавелевой кислотой до pH 2-2,5, в соотношении 1:2. Настаивали 2 раза: 2 ч и 1 ч при периодическом перемешивании. Водную вытяжку процеживали через двойной слой марли, подщелачивали до pH 7-8 25% раствором аммиака, добавляли 1 мл раствора аммония сульфата насыщенного и экстрагировали 3 мл хлороформа. Содержимое взбалтывали в течение 5 минут и помещали в делительную воронку. После разделения фаз отделяли слой органического растворителя. Растворитель удаляли при комнатной температуре. Сухой остаток, полученный после испарения экстрагента, растворяли в 5 мл 96% этанола.
Обнаружение и количественное определение байкалина в извлечениях проводили методом ВЭЖХ на приборе «Миллихром А-02». Нами были использованы следующие условия хроматографирования: хроматографическая колонка размером 2x75 мм, заполненная обращено-фазовым сорбентом «ProntoSil120-5-С18 AQ»; подвижная фаза: элюент А – 0,1% раствор кислоты трифторуксусной, элюент Б – ацетонитрил (от 5% до 95% за 25 мин); скорость потока – 100 мкл/мин; время измерения 0,18 с; температура термостата колонки – 35°С, объем пробы 2 мкл, длина волны – 254 нм. Расчет количественного содержания байкалина в извлечениях проводили по стандартному образцу байкалина.
Результаты и их обсуждение
Полученный в результате исследования усредненный фармакокинетический профиль зависимости концентрации байкалина в сыворотке крови от времени при разных способах введения приведен на рисунке 1. Выявлено, что после перорального введения СЭ ШБ в оптимальной терапевтической дозе 300 мг/кг, концентрация байкалина в сыворотке крови через 2 часа составила 5,67±0,155 мкг/мл, через 4 часа она увеличилась до 10,8±0,36, достигла максимума через 6 часов – 11,7±0,45, затем через 8 часов концентрация байкалина начала снижаться, а через 10 часов он в крови уже не обнаруживался.
Сходный фармакокинетический профиль байкалина наблюдался и после внутрибрюшинного введения СЭ-2-ГП-β-ЦД в оптимальной терапевтической дозе 15 мг/кг, за исключением дополнительного максимума, который наблюдался через 10 мин и составил 36,05±2,997 мкг/мл, затем концентрация быстро снизилась, и через 30 минут содержание байкалина в сыворотке крови было ниже порога определения. Через 1 час концентрация байкалина в крови вновь начала повышаться и достигла второго максимума (7,29± 0,177 мкг/мл) через 6 часов после введения. В это же время наблюдалось достижение максимума и при пероральном введении СЭ ШБ, но при этом концентрация байкалина была достоверно выше на 60%. Через 8 часов концентрация байкалина снизилась до 6,20±0,159 мкг/мл, но была достоверно выше, чем после перорального введения СЭ ШБ в 4,4 раза. Через 10 часов, как и при пероральном введении, байкалин в сыворотке крови не определялся.
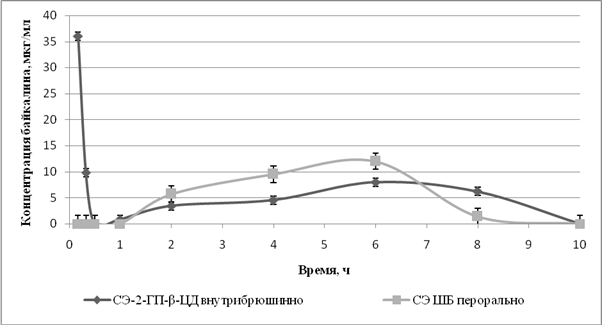
Рис.1. Концентрация байкалина в сыворотке крови крыс при пероральном введении СЭ ШБ и при внутрибрюшинном введении СЭ-2-ГП-β-ЦД
Таким образом, изменение концентрации байкалина в сыворотке крови в зависимости от времени при внутрибрюшинном введении СЭ-2-ГП-β-ЦД имело двухфазный характер в отличие от перорального введения СЭ ШБ, причем второй пик повышения концентрации после внутрибрюшинного введения совпадал с максимумом, который достигался через 6 часов после перорального введения. При этом максимальная концентрация байкалина при пероральном введении СЭ ШБ была достоверно выше на 60%, чем при внутрибрюшинном введении СЭ-2-ГП-β-ЦД, но затем после достижения пика наблюдалось ее более быстрое снижение по сравнению с внутрибрюшинным введением, когда более высокие концентрации поддерживались более длительный период времени (с 7 до 10 часов).
Изучение распределения байкалина выявило его присутствие в органах-мишенях – печени и почках (рисунок 2). При этом максимальная концентрация байкалина при обоих способах введения была зафиксирована в печени раньше, чем в почках. После перорального введения СЭ ШБ в дозе 300 мг/кг максимальная концентрация в печени достигалась через 6 часов и составила 4,5±0,52 мкг/г, а после внутрибрюшинного введения СЭ-2-ГП-β-ЦД в дозе 15 мг/кг она наблюдалась раньше – через 4 часа и была достоверно выше на 80% (составила 8,1±0,75 мкг/г).
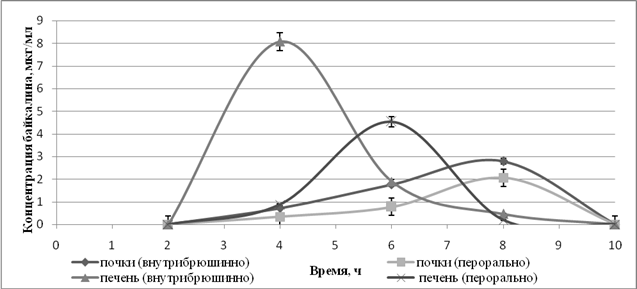
Рис.2. Концентрация байкалина в печени и почках крыс при пероральном введении СЭ ШБ и при внутрибрюшинном введении СЭ-2-ГП-β-ЦД
Полная элиминация байкалина из печени после перорального введения произошла через 8 часов, а после внутрибрюшинного введения – на 2 часа позже – через 10 часов. Максимальная концентрация байкалина в почках при обоих способах введения достигалась через 8 часов и ее значения достоверно не отличались при внутрибрюшинном введении (2,8±0,25 мкг/г) и при пероральном введении (2,1±0,22 мкг/г). Полная элиминация из почек наблюдалась через 10 часов в обоих случаях.
Полученные нами данные свидетельствуют о присутствии байкалина в органах-мишенях – печени и почках, как при пероральном, так и при внутрибрюшинном введениях. При этом максимальная концентрация байкалина, которая достигается в печени после внутрибрюшинного введения СЭ-2-ГП-β-ЦД в дозе 15 мг/кг, почти в 2 раза выше максимальной концентрации в этом органе после перорального введения СЭ ШБ в дозе 300 мг/кг. В почках создаются практически равные концентрации байкалина после внутрибрюшинного и перорального введения исследуемых субстанций, несмотря на существенные различия в оптимальных терапевтических дозах СЭ ШБ и СЭ-2-ГП-β-ЦД.
Заключение
Таким образом, внутрибрюшинное введение СЭ-2-ГП-β-ЦД позволяет уменьшить оптимальную терапевтическую дозу в 20 раз, не уменьшая концентрации действующего начала в органах-мишенях. Кроме того, некоторые регистрируемые эффекты, позволяют заключить о пролонгированности действия СЭ-2-ГП-β-ЦД (более медленная элиминация байкалина из крови и печени). Тот факт, что для достижения терапевтических концентраций байкалина в организме требуется введение peros значительно более высокой дозы СЭ ШБ, чем при внутрибрюшинном введении СЭ-2-ГП-β-ЦД, говорит о наличии достаточно существенного метаболизма байкалина в кишечнике при пероральном способе введения.
Рецензенты:Черников М.В., д.м.н., заведующий кафедрой биологии и физиологии Пятигорского медико-фармацевтического института - филиала ГБОУ ВПО ВолгГМУ Минздрава России, г.Пятигорск;
Погорелый В.Е., д.б.н., профессор кафедры фармакологии с курсом клинической фармакологии Пятигорского медико-фармацевтического института - филиала ГБОУ ВПО ВолгГМУ Минздрава России, г.Пятигорск.
Библиографическая ссылка
Потапова А.А., Доркина Е.Г., Ремезова И.П. ИЗУЧЕНИЕ ФАРМАКОКИНЕТИКИ БАЙКАЛИНА ПРИ РАЗЛИЧНЫХ СПОСОБАХ ВВЕДЕНИЯ СУХОГО ЭКСТРАКТА ШЛЕМНИКА БАЙКАЛЬСКОГО (SCUTELLARIAE BAICALENSIS GEORGI) // Современные проблемы науки и образования. 2015. № 6. ;URL: https://science-education.ru/ru/article/view?id=22875 (дата обращения: 20.02.2026).



