Показано, что превышение физиологической нагрузки на хрящевую ткань приводит в первую очередь к снижению содержания в ней протеогликанов (ПГ) – сложных белково-углеводных молекул, обеспечивающих упругие и лубрикационные свойства хряща, а также многие физиологические процессы в ткани [3, 6, 7]. В экспериментах на животных продемонстрирована неоднородность структуры суставного хряща, которая усиливается при развитии ОА [1, 2, 15]. В разных топографических зонах пораженного коленного сустава у больных ОА структура ПГ и состав их углеводной части – гликозаминогликанов (ГАГ) – значительно различается, но при этом сохраняется экспрессия генов основных структурных элементов матрикса хряща – аггрекана, декорина, коллагена II, а также генов регуляторных белков пролиферации и дифференцировки хондроцитов [2, 4]. Это дало основание предполагать, что у больных ОА коленного сустава с терминальными стадиями заболевания в разных топографических зонах дегенеративные изменения хряща специфичны, и активность резидентных клеток направлена на формирование внеклеточного матрикса, адаптированного к механическим нагрузкам. Поэтому целью нашего исследования явилось изучение особенностей дегенеративного процесса в хряще разных топографических зон коленного сустава у больных ОА и его влияния на структуру протеогликанов. Для этого мы провели сравнительный анализ морфологической структуры хряща, биохимических характеристик ПГ и их углеводной части –ГАГ в разных топографических зонах коленного сустава пациентов с ОА.
Материалы и методы
Исследовали образцы хряща из разных топографических зон коленного сустава, испытывающих разную биомеханическую нагрузку вследствие варусной деформации, у 11 больных идиопатическим ОА III стадии в возрасте от 65 до 75 лет, отобранных после операции эндопротезирования. Хрящевую ткань забирали из следующих зон: задний край внутреннего мыщелка бедра, который, в силу ограничения движения в суставе, оказывается в стороне от основной двигательной нагрузки; латеральный мыщелок большой берцовой кости, испытывающий относительно небольшие нагрузки; медиальный мыщелок большой берцовой кости со стороны варусной деформации, подверженный максимальным нагрузкам.
Для исследования морфологической структуры ткань фиксировали в 10 % формалине. После стандартной гистологической обработки срезы окрашивали гематоксилин-эозином и альциановым синим 8GX. Структуру хряща рассматривали под микроскопом Zeis Axiostar plus с увеличением 10х10, 10х20. Количество клеток подсчитывали в поверхностной и средней зоне хряща в трёх последовательных квадратах площадью 0,01мм2. Для сравнения в каждой зоне проведено 60 пар измерений. Площади и периметры клеток и ядер (ядерно-цитоплазматические отношения) подсчитывали с помощью программы расчета коэффициента формы фирмы «Микромед». Обработку статистических данных проводили с использованием комплекса оптико-структурного анализа «Carl Zeiss», «Axion Vision-3», «Motic Vision».
ПГ из ткани хряща выделяли последовательной экстракцией растворами разной природы: 0,14М NaCl, 4М гуанидин-HCl. Оставшийся нерастворенным материал обрабатывали раствором папаина для полного извлечения молекул, прочно связанных с сетью коллагена [3]. Количество ПГ содержанию сульфатированных ГАГ (Сгаг), качественный состав ГАГ определяли по гексуроновым кислотам и галактозе. Результаты обрабатывали статистически с использованием программы STATISTICA. Для выявления достоверности различий выбран критерий Манна-Уитни. Достоверные различия принимали при р<0,05.
Результаты и обсуждение
Результаты морфологических исследований.
В хряще заднего края внутреннего мыщелка бедра под поверхностным слоем, содержащим одиночные клетки, ткань заполнена многочисленными клетками, которые располагаются хаотично или группами, формируя подобие изогенных структур (рис. 1 а, б).
а 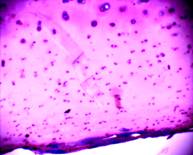 б
б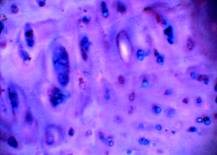 в
в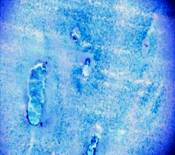
Рис. 1. Хрящ из заднего края внутреннего мыщелка бедра
а – поверхностный слой (окраска гематоксилин-эозин, 10х10); б – глубокие слои хряща, колонкоподобные структуры (окраска альциановым синим, 20х10); в – нарушенные тинкториальные свойства матрикса, (окраска Хейл, 20х10)
Структура самого матрикса мозаична: встречаются участки гомогенного, равномерно окрашенного основного вещества, и участки с частично нарушенными тинкториальными свойствами. В глубокой зоне хряща на границе с костью встречаются участки с колонкоподобными клеточными структурами и дистрофическими изменениями в виде запустевших лакун (рис.1в). Таким образом, структура суставного хряща в зоне внутреннего мыщелка бедра, в основном, сохранена, но имеет локальные проявления дегенеративных изменений.
Хрящ латерального мыщелка большой берцовой кости. Поверхностный слой покрыт паннусом, под которым располагаются округлые клетки, напоминающие малодифференцированные хондроциты (рис. 2а). В гомогенном матриксе встречаются регенераты из малодифференцированных хондробластов (рис. 2б). В нижних слоях видны колонкоподобные структуры, в которых клетки образуют своеобразные цепочки, но отсутствует общая лакуна (рис. 2в). В регенератах и колонкообразных структурах интенсивная окраска альциановым синим свидетельствует об активном синтезе ГАГ (рис. 2г). В целом, морфологическая структура хряща этой зоны содержит области сохраненного гиалинового хряща с признаками дегенеративных изменений и активными регенераторными процессами, а также появлением характеризуется появлением недифференцированных клеток.
а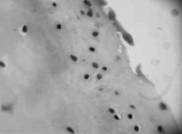 б
б 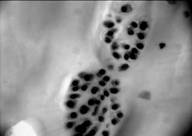 в
в
г 
Рис.2. Хрящ из латерального мыщелка большой берцовой кости; а – малодиференцированные хондроциты в поверхностной зоне (окраска гематоксилин-эозин,10х20); б – регенераты малодифференцированных хондробластов (окраска гематоксилин-эозином, 10х40); в – хрящ, прилегающий к кости (гематоксилин-эозин. 10х10), г – присутствие ГАГ в клетках и прилегающем матриксе хряща
(гематоксилин-эозин. 10х20)
Хрящ в зоне медиального мыщелка большой берцовой кости сохранен по латеральному краю костной поверхности. Поверхностная зона его разрушена (рис. 3а). В центре он представлен плотной фиброзной тканью с редкими клетками. Глубже располагается бесструктурный матрикс, в котором встречаются редкие клеточные кластеры пролиферирующих клеток (рис. 3б). В глубокой зоне отсутствуют типичные колонковые структуры, клетки располагаются поодиночке. В этой зоне матрикс окрашивается альциановым синим, выявляющим ГАГ, дискретно, что говорит об остаточных проявлениях молекулярной структуры гиалиноваого хряща в этой зоне (рис. 3в). Таким образом, в этой зоне коленного сустава хрящ представлен плотной фиброзной тканью с редкими клетками и кластерами пролиферирующих фибробластоподобных клеток с остатками структуры гиалинового хряща в глубокой зоне.
а Б
Б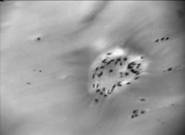 в
в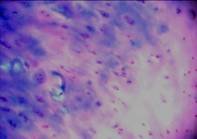
Рис.3. Хрящ из медиального мыщелка большой берцовой кости;
а – разрушенная поверхность хряща (гематоксилин-эозин, (10х10);
б –пролифераты клеток (окраска гематоксилин-эозином, 10х10);
в – глубокая зона хряща (окраска алциановым синим, 10х10)
Самые большие разрушения отмечены в поверхностной зоне хряща латерального и медиального мыщелков большой берцовой кости (рис. 2,3). Вероятно, они определяют дальнейшую структурную перестройку хрящевой ткани и изменение фенотипа клеток.
Морфометрический анализ показал, что в разных топографических зонах коленного сустава больных ОА количественные параметры клеток, отражающие их разную и метаболическую активность и фенотипические черты, различаются (табл. 1).
Таблица 1
Характеристика морфометрических параметров клеток из разных топографических зон коленного сустава человека при ОА
|
Зона коленного сустава |
Количество клеток |
Площадь клеток, мкм2 |
Площадь ядер, мкм2 |
Ядерно-цитоплазматическoе отношение |
|
Внутренний мыщелок бедра |
223,0±45,6 |
807,1±208,8 |
251,5±67,4 |
0,41±0,073 |
|
Латеральный мыщелок большой берцовой кости |
197,8±63,4* |
1715,1±357,2* |
334,2±80,5* |
0,21±0,056* |
|
Медиальный мыщелок большой берцовой кости |
76,1±12,5* |
652,7±127,7* |
324,0±54,3* |
0,39±0,091* |
*р<0,05 по сравнению с хрящом внутреннего мыщелка бедра коленного сустава.
В хряще зоны внутреннего мыщелка бедра, характеризующегося наименьшими дегенеративными изменениями относительно других зон, выявляется наибольшее количество клеток. Ядерно-цитоплазматическое отношение указывают на то, что клетки имеют компактное ядро и достаточный объем цитоплазмы, что свидетельствует об их функциональной активности, в том числе – синтетической, достаточной для поддержания структуры матрикса хряща в этой зоне. Равномерное окрашивание альциановым синим межклеточного матрикса может служить подтверждением сохранения структурированности гиалинового хряща (рис. 1в).
В хряще зоны латерального мыщелка большой берцовой кости относительно зоны внутреннего мыщелка бедра, площадь клеток увеличивается более чем в 2 раза и в 1,3 раза – площадь ядер. Относительное снижение ядерно-цитоплазматического отношения в клетках (в 2 раза), на фоне увеличения площади ядер свидетельствует об увеличении количества малодифференцированных клеток и повышенной активности биосинтетических процессов сравнительно с другими зонами, что подтверждается интенсивной окраской клеток и близлежащего матрикса альциановым синим (рис. 2г). Судя по присутствию регенератов, хрящевая ткань в этой зоне имеет потенциал к восстановлению (рис. 2б).
В наиболее нагружаемой зоне медиального мыщелка большой берцовой кости, где хрящ замещен фиброзной тканью, количество клеток снижено по сравнению с другими зонами в 2,6 раза. Ядерно-цитоплазматические отношения сопоставимы с данным параметром клеток из хряща зоны внутреннего мыщелка бедра и снижены относительно латерального мыщелка большой берцовой кости. Изменение морфометрических параметров клеток можно объяснить вариацией их фенотипических черт, в разных топографических зонах коленного сустава у пациентов с ОА. Таким образом, у больных с терминальными стадиями заболевания ОА выраженность и интенсивность дегенеративных изменений в хряще разных топографических зон различается и зависит от нагрузки, которой подвергается хрящ в данной зоне сустава.
Результаты исследования протеогликанов в хряще разных зон коленного сустава.
Прочность связей ПГ со структурами внеклеточного матрикса определяет их доступность экстракции разными растворителям и отражает физиологические процессы в ткани, связанные с её ремоделированием, синтетической способностью хондроцитов и разнообразием функций самих молекул в динамично функционирующей структуре ткани. Новосинтезированные молекулы, еще не встроенные в структуры внеклеточного матрикса и способные диффундировать в ткани, т.е. «свободные» ПГ, можно выделить 0,14 М NaCL [1], тогда как ПГ, встроенные в структуру внеклеточного матрикса, экстрагируются раствором 4 М гуанидин-НСl. Молекулы ПГ, прочно связанные в матриксе с сетью коллагена, можно извлечь только после разрушения белков папаином. Общее количество ПГ и распределение их фракций в хрящевой ткани показано в таблице 2.
Таблица 2
Характеристика протеогликанов во фракциях, полученных последовательной экстракцией разными растворителями
|
Исследуемый показатель |
задний мыщелок бедра |
латеральный мыщелок большой берцовой кости |
медиальный мыщелок большой берцовой кости |
|
|
Общее количество ПГ (по количеству Сгаг, мкг/мг сухой ткани) |
55,2±6,28 |
45,6±5,21 |
19,4±1,12* |
|
|
Количество ПГ во фракциях, последовательно выделяемых растворителями (% от общего количества) |
0,14М NaCl |
9,8± 4,67 |
21,5±5,41* |
12,1±1,91# |
|
4М гуанидин-НСl |
80,6±14,23 |
39,5±4,09* |
14,8±2,55*# |
|
|
папаин |
10,2± 3,34 |
39,1±3,67* |
73,3±10,04*# |
|
|
Общее соотношение хондроитнсульфат/кератансульфат в хряще (по количественному отношению уроновых кислот к галактозе) |
1,56±0,109 |
1,37±0,142* |
1,07±0,104*# |
|
|
Соотношение хондроитнсульфат /кератансульфат во фракциях, последовательно выделяемых растворителями |
0,14М NaCl |
1,27±0,281 |
1,37±0,326 |
3,12±0,183* |
|
4М гуанидин-НСl |
1,52±0,228 |
1,62±0,453 |
1,02±0,171*# |
|
|
папаин |
2,15±0,245 |
1,12±0,228* |
1,01±0,155* |
|
* р<0,05 – по сравнению с зоной внутреннего мыщелка бедра;
# р<0,05 – достоверные различия с зоной латерального мыщелка большой берцовой кости.
Общее количество ПГ, определеяемое по Сгаг, хряща внутреннего мыщелка бедра и латерального мыщелка большой берцовой кости близки по значению и значительно выше – в 2,4 раза, чем в хряще медиального мыщелка (табл. 2). При этом количество Сгаг во фракциях значительно отличается от зоны к зоне.
Матрикс хряща зоны внутреннего мыщелка бедра, испытывающего наименьшую механическую нагрузку, на 80 % состоит из встроенных в матрикс ПГ, выделяемых 4М гуанидин-HCl, тогда как «свободные» и прочно связанные с коллагеном ПГ представлены, приблизительно в одинаковом количестве – 9,8 % и 12,1% соответственно. Преобладание фракции встроенных ПГ в матриксе этой зоны объясняет его равномерную окраску альциановым синим (рис. 1). Вероятно, малая механическая нагрузка в этой зоне определяет относительно небольшую продукцию коллагена клетками и поэтому слабо развитую сеть коллагена, в формировании которой участвуют прочно связанные с сетью коллагена ПГ [7]. Можно предположить, что хрящевая ткань в этой зоне обладает относительно слабыми прочностными свойствами, но они, скорее всего, соответствуют биомеханическим нагрузкам этой зоны и обеспечивают необходимую прочность.
В матриксе хряща зоны латерального мыщелка, испытывающего более высокую нагрузку по сравнению с хрящом внутреннего мыщелка бедра, функциональная активность клеток отражается в повышении относительного содержания «свободных» ПГ – 20 % от общего количества против 10 % в других зонах. Встроенных в структуры внеклеточного матрикса и прочно связанных с сетью коллагена ПГ содержится до 80 %. При этом на каждую из этих фракций приходится почти по 40 %, что можно рассматривать как адаптацию хрящевой ткани в этой зоне к более высоким биомеханическим нагрузкам, которые способствуют формировании плотной, упругой ткани. Это наблюдение подтверждает известное положение, что умеренная механическая нагрузка необходима для нормального гомеостаза хряща в качестве анаболического стимула хондроцитов [8,14].
В фиброзной ткани зоны медиального мыщелка, испытывающего максимальную нагрузку в коленном суставе, основное количество ПГ – 73 % общего количества, прочно связано с сетью коллагена и выделяется только после обработки ткани папаином. Относительное содержание «свободных» ПГ аналогично зоне внутреннего мыщелка бедра, в котором ткань наименее поражена дегенеративными изменениями и составляет 12 % общего количества. Количество ПГ в структуре внеклеточного матрикса в этой зоне наименьшее и составляет 15 % общего количества, что в 2,7 раза меньше, чем в латеральном мыщелке, и в 5,3 раза ниже зоны внутреннего мыщелка бедра. Учитывая, что общее количество ПГ в этой зоне в 2 раза меньше, чем в других зонах, а также учитывая данные морфологии (рис. 3), можно утверждать, что повышение содержания фракции «связанных» ПГ отражает развитие фибропластических процессов в ткани.
Таким образом, в хрящевой ткани разных топографических коленного сустава прочность связей ПГ со структурами внеклеточного матрикса и сетью коллагена существенно различается и, вероятно, зависит от биомеханической нагрузки, метаболической активности клеток и развития фибропластических процессов, т.е. патогенетических факторов, определяющих течение ОА.
Основными ГАГ хряща являются хондроитин сульфат и кератан сульфат. Поскольку уроновые кислоты являются структурными единицами хондроитин сульфата, а галактоза – кератан сульфата, то по коэффициенту отношения их количества можно судить об относительном содержании основных типов ГАГ (табл. 2). Соотношение хондроитин сульфата к кератан сульфату в разных топографических зонах существенно различается. В зоне внутреннего мыщелка бедра коэффициент отношения превышает аналогичные коэффициенты других топографических зон, т.е. указывает на относительное преобладание хондроитин сульфата. Тогда как в зоне латерального мыщелка снижение этого коэффициента отражает накопление кератан сульфата. В фиброзной ткани медиального мыщелка соотношение этих ГАГ соответствует единице. Таким образом, в хрящах разных топографических зон по мере увеличения механической нагрузки увеличивается относительное содержание ПГ, несущих цепи кератан сульфата и снижается количество хондроитин сульфата. Известно, что кератансульфат накапливается в ткани в условиях кислородной недостаточности [5]. Гипоксия существенно влияет на обменные процессы в суставном хряще: понижение напряжения кислорода относительно физиологического уровня снижает активность катаболических ферментов, участвующих в разрушении хряща, стимулирует анаболические процессы и подавляет гипертрофическое перерождение хондроцитов [8]. Вероятно, совместное влияние механических нагрузок и гипоксии определяет фенотипические черты клеток и развитие фибропластических процессов в суставном хряще. Динамика изменения количества и качественного состава ГАГ, относительное количество «свободных» ПГ и прочно связанных с сетью коллагена в разных топографических зонах сустава отражает специфику дегенеративных процессов в суставе и существенно зависит от патогенетических факторов развития остеоартроза.
Заключение
В разных топографических зонах коленного сустава больных ОА, морфологическая и биохимическая структура хряща существенно различается. Эти различия обусловлены изменением механических нагрузок в суставе и, вероятно, развивающейся гипоксией вследствие склероза подлежащей кости, и выражаются в вариабельности плотности клеток, их фенотипических черт, морфологических характеристиках ткани. Свойства ПГ и химические характеристики их углеводной части – ГАГ отражают особенности структуры хряща разных топографических зон сустава у пациентов с идиопатическим ОА коленного сустава. Необходимость механической нагрузки для нормального гомеостаза хряща справедлива и для хряща больных ОА: биомеханическая нагрузка на хрящ, адекватная упруго-прочностным характеристикам, стимулирует синтетическую активность клеток и обеспечивает формирование ткани, адаптированной к существующим условиям в пораженном коленном суставе. Избыточная нагрузка на фоне гипоксии стимулируют повреждение хряща и замещение его фиброзной тканью. Несмотря на развитие фибропластических процессов в наиболее пораженной зоне сустава, согласно нашим исследованиям, клетки сохраняют синтетический потенциал основных структурных элементов суставного хряща. Доказательное изучение регенераторного потенциала клеток этой зоны планируется в следующем цикле наших исследований.
Авторы выражают благодарность профессору, главному научному сотруднику ННИИТО А. М. Зайдман за помощь в написании и обсуждении морфологического раздела статьи.
Работа выполнена при поддержке гранта Президента Российской Федерации для государственной поддержки молодых российских ученых №МК-6370.2015.7
Рецензенты:
Матвеева Е. Л., д.б.н., ведущий научный сотрудник лаборатории биохимии ФГБУ «РНЦ «Восстановительная травматология и ортопедия» им. акад Г. И. Илизарова» Минздрава РФ, г. Курган;
Павлов В. В., д.м.н., главный научный сотрудник, зав. отделением травматологии № 2 ФГБУ «Новосибирский научно-исследовательский институт травматологии и ортопедии им. Я. Л. Цивьянна Минздрава России», г. Новосибирск.
Библиографическая ссылка
Русова Т.В., Воропаева А.А., Корель А.В., Щелкунова Е.И. СТРУКТУРНО-ФУНКЦИОНАЛЬНЫЕ ОСОБЕННОСТИ ХРЯЩЕВОЙ ТКНАНИ КОЛЕННОГО СУСТАВА ПРИ ОСТЕОАРТРОЗЕ // Современные проблемы науки и образования. 2015. № 5. ;URL: https://science-education.ru/ru/article/view?id=22665 (дата обращения: 11.02.2026).



