Макрофиты как один из основных компонентов водной экосистемы являются лабильным и уязвимым звеном системы самоочищения воды. Предотвращение антропогенного снижения самоочистительного потенциала рек - одно из условий устойчивого использования ресурсов водных экосистем и биосферы в целом.
Макрофитам свойственна консервативность по отношению к кратковременным изменениям среды, но изменения растительности в течение нескольких лет могут свидетельствовать об антропогенной трансформации водных экосистем. Именно поэтому макрофиты используют как объект для многолетних наблюдений в оценке экологического состояния водоемов [2].
При действии различных стресс-факторов, в качестве которого выступает и загрязнение ПХБ, в живых организмах происходят изменения на биохимическом уровне: активизируются окислительные процессы. Ответной реакцией макрофитов на увеличение активности свободно-радикального окисления липидов является повышение синтеза антиоксидантов. В результате действия токсикантов в растениях устанавливается определенный баланс между интенсивностью процессов перекисного окисления и антиоксидантной активностью. Этот баланс отражает адаптационные возможности организмов, т.е. приспособленность к изменяющимся условиям среды. Биохимический ответ растительных организмов водной экосистемы как результаты первичной реакции на действие стресс-факторов изучен недостаточно полно и требует более детального исследования в целях разработки наиболее эффективных путей защиты водной экосистемы от загрязнения ПХБ.
Целью данного исследования явилась оценка ответных реакций макрофитов на токсическое действие полихлорбифенилов, что определило ряд задач исследования:
1) в модельном эксперименте определить влияние различных концентраций полихлорированных бифенилов на состояние свободно-радикального окисления, антиоксидантную защиту;
2) определить степень воздействия поллютантов на фотосинтезирующий и генетический аппарат макрофитов.
Материал и методы исследования
В ранних исследованиях [1] нами установлено, что макрофиты интенсивно аккумулируют значительные количества токсикантов, что и определило выбор в качестве объекта исследования биохимических ответов гидробионтов в экосистеме на действия ПХБ именно макрофитов. Для решения поставленных задач использованы модельные эксперименты, на основе которых определяли воздействие различных концентраций ПХБ на макромолекулярном уровне на водные растения (перестройки фотосинтезирующей системы и генетического аппарата, потенциальные возможности защиты растительных организмов на данное воздействие). В качестве тест-объекта использовали доминирующий в р. Урал вид макрофитов - роголистник погруженный (Ceratophyllum demersum L.).
Изучение влияния ПХБ на макрофиты проводили с применением классического для токсикологических исследований качества воды подхода с использованием однократных добавок контаминантов [8].
В качестве воздействующего вещества применяли раствор Совола (смесь тетра-, пента- и гекса-ПХБ) в гексане с концентрацией 0,005; 0,001; 0,0012 мг/л. Данные концентрации соответствовали минимальному, максимальному значению ПХБ в реке Урал [1], а также ПДК данных поллютантов для воды водных объектов хозяйственно-питьевого и культурно-бытового водопользования. В качестве контроля выступали растения, содержащиеся в воде без добавления токсикантов.
Уровень воды в модельных системах в опытах с однократными добавками поддерживали путем мониторинга (через каждые двое суток) за снижением уровня воды и добавления в аквариумы воды до отметки требуемого уровня.
После периода акклиматизации были взяты пробы из всех аквариумов и проведены определения исходного содержания исследуемых биохимических показателей. Затем в аквариумы были добавлены ПХБ в различных концентрациях. После этого биохимические исследования были проведены через 2, 5, 9, 12 суток.
Степень свободно-радикального окисления определяли по содержанию соединений, реагирующих с тиобарбитуровой кислотой (ТБКРС) [10], об антиоксидантной активности макрофитов судили по их способности ингибировать аутоокисление адреналина in vitro и тем самым предотвращать образование активных форм кислорода [7]. В экстрактах определяли активность каталазы [3], массовую долю суммы Р-активных флавоноидов [5], количественное содержание аскорбиновой кислоты [4], хлорофиллов a и b, каротиноидов [9].
Для моделирования оценки генотоксичности ПХБ использовали два биотеста: для учета видимых мутаций (ВМ) - Chlorella vulgaris, хромосомных аберраций (ХА) в меристеме - Allium cepa [6].
Для статистической обработки результатов исследований и корреляционного анализа применяли компьютерные программы EXCEL2000 (Microsoft, USA) и Statistika 10.0. Была построена математическая модель зависимости концентрации от значений биохимических показателей Ceratophyllum demersum при помощи «Построение деревьев классификации».
В качестве целевой переменной выступала «концентрация ПХБ» (варианты: 0,0 мг/л - контроль; 0,0005 мг/л; 0,001 мг/л; 0,0012 мг/л). Предикторами в построенной модели выступали: активность каталазы, содержание ТБКРС, аскорбиновой кислоты, флавоноидов, хлорофилла а и хлорофилла b, каротиноидов, антиоксидантная активность.
Определение статистической значимости различий между сравниваемыми параметрами проводилось с расчетом критерия Стьюдента при обязательном выполнении условий нормальности (критерий Колмагорова-Смирнова) в сравниваемых группах и равенства дисперсии (критерий Левина). Пороговый уровень статистической значимости принят при p≤0,05.
Результаты исследования и их обсуждение
По результатам нашего исследования такие стрессовые факторы, как ПХБ, вызывали различные по амплитуде и скорости изменения содержания ТБКРС, а формирование ответной реакции растительного организма зависело от концентрации поллютантов.
Результаты модельных экспериментов показали, что токсическое воздействие ПХБ в концентрациях, равных уровню ПДК и выше, проявляется в нарушениях процесса свободно-радикального окисления в макрофитах, о чем свидетельствуют изменения концентрации ТБКРС в их тканях. Так, в растениях, культивируемых при концентрациях ПХБ, равных ПДК и выше, по истечении эксперимента содержание ТБКРС превышало контроль в 1,6-1,7 раза. В то же время концентрация поллютантов ниже ПДК приводила к снижению ТБКРС в тканях макрофитов в 1,9 раза по сравнению с контролем. Повышение содержания ТБКРС под воздействием концентраций ПХБ, равных или немного превышающих ПДК, свидетельствует о том, что в ответ на воздействие токсикантов растение испытывает стресс и вступает в первичную стрессовую реакцию - реакцию тревоги, проявляющуюся в изменении интенсивности биохимического процесса - свободно-радикального окисления (табл. 1).
Таблица 1
Динамические изменения концентрации ТБКРС и в процентах (%) к контролю в Ceratophyllum demersum под воздействием различных концентраций ПХБ
|
Экспозиция, день |
Контроль
|
Вариант опыта (концентрация ПХБ, мг/л) |
|||||
|
0,0005 |
0,001 |
0,0012 |
|||||
|
Концентрация ТБКРС, мкмоль/г |
% |
Концентрация ТБКРС, мкмоль/г |
% |
Концентрация ТБКРС, мкмоль/г |
% |
||
|
До внесения ПХБ |
15,527±3,38 |
15,527±3,38 |
100 |
15,527±3,38 |
100 |
15,527±3,38 |
1100 |
|
2 |
18,194±1,23 |
15,097±4,19 |
83,0 |
22,839±1,37 |
125,5 |
9,892±3,45 |
54,4 |
|
5 |
16,43±2,32 |
29,183±3,46 |
177,6 |
27,957±3,1 |
170,2 |
32,129±2,95 |
195,5 |
|
9 |
14,409±4,69 |
13,419±2,34 |
93,1 |
24,344±2,19 |
168,9 |
23,054±1,44 |
160,0 |
|
12 |
13,462±1,99 |
7,097±2,32 |
52,7 |
22,839±3,16 |
169,7 |
21,763±1,89 |
161,7 |
Известно, что уровень свободно-радикального окисления липидов в клетке поддерживается постоянным благодаря многоуровневой антиоксидантной системе защиты, а сбалансированность между окислением и антиоксидантной активностью является необходимым условием для поддержания нормальной жизнедеятельности клетки. В связи с этим представляло интерес в лабораторных условиях выяснить особенности изменчивости и функционирования компонентов антиоксидантной защиты макрофитов от воздействия ПХБ.
Полученные данные по изучению активности каталазы в Ceratophyllum demersum во временном аспекте при разных концентрациях ПХБ представлены на рисунке 1.
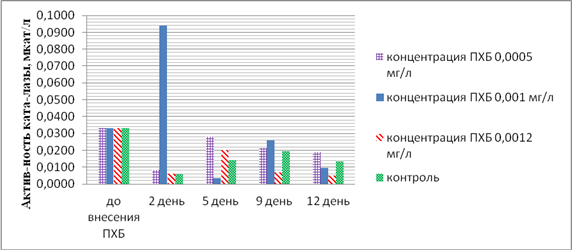
Рис. 1. Активность каталазы Ceratophyllum demersum в эксперименте
В наших исследованиях установлено, что разные концентрации ПХБ как стрессовые факторы вызывали различные по амплитуде и скорости изменения активности каталазы, что отличалось от колебаний содержания фермента в контроле, а это свидетельствует о том, что формирование ответной реакции растений на воздействие токсиканта в большей степени зависит не их токсического воздействия, а от концентрации поллютантов.
Результаты количественного определения содержания аскорбиновой кислоты в Ceratophyllum demersum представлены на рисунке 2.
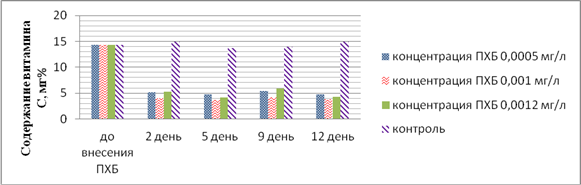
Рис. 2. Динамические изменения содержания аскорбиновой кислоты в экстрактах Ceratophyllum demersum в модельном эксперименте
Как видно из представленных данных, содержание биологически активных веществ на примере аскорбиновой кислоты в растениях варьирует в зависимости от дня эксперимента.
Известно, что аскорбиновая кислота выполняет защитную функцию уже на первых этапах образования активных форм кислорода в гидрофильной среде, а уменьшение содержания аскорбата в исследуемом макрофите, возможно, связано с включением защитных механизмов к комплексу неблагоприятных факторов окружающей среды.
Результаты количественного определения суммарного содержания флавоноидов в Ceratophyllum demersum во временном аспекте представлены на рисунке 3.
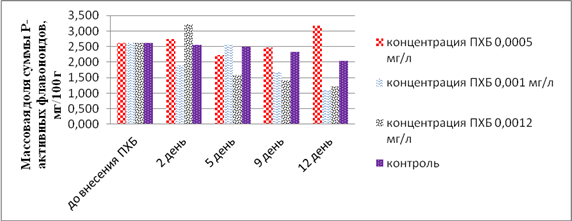
Рис. 3. Динамические изменения массовой доли суммы Р-активных флавоноидов в экстрактах Ceratophyllum demersum в модельном эксперименте
Результаты модельного эксперимента показали, что только в макрофитах из аквариума с концентрацией ПХБ 0,0005 мг/л на 12-й день эксперимента происходило увеличение содержания флавоноидов в 1,2 раза (3,162±0,04 мг/100 г) по сравнению с начальным значением (2,611±0,32 мг/100 г). Вероятно, высокое содержание флавоноидов в растениях вызвано действием воды, загрязненной ПХБ, что привело к активации антиоксидантной системы защиты растения и снижению концентрации конечного продукта свободно-радикального окисления в макрофите.
В то же время в Ceratophyllum demersum из аквариумов с более высоким содержанием ПХБ наблюдалось уменьшение данного показателя. Так, из аквариума с концентрацией ПХБ 0,001 мг/л оно составило 2,4 раза, из аквариума с концентрацией ПХБ 0,0012 мг/л - 2,2 раза, в то время как в контрольном аквариуме - 1,3 раза. Возможно, первичный ответ Ceratophyllum demersum на загрязнение окружающей среды ПХБ проявился в повышении конечного продукта свободно-радикального окисления Л, в результате чего, по-видимому, срабатывали защитные механизмы, в том числе и флавоноидная система, происходило расходование флавоноидов, что и отразилось на снижении их концентрации в растениях.
В качестве основного показателя, определяющего состояние антиоксидантной системы Ceratophyllum demersum под влиянием ПХБ, была использована антиоксидантная активность (АОА).
Расчет антиоксидантной активности показал, что исследуемые растительные экстракты проявляют разные значения показателя в условиях воздействия различных концентраций ПХБ, которые менялись в разные сроки эксперимента (рис. 4).
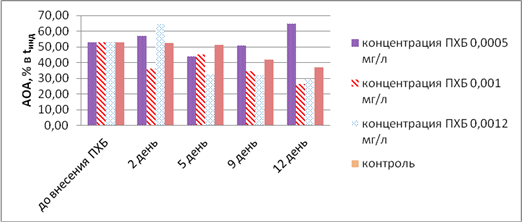
Рис. 4. Динамические изменения антиоксидантной активности экстрактов Ceratophyllum demersum в модельном эксперименте
Так, если в начале эксперимента АОА соответствовала 52,96 %, то после добавления ПХБ ее величина варьировала от 26,13 до 64,62 % в разные дни эксперимента.
По истечении модельного эксперимента было показано, что ПХБ в зависимости от концентрации по-разному влияет на АОА экстрактов Ceratophyllum demersum. Так, если в контрольной пробе показатель постепенно снижался с 52,96 до 37,10% (снижение составило 1,4 раза), то в образцах, содержащихся в аквариуме с концентрацией ПХБ 0,0005 мг/л (минимальное содержание ПХБ в р. Урал в районе Оренбурга), наблюдалась стимуляция АОА до 64,62% (увеличение составило 1,2 раза). Это подтверждает тот факт, что, по-видимому, Ceratophyllum demersum легче приспосабливается к изменяющимся условиям при медленном развитии неблагоприятных факторов, т.е. при очень низкой концентрации поллютантов.
Более высокие концентрации ПХБ (0,001 мг/л - ПДК для воды, 0,0012 мг/л - максимальное содержание ПХБ в р. Урал в районе Оренбурга), наоборот, приводили к более резкому снижению показателя АОА (до 26,13 и 29,0) в 2 и 1,8 раз. В то же время, по нашим результатам, под действием поллютантов с концентрацией 0,001 мг/л и 0,0012 мг/л в конце модельного эксперимента наблюдалось повышение конечного продукта свободно-радикального окисления (ТБКРС), при этом, по-видимому, происходило расходование флавоноидов, их концентрация в растениях снижалась, а вследствие этого уменьшалась и антиоксидантная защита. Таким образом, можно предположить определенную роль активности каталазы, флавоноидов, аскорбиновой кислоты в сохранении макрофитов при токсическом действии ПХБ.
При воздействии экотоксикантов на растения серьезные изменения наблюдаются в строении их клеток и особенно фотосинтезирующего аппарата, так как многие поллютанты концентрируются в клетках (преимущественно в хлоропластах и вакуолях), поэтому огромное значение при исследовании влияния токсикантов на физиологическое состояние растений имеет изучение пластичности фотосинтетического аппарата, его способности приспосабливаться к изменяющимся условиям среды обитания фитоценоза.
Таблица 2
Динамические изменения фотосинтезирующих пигментов и каротиноидов Ceratophyllum demersum под воздействием различных концентраций ПХБ
|
Время взятия проб |
Концентрация ПХБ, мг/л |
Содержание пигментов, мг/ г сырой массы |
Соотношение пигментов |
||||
|
Хлорофилл а |
Хлорофилл в |
Сумма хл. |
Каротиноиды |
Хл. а Хл. в |
Хл.(а+в) кар. |
||
|
До внесения ПХБ |
0,0005 |
0,382±0,002 |
0,726±0,008 |
1,108 |
0,021±0,003 |
0,526 |
52,762 |
|
0,001 |
0,382±0,002 |
0,726±0,008 |
1,108 |
0,021±0,003 |
0,526 |
52,762 |
|
|
0,0012 |
0,382±0,002 |
0,726±0,008 |
1,108 |
0,021±0,003 |
0,526 |
52,762 |
|
|
контроль |
0,382±0,002 |
0,726±0,008 |
1,108 |
0,021±0,003 |
0,526 |
52,762 |
|
|
2-й день |
0,0005 |
0,725±0,005 |
0,405±0,017 |
1,13 |
0,01±0,004 |
1,79 |
113,0 |
|
0,001 |
0,69±0,005 |
0,379±0,008 |
1,069 |
0,021±0,003 |
1,821 |
50,905 |
|
|
0,0012 |
0,388±0,005 |
0,332±0,012 |
0,72 |
0,105±0,003 |
1,169 |
6,261 |
|
|
контроль |
0,941±0,008 |
0,986±0,036 |
1,927 |
0,154±0,009 |
0,954 |
12,513 |
|
|
5-й день |
0,0005 |
0,288±0,005 |
0,519±0,003 |
0,807 |
0,216±0,002 |
0,555 |
3,736 |
|
0,001 |
0,285±0,005 |
0,416±0,01 |
0,701 |
0,208±0,003 |
0,685 |
3,37 |
|
|
0,0012 |
0,16±0,001 |
0,231±0,007 |
0,391 |
0,175±0,005 |
0,693 |
2,234 |
|
|
контроль |
0,311±0,002 |
0,558±0,006 |
0,869 |
0,218±0,002 |
0,557 |
3,986 |
|
|
9-й день |
0,0005 |
0,231±0,007 |
0,296±0,019 |
0,527 |
0,296±0,004 |
0,78 |
1,78 |
|
0,001 |
0,201±0,002 |
0,21±0,009 |
0,411 |
0,266±0,004 |
0,957 |
1,545 |
|
|
0,0012 |
0,132±0,01 |
0,19±0,014 |
0,322 |
0,145±0,003 |
0,695 |
2,221 |
|
|
контроль |
0,318±0,002 |
0,497±0,01 |
0,815 |
0,3 ±0,01 |
0,64 |
2,717 |
|
|
12-й день |
0,0005 |
0,169±0,004 |
0,161±0,012 |
0,33 |
0,267±0,004 |
1,05 |
1,236 |
|
0,001 |
0,24±0,003 |
0,14±0,01 |
0,38 |
0,268±0,005 |
1,714 |
1,418 |
|
|
0,0012 |
0,094±0,004 |
0,102±0,009 |
0,196 |
0,118±0,001 |
0,922 |
1,661 |
|
|
контроль |
0,325±0,008 |
0,476±0,007 |
0,801 |
0,303±0,004 |
0,683 |
2,644 |
|
Проведенный анализ динамических изменений в содержании хлорофиллов а и b и каротиноидов Ceratophyllum demersum показал, что фотосинтетический пигмент хлорофилла b значительно более чувствителен к загрязнению ПХБ, нежели хлорофилл а. Об этом свидетельствует тот факт, что в течение эксперимента содержание хлорофилла b уменьшилось у макрофитов из всех аквариумов с различной концентрацией ПХБ в 1,5-7,12 раз, а хлорофилла а - в 1,18-4 раза. В то же время для содержания каротиноидов в Ceratophyllum demersum характерно увеличение их концентрации под влиянием загрязнения. Это объясняется тем, что каротиноиды являются наиболее распространенным и активным метаболитом живых организмов, участвующим в системе защиты клеток от воздействия факторов внешней среды.
Эксперимент показал, что произрастание растений в условиях, характеризующихся действием малых концентраций ПХБ в воде, приводило к изменению величины показателя «хл. (а+в)/кар.», что может быть следствием свободно-радикального окисления, степень которого возрастает при окислительном стрессе.
Проведенный нами эксперимент показал, что исследуемые загрязнители, даже в относительно невысоких концентрациях, способны вызывать снижение содержания основных форм фотосинтезирующих пигментов в тканях водного растения. Мы можем предположить, что ПХБ приводят к серьезным нарушениям функционирования пластид, а именно к ингибированию синтеза собственно пигментов и нарушению производства новых фотосинтетических органелл.
В итоге загрязнения водных объектов ПХБ приводит к изменению интенсивности фотосинтеза и дыхания водных растений. Полученные данные о выявленной чувствительности фотосинтезирующего пигментов к действию ПХБ, изменении их соотношения могут быть использованы для диагностической оценки степени и устойчивости растений к действию токсикантов.
Для анализа зависимости исследуемых биохимических показателей (таких как активность каталазы, содержание ТБКРС, аскорбиновой кислоты, флавоноидов, хлорофилла а и хлорофилла b, каротиноидов, антиоксидантная активность) от концентрации ПХБ был применен метод моделирования: «Построение деревьев классификации», где целевой переменной выступала «концентрация ПХБ» (варианты: 0,0 мг/л - контроль; 0,0005 мг/л; 0,001 мг/л; 0,0012 мг/л). Была последовательно выявлена многомерная зависимость концентрации ПХБ при различных значениях анализируемых биохимических показателей. По графику значимости предикторов для построенной модели мы можем указать, какие биохимические показатели наиболее связаны с различными концентрациями ПХБ. В зависимости от содержания поллютантов в воде выделено 4 ведущих фактора: концентрация хлорофилла b, содержание витамина С, антиоксидантная активность, концентрация флавоноидов. Остальные биохимические показатели имели более низкую зависимость и играли второстепенную роль в классификации.
Это подтверждает сделанные выводы о том, что фотосинтетический пигмент хлорофилла b значительно более чувствителен к загрязнению ПХБ, нежели хлорофилл а и каротиноиды. Выявлена высокая зависимость концентрации аскорбиновой кислоты от содержания поллютантов в воде, что, как показали наши исследования, сопровождалось значительным снижением синтеза витамина. Также показано, что такие показатели, как содержание флавоноидов и антиоксидантная активность, напрямую зависят от концентрации ПХБ.
Предложенная классификация является достаточно качественной, так как прогностическая ценность этой классификации равна 96%, что соответствует отличной точности построенной модели. Проведение тройной кросс-проверки несколько снизило качество модели. Однако ее прогностическая ценность составила 81%, что свидетельствует о хорошем качестве построенной модели.
В настоящее время генетические процессы, протекающие в водных биосистемах, подвергающихся интенсивному антропогенному воздействию, в том числе ПХБ, исследованы недостаточно. Поэтому актуальными являются генетические исследования живых организмов природных популяций, подверженных антропогенным загрязнениям, и экспериментальный анализ таких воздействий, моделируемых в лабораторных условиях.
Так как нами было показано, что под действием небольших концентраций ПХБ в макрофитах на примере Ceratophyllum demersum наблюдается увеличение интенсивности свободно-радикального окисления, на что указывало усиление образования конечного продукта - ТБКРС, которые, как известно, обладают мутагенной активностью и блокируют клеточное деление, вызывало интерес исследовать генотоксическую активность полихлорированных бифенилов в модельном эксперименте.
Используемый в нашем модельном эксперименте набор биологических тестов (Chlorella vulgaris, Allium cepa) позволил регистрировать генные и хромосомные типы нарушений наследственного материала.
Показано, что различные концентрации ПХБ вызывали видимые мутации (ВМ) у одноклеточной водоросли Chlorella vulgaris, наименьшая частота которых (0,647±0,125%) отмечалась при воздействии минимальной концентрации ПХБ (0,0005 мг/л) в воде реки Урал в районе Оренбурга.
Видимые мутации у Chlorell avulgaris (1,683±0,141*%) индуцировали ПХБ и в концентрации 0,001 мг/л, при этом кратность превышения контроля составила 12,5 при р=0,01, и мутагенная активность при данном воздействии соответствовала «сильному» уровню выраженности. Полихлорированные бифенилы в концентрации 0,0012 мг/л также индуцировали ВМ (1,375±0,140* %), превышение контроля составило 10,2 раза при р=0,02, что свидетельствует о «сильной» мутагенной активности.
В модельных экспериментах установлено, что генотоксический эффект ПХБ у растений проявляется и в индуцировании хромосомных аберраций в меристематической ткани Allium cepa.
Оценка суммарного индекса мутагенной активности (СИМА) при воздействии различных концентраций ПХБ показала, что наибольшая СИМА=6 регистрировалась в растениях, подверженных влиянию ПХБ в концентрациях 0,001 и 0,0012 мг/л, а наименьшая СИМА=3 проявлялась при воздействии 0,0005 мг/л ПХБ.
Проведенный модельный эксперимент по оценке мутагенной активности различных концентраций ПХБ позволил сделать вывод, что в целом ПХБ, даже в небольших концентрациях, обладали генотоксичностью по отношению к растительным объектам, а это свидетельствует о том, что в рамках проведения экологического мониторинга водных экосистем необходимо учитывать наличие полихлорированных бифенилов, так как даже в незначительных концентрациях они оказывают повреждающее воздействие на генетический аппарат клеток.
Заключение
Ответная реакция макрофитов на действие ПХБ зависела от концентрации поллютантов и проявлялась в различных по амплитуде и скорости изменениях содержания соединений, реагирующих с тиобарбитуровой кислотой (ТБКРС): ПХБ ниже ПДК (0,0005 мг/л) вызывали активное снижение содержания ТБКРС в растениях по сравнению с исходным и падение интенсивности свободно-радикального окисления. В то же время в растениях, испытывающих воздействие концентраций ПХБ на уровне ПДК и выше (0,001 мг/л и 0,0012 мг/л), зафиксировано возрастание содержания ТБКР, что свидетельствует об активации процесса свободно-радикального окисления, а значит, и нарушении работы компенсаторно-адаптивного ответа биологической системы макрофитов, но не приводящего к гибели организма на конец эксперимента.
Анализ зависимости исследуемых биохимических показателей (таких как активность каталазы, содержание ТБКРС, аскорбиновой кислоты, флавоноидов, хлорофилла а и хлорофилла b, каротиноидов, антиоксидантной активности) от исследуемых концентраций ПХБ с использованием метода моделирования: «Построение деревьев классификации», где целевой переменной выступала «концентрация ПХБ» (варианты: 0,0 мг/л - контроль; 0,0005 мг/л; 0,001 мг/л; 0,0012 мг/л), позволил выделить зависимости от содержания поллютантов в воде 4 ведущих факторов: концентрации хлорофилла b, содержания витамина С, антиоксидантной активности, концентрации флавоноидов. Остальные биохимические показатели имели более низкую зависимость и играли второстепенную роль в классификации (при уровне прогностической ценности данной классификации 96%).
На модели Al. cepa установлен генотоксический эффект полихлорбифенилов, который проявлялся в повреждении хромосом и индукции хромосомных аберраций типа «фрагментов» и «мостов», а также на геномном уровне, в нарушении подвижности хромосом на хроматиновом веретене деления, приводящих к появлению отставаний в процессе расхождения хромосом. ПХБ в различных концентрациях могут выступать в качестве мутагенов прямого действия и вызывать генные мутации.
Рецензенты:
Сафонов М.А., д.б.н., профессор, заведующий кафедрой общей биологии, экологии и методики обучения биологии ГБОУ ВПО «Оренбургский государственный педагогический университет», г. Оренбург;
Немцева Н.В., д.м.н., профессор, заведующая лабораторией водной микробиологии Института клеточного и внутриклеточного симбиоза УрО РАН, г. Оренбург.
Библиографическая ссылка
Соловых Г.Н., Винокурова Н.В. МЕХАНИЗМЫ ЭКОЛОГИЧЕСКОЙ АДАПТАЦИИ МАКРОФИТОВ Р. УРАЛ К ТОКСИЧЕСКОМУ ВОЗДЕЙСТВИЮ ПОЛИХЛОРИРОВАННЫХ БИФЕНИЛОВ // Современные проблемы науки и образования. 2015. № 5. ;URL: https://science-education.ru/ru/article/view?id=22642 (дата обращения: 14.02.2026).



