В научной литературе накоплен обширный материал по влиянию радиации на биологические системы [1-7]. Первоначально интерес к этой проблеме был обусловлен разворачивавшейся гонкой ядерных вооружений, впоследствии – развитием ядерной энергетики. В последнее время большое внимание исследователей привлекает проблема эффектов малых доз радиации на биологические объекты в связи с увеличивающимся радиоактивным загрязнением окружающей среды [8-10]. Экспериментальные работы, посвященные исследованию эффектов в области малых доз радиации, с которыми сталкиваются люди в обыденной жизни, заполнены данными, полученными путем экстраполяции из области больших доз. Достаточно сказать, что не определено понятие “малые дозы” радиации. По этой причине в радиобиологии существует спектр гипотез о степени опасности малых доз радиации: от линейно-беспороговой, когда опасными считаются любые сколь угодно малые дозы радиации, до гипотезы радиационного гормезиса, когда малые дозы радиации считаются полезными для живых организмов.
В связи с вышеизложенным, очень важным аспектом наших исследования являлась оценка канцерогенных рисков для здоровья лиц, проживающих в 30 км. зоне Ростовской АЭС.
Генетическими причинами, приводящими к развитию рака, являются мутации в генах принимающих участие в репарации ДНК, в регуляции клеточного цикла, в генах супрессирующих опухоль и в протоонкогенах. В общей сложности в организме человека должно произойти несколько десятков мутаций для проявления опухоли. Поэтому, обычно раковые заболевания регистрируются в пожилом возрасте, за долгие годы происходит их постепенное накопление, за счет спонтанных причин. Повышенный уровень радиации существенно ускоряет процесс образования мутаций и соответственно развитие опухолевых заболеваний [9]. Целью данной работы было выявление онкологических заболеваний на ранних стадиях у жителей 30-км зоны Ростовской АЭС, используя широкий спектр онкомаркеров к раку легкого, кишечника, яичника, молочной и предстательной желез, разработанных на основе специфических антител и проведение сравнительного анализа частот активности и регистрации онкомаркеров с жителями различных районов Ростовской области. Данное исследование может дать ответ на постоянно волнующий вопрос населения, проживающего в 30 км зоне – увеличивается ли у них риск развития онкологических заболеваний от деятельности АЭС?
Материалы и методы
Материалом для исследования служила кровь 2415 доноров в возрасте 18-45 лет, соотношение полов – 1:1, проживающих в 30-км зоне Ростовской АЭС (n=500), а также жителей г. Ростове-на-Дону (n=1115) и Ростовской области – Чертковский район (n=200), Мясниковский р-н (n=100), Ремонтненский р-н (n=200), г. Сальск (n=100), г. Пролетарск (n=100) (рис.2.1). Районы Ростовской области для скрининговых исследований выбирались по следующим показателям: удаленность от Волгодонской АЭС, структура промышленного производства, прохождение крупнейших авто- и железнодорожных магистралей, количество жителей.
Материалом исследования являлась сыворотка крови, полученная из венозной крови в необходимом для исследования количестве. Забор крови осуществлялся натощак с 8 до 11 утра с применением системы Vacutainer (Bioline, USA). Сыворотку крови получали, отстаивая венозную кровь при температуре 15-20оС в течение 30 минут, затем центрифугировали при 1000 об/мин в течение 10 минут.
Содержание онкомаркеров в сыворотке крови определяли методом конкурентного твердофазного иммуноферментного анализа (ELISA) на автоматическом иммуноферментном анализаторе «ALISEI Q.S.», с использованием реагент-наборов производства «Алкор-Био» и «Вектор-Бест». Метод определения основан на твердофазном одностадийном «sandwich» варианте иммуноферментного анализа с применением моноклональных антител. Статистическая обработка результатов производилась с использованием программы Statistica 6.0. Достоверность отличий определяли с использованием критерия Стьюдента.
Результаты исследований
Повышенные концентрации онкомаркеров не могут служить абсолютным доказательством наличия опухоли, поскольку они нередко отмечаются при заболеваниях нераковой природы с интенсивной пролиферацией ткани. При комплексном определении концентрации онкомаркеров увеличиваются возможности дифференциальной диагностики заболеваний. Результаты определения концентрации онкомаркеров могут быть использованы для выявления недиагностируемых опухолей различной локализации и органной специфичности, а также для прогноза развития опухоли.
Раковый эмбриональный антиген (РЭА) является универсальным маркером для всех типов раковых опухолей. В литературе описывается использование РЭА в диагностике и мониторинге рака молочной железы, желудочно-кишечного тракта, легких, простаты и другой локализации, а так же в случае наличия метастазов неизвестного происхождения. [7,8,9]. В связи с этим начальным этапом скринингового исследования было определение концентрации ракового эмбрионального антигена в сыворотке крови жителей 30-км зоны Ростовской АЭС.
Результаты исследований показали, что наибольшая частота выявления повышенной концентрации ракового эмбрионального антигена в сыворотке крови наблюдается у мужчин в возрастной группе старше 30 лет и составляет 4,3% от всех обследованных мужчин. В возрастной группе до 30 лет среди мужчин частота повышения концентрации РЭА составила 1,3%. Среди женщин наибольшая частота выявления повышенной концентрации ракового эмбрионального антигена в сыворотке крови наблюдается в возрастной группе 18-30 лет и составляет 3,84%. В возрастной группе старше 30 лет данный показатель равен 2,5%. Концентрация РЭА варьировала от 0 до 23 нг/мл. На рисунке 1. представлена гистограмма распределения частот выявления повышенной концентрации ракового эмбрионального антигена по районам Ростовской области. Наибольшая частота (13,5% женщин и 9% мужчин) зарегистрирована в Мясниковском районе. Наименьшая частота (2,3% мужчин и не зарегистрирована у женщин) наблюдается в Чертково.
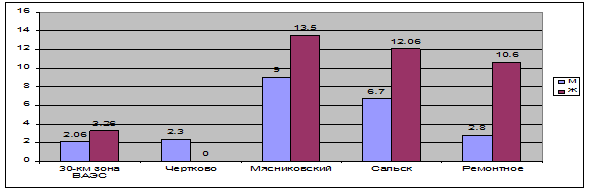
Рис. 1. Частота (в %) выявления повышенного содержания РЭА в 30-км зоне Ростовской АЭС и в районах контрольной группы
Злокачественные опухоли яичников составляют около 20% всех новообразований женской половой сферы. За последнее десятилетие отмечен неуклонный рост показателей смертности от них во всем мире. Более того, в некоторых цивилизованных странах смертность от рака яичников опережает в своем росте смертность от рака молочной железы. Основными причинами этого являются поздняя диагностика, низкая эффективность лечения, появление нетипичных форм.
Если анатомические особенности целого ряда органов, с внедрением эндоскопических, цитологических, гистологических методов, дают возможность детально изучить предраковые процессы и ранние формы рака, то сложность распознавания начальных этапов бластогенеза в яичниках, скудность клинической симптоматики, поздняя выявляемость опухолевого поражения приводят к тому, что около 80% больных поступают в специализированные стационары уже в III и IV стадиях заболевания. Поэтому, выявление риска возникновения эпителиального рака яичников у жителей 30 км. зоны Ростовской АЭС с применением биомаркеров, стало следующим этапом нашей работы.
Карбогидратный антиген 125 (СА -125) обнаруживается в сыворотке крови, что используется при диагностике злокачественных опухолей. В норме концентрация СА 125 в сыворотке крови составляет от 0 до 30 Ед/мл. Увеличение концентрации этого опухолевого маркера в сыворотке крови наиболее часто связано с эпителиальным раком яичников. В различных исследованиях показано, что уровень СА 125 повышен в 50% случаев у пациентов на 1 стадии развития заболевания, и у 90% пациентов на последующих стадиях [9]. Также регистрируются случаи повышения уровня содержания СА 125 при раке легких, груди, эндометрия и ЖКТ.
Результаты исследования концентрации карбогидратного антигена 125 в сыворотке крови жителей 30-км зоны РАЭС показали, что повышение уровня содержания СА 125 в сыворотке крови наблюдалось только в возрастной группе младше 30 лет в 5,26% случаев. Показатель варьировал от 0 до 101,9 Ед/мл. В возрастной группе старше 30 лет повышения уровня содержания СА-125 в сыворотке крови не зарегистрировано.
На графике (рис.2) показано распределение частот выявления повышенной концентрации карбогидратного антигена 125 по районам Ростовской области. Наибольшая частота (3%) зарегистрирована в 30-км зоне ВАЭС. В городах Чертково и Сальск частота составила 2%. В Мясниковском и Ремонтненском районах повышения концентрации СА 15-3 не выявлено.
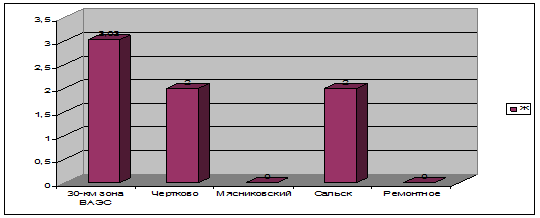
Рис. 2. Частота (в %) выявления повышенного содержания СА -125 в 30-км зоне Волгодонской АЭС и в районах контрольной группы
АФП является важным онкологическим маркёром. Повышенные уровни АФП могут наблюдаться у больных с различными формами рака, однако наиболее характерны они при гепатоцеллю-лярной карциноме и гепатобластоме печени, эмбрионально-клеточных опухолях яичка и яичников, а также при плоскоклеточном раке пищевода и при метастазировании некоторых раков в печень. Поскольку период полужизни АФП в организме составляет около 5 суток, наблюдение концентрации АФП в сыворотке крови в течение нескольких недель после удаления опухоли, лучевой терапии или химиотерапии позволяет контролировать их эффективность. Постоянно увеличивающийся уровень коррелирует с плохим прогнозом, медленно снижающийся или замерший — с остаточной опухолью или её метастазами.
Надёжность постановки диагноза в онкологии с помощью определения АФП зависит не только от вида рака, но и от стадии его развития, дифференцированности, интенсивности метастазирования, активности иммунной системы и т.д. Например, надёжность теста на АФП при первичной карциноме печени (при дискриминирующем уровне АФП — 50 нг/мл) в целом по всем стадиям составляет 70—72%, тогда как при первой и второй стадиях — только 15-40%, а при 3-ей и 4-ой — до 90 % . Вероятно, при высокой активности иммунной системы может нарабатываться большое количество антител к «раковым» изо-формам АФП, которые, связывая его в иммунные комплексы, повышают процент ложноотрицательных результатов.
Другой аспект демонстрирует большая группа опухолей (рак груди, лёгкого, желудка, толстого кишечника, поджелудочной железы и др.), при наличии которых увеличение уровня АФП в крови отмечается лишь периодически и в концентрациях лишь в 1,5-4 раза превышающих норму (10-12 нг/мл). По-видимому, существенную часть общего пула АФП этих мало- и среднепродуцирующих АФП опухолей составляет не раковый, а физиологический АФП, синтезирующийся в результате работы гомеостатического механизма. Кроме того, многие раковые клетки имеют рецепторы к АФП и способны поглощать его, снижая концентрацию АФП в кровотоке.
Не следует забывать, что умеренно повышенные уровни АФП (20-400 нг/мл) могут быть зафиксированы при заболеваниях печени нераковой природы с интенсивной регенерацией её тканей (гепатиты В и С, цирроз). Обычно незначительное и непродолжительное увеличение концентрации АФП в крови иногда может быть зафиксировано и при репаративных процессах в других тканях организма.
Проведенные нами исследования содержания альфа-фетопротеина в сыворотке крови жителей 30-км зоны РАЭС показали, что наибольшая частота выявления повышенной концентрации АФП в сыворотке крови наблюдается у женщин в возрастной группе старше 30 лет и составляет 5,5% от всех обследованных женщин. В возрастной группе 18-30 лет среди женщин частота повышения концентрации АФП составила 2,22%. Среди мужчин наибольшая частота выявления повышенной концентрации ракового эмбрионального антигена в сыворотке крови наблюдается в возрастной группе старше 30 лет и составляет 2,85%. В возрастной группе 18-30 лет повышения уровня содержания АФП не выявлено. Концентрация АФП варьировала от 0 до 19,48 нг/мл. На рисунке 3 представлена гистограмма распределения частот выявления повышенной концентрации альфафетопротеина по районам Ростовской области. Наибольшая частота (6% женщин и 1,9% мужчин) зарегистрирована в г. Сальске. Не зарегистрировано повышение концентрации АФП в сыворотке крови жителей г. Чертково.
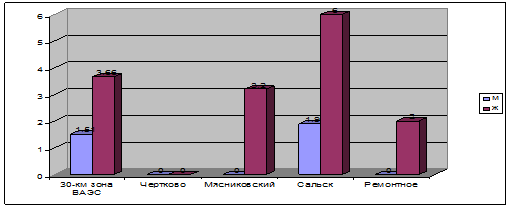
Рис. 3. Частота (в %) выявления повышенного содержания АФП в 30-км зоне Ростовской АЭС и в районах контрольной группы
Рак предстательной железы (РПЖ) в настоящее время занимает первое-второе место среди онкологических заболеваний у мужчин. Простат-специфический антиген (ПСА) в настоящее время является наиболее надежным, чувствительным и специфичным методом ранней диагностики и мониторинга доброкачественной гиперплазии и РПЖ. ПСА, относящийся к гликопротеинам, вырабатывается почти исключительно секреторным эпителием простаты, и, попадая с семенную жидкость, обеспечивает разжижение эякулята и увеличение подвижности спермы. Незначительные количества ПСА секретируются эпителием протоков молочных желез лактирующих женщин, эпителием эндометрия и слюнных желез, однако это не имеет клинического значения ПСА способен «выявлять» РПЖ уже на I стадии. С 80-х годов в Западной Европе и США определение ПСА стало обязательным клиническим анализом в онкоурологической практике. Ежегодное определение ПСА в сыворотке крови целесообразно проводить у всех практически здоровых мужчин старше 50 лет, у больных с урологическими жалобами, а также у более молодых мужчин, относящихся к группе высокого риска по развитию РПЖ (у которых отец или брат болели РПЖ, особенно в возрасте до 60 лет).
У здоровых мужчин моложе 45 лет уровень ПСА в сыворотке не превышает 4,0 нг/мл. С возрастом концентрация ПСА несколько увеличивается, что связано с гиперпластическими процессами в предстательной железе. Поэтому установлены возрастно-специфические нормативы: до 49 лет – 2,5 нг/мл, 50-59 лет – 3,5 нг/мл, 60-69 лет – 4,5 нг/мл, старше 70 лет – 6,0 нг/мл. Граница ежегодного физиологического приращения общего ПСА не должна превышать 0,75-1,36 нг/мл в год. При уровне ПСА ниже 4,0 нг/мл РПЖ обнаруживается только в 0,5% случаев. При концентрации ПСА от 4,0 до 20 нг/мл частота обнаружения РПЖ достигает 27-37%, 20-30 нг/мл – 74%, а при концентрации больше 30 нг/мл практически у всех обследуемых подтверждается диагноз РПЖ. Увеличение ПСА выше 50 нг/мл указывает на экстракапсулярный рост опухоли с вероятностью 80%, а уровень больше 100 нг/мл – признак регионарных или отдаленных метастазов.
Результаты исследования концентрации простатспецифического антигена в сыворотке крови жителей 30-км зоны РАЭС показали повышение уровня содержания ПСА в сыворотке крови только в возрастной группе старше 30 лет в 2,17% случаев. Показатель варьировал от 0 до 10 Ед/мл. В возрастной группе 18-30 лет повышения уровня содержания ПСА в сыворотке крови не зарегистрировано. На диаграмме (рис.4) представлено распределение частот регистрации повышенного содержания ПСА в сыворотке крови жителей 30-км зоны Ростовской АЭС и районов Ростовской области. Из рисунка видно, что во всех рассмотренных районах частоты сохраняются на низком (<1,5 %) уровне.

Рис. 4. Частота (в %) выявления повышенного содержания ПСА в 30-км зоне Ростовской АЭС и в районах контрольной группы
В таблице 1 рассматривается отношение среднего процента обследованных жителей с повышенным содержанием онкомаркеров в сыворотке крови по районам к среднему проценту по Ростовской области. Повышение частоты регистрации высокого уровня онкомаркеров с сыворотке крови обследованных жителей по сравнению со средней частотой по области выявлено в г. Сальске (в 3 раза выше по онкомаркерам АФП и СА15-3). Низкая по сравнению со средним по области частота регистрации повышения концентрации онкомаркеров в сыворотке крови наблюдается в г. Чертково и Ремонтное. На одном уровне или умеренно повышены (коэффициент от 1 до 2) частоты в Мясниковском районе и у жителей 30-км зоны Ростовской АЭС.
Таблица 1
Коэффициент превышения региональной нормы уровня онкомаркеров
у жителей РО
|
Районы РО
|
РЭА |
АФП |
СА15-3 |
СА125 |
ПСА |
||
|
М
|
ж
|
м
|
ж
|
ж
|
ж
|
М
|
|
|
30-км зона ВАЭС |
0,33 |
0,53 |
0,83 |
2 |
1,92 |
2,15 |
0,2 |
|
Чертково |
0,37 |
0 |
0 |
0 |
0 |
1,42 |
0 |
|
Мясниковский |
1,45 |
2,12 |
1,75 |
0 |
0 |
0 |
0 |
|
Сальск |
1,08 |
1,95 |
1,04 |
3,28 |
3,08 |
1,42 |
0 |
|
Ремонтное |
0,45 |
1,71 |
0 |
1,09 |
0 |
0 |
0 |
Выводы:
Резюмируя итоги обследования содержаний онкомаркеров у жителей 30 км. зоны Ростовской АЭС и у лиц Ростовской области, проживающих в отдаленных районах от АЭС следует отметить основные зоны риска – это Мясниковский район ( поселок Чалтырь) и г. Сальск. Достоверное увеличение числа жителей с повышенным содержанием исследуемых онкомаркеров – РЭА, СА-15-3,.СА-125, ПСА, АФП, наблюдалось только для двух биомаркеров – РЭА и АФП. Повышенный уровень РЭА наблюдался у 3% жителей 30 км зоны Ростовской АЭС, у 6% жителей Ремонтненского района, у 12% жителей г Сальска и у 13% жителей Мясниковского района. Повышенный уровень АФП был зарегистрирован только у жителей 30-км зоны Ростовской АЭС и г Сальска и составил 2, 5% и 4% соответственно. Таким образом, проведенный сравнительный анализ частот активности и регистрации онкомаркеров у жителей различных районов Ростовской области достоверно показывает, что риск развития онкологических заболеваний, в данное время, не зависит от деятельности Ростовской АЭС.
Исследования выполнены в рамках базовой части внутреннего гранта ЮФУ по проекту 213.01-2015/003ВГ «Изучение ДНК-элементов некодирующих белок в структуре различных геномов».
Рецензенты:
Денисова Т.В., д.б.н., профессор Академии биологии и биотехнологии федерального государственного автономного образовательного учреждения высшего образования «Южный федеральный университет», г. Ростов-на-Дону;
Чистяков В.А., д.б.н., главный научный сотрудник Академии биологии и биотехнологии федерального государственного автономного образовательного учреждения высшего образования «Южный федеральный университет», г. Ростов-на-Дону.
Библиографическая ссылка
Шиманская Е.И. СРАВНИТЕЛЬНЫЙ АНАЛИЗ УРОВНЯ ОНКОМАРКЕРОВ У ЖИТЕЛЕЙ РОСТОВСКОЙ ОБЛАСТИ И 30-КМ ЗОНЫ РОСТОВСКОЙ АЭС // Современные проблемы науки и образования. 2015. № 5. ;URL: https://science-education.ru/ru/article/view?id=22563 (дата обращения: 11.02.2026).



