Цель исследования
Изучить эффективность трансляционной клеточной иммунотерапии при трансплантации почки, как метода, позволяющего индуцировать процессы толерантности к трансплантированному органу.
Материалы и методы
Проведено проспективное рандомизированное исследование эффективности трансляционной клеточной иммунотерапии (ТКИ) у 24 реципиентов почечного трансплантата. Для исключения влияния на результат исследования возможной донорской патологии и недостатков изъятия и консервации органа контролем явились 24 реципиента парных основной группе трансплантатов. В число пациентов основной группы (n=24) вошли 14 мужчин в возрасте от 31 года до 56 лет и 10 женщин в возрасте от 27 до 50 лет, которые получали стандартную медикаментозную иммуносупрессивную терапию в сочетании с ТКИ. Группу сравнения (n=24) составили 13 мужчин в возрасте от 21 года до 55 лет и 11 женщин в возрасте от 37 до 48 лет, которые являлись реципиентами парных основной группе трансплантатов и получали только общепринятую медикаментозную иммуносупрессивную терапию.
Длительность заместительной почечной терапии перед трансплантацией у пациентов исследуемой группы составила в среднем 25 месяцев, в группе сравнения - 28 месяцев. Индекс совместимости доноров и реципиентов в основной группе составил 8 (4;13), в контрольной группе этот показатель оказался недостоверно выше 9 (5;13), что изначально могло предполагать лучший результат трансплантации в группе контроля.
Процедуры ТКИ проводились пациентам исследуемой группы в первые 2 недели после трансплантации почки с кратностью 2 раза в неделю, в последующие 2 недели - 1 раз в неделю, в течение 2-го месяца - 1 раз в 2 недели, 1 раз в течение 3-го месяца и завершались одной процедурой на 180-е сутки после ТП.
Методика ТКИ заключалась в сепарации и накоплении в экстракорпоральном контуре мононуклеарных клеток с помощью аппарата Haemonetics. За одну процедуру выделяли от 40 до 70 мл. концентрата мононуклеарных клеток, которые ресуспендировали в 0,9% р-ре хлористого натрия, доводя общий объем до 200,0 мл. Клеточную суспензию подвергали ультафиолетовому воздействию при длине волны 380-420 нм. Общая доза экспозиции составляла 0,8-1,2 дж/см2. Дополнительно сразу после ультрафиолетового облучения проводилось замещение физраствора плазмой крови в том же объеме. Затем вводили в полученную смесь цитокин - гранулоцит-макрофагальный колониестимулирующий фактор в дозе 80-120 нг/мл. После 90 минут инкубационного периода при температуре 37 С0 клетки реинфузировали пациенту в течение 30 мин. В качестве фотосенсибилизатора использовался аммифурин в дозе 1 мг/кг массы тела, который принимался пациентом за 2 часа до проведения процедуры.
На основании клинических и лабораторных показателей сравнивалось функциональное состояние ПАТ в раннем и позднем посттрансплантационном периоде, выживаемость трансплантатов и реципиентов по Kaplan-Meier, с помощью протокольной биопсии на 30-е и 180-е сутки после трансплантации почки оценивалось количество и тяжесть перенесенных реакций отторжения, сравнивалось число инфекционных осложнений.
Критерием индукции иммунологической толерантности явились клинико-иммунологические корреляции, учитывающие ключевой путь активации Т-клеточного рецептора на наивных CD4+ Т-лимфоцитах - CD28 в сравнении с контрольной группой.
Результаты
Установлено, что в основной группе на протяжении всего периода наблюдения (4 года) не было отмечено ни клинических, ни гистологических симптомов отторжения (Таблица 1). В контрольной группе по данным биопсии отторжения наблюдались в 4 наблюдениях, в 2 - трансплантатэктомия по поводу острого отторжения.
Таблица 1
Общая таблица событий в двух группах
|
Событие |
Основная группа |
Контрольная группа |
||||||
|
Сроки после ТП |
1 год (n=24) |
2 года (n=22) |
3 года (n=13) |
4 года (n=9) |
1 год (n=20) |
2 года (n=17) |
3 года (n=9) |
4 года (n=7) |
|
Отторжение |
|
|
|
|
4 |
|
|
|
|
ХТН |
3 |
|
1 |
|
7 |
2 |
3 |
1 |
|
Инфекция: |
|
|
|
|
|
|
|
|
|
-легочная |
2 |
|
|
|
8 |
1 |
1 |
|
|
-мочевая |
2 |
|
|
|
6 |
2 |
1 |
|
|
-хирургическая |
1 |
|
|
|
|
|
|
|
|
ФСГС |
|
|
|
|
1 |
1 |
|
|
|
Трансплантатэкто-мия |
|
|
|
|
3 |
1 |
|
|
|
Смерть пациента |
|
|
|
|
1 |
|
|
|
|
Итого событий по периодам |
8 |
|
1 |
|
48 |
7 |
5 |
1 |
|
Всего событий |
9 |
61 |
||||||
3 пациента контрольной группы перенесли трансплантатэктомии в течение первого года после трансплантации почки по причинам рецидивирующего пиелонефрита трансплантата, острого отторжения и тромбоза вены трансплантата, 1 трансплантатэктомия выполнена через 1 год после пересадки - фокально-сегментарный гломерулосклероз по данным биопсии (Рисунок 1). В функцию дожития не включен пациент контрольной группы, который умер в результате развившейся на фоне усиленной иммуносупрессии пневмоцистной пневмонии.
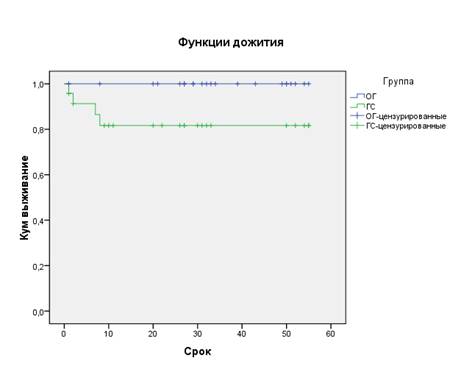
Рис.1. Функции выживаемости до потери трансплантата в двух группах (месяцы) (Kaplan-Meier)
Анализ клинических и лабораторных данных на 30-е сутки после трансплантации не выявил существенных преимуществ в основной группе по сравнению с контрольной. Более существенная и достоверная разница отмечена через 6 месяцев после трансплантации: в основной группе происходило дальнейшее улучшение показателей, тогда как в группе сравнения они оставались стабильными с тенденцией к ухудшению (Таблица 2).
Таблица 2
Лабораторные показатели на 30-е и 180-е сутки после трансплантации
|
Параметр |
Основная группа |
Группа сравнения |
р |
|
|
Креатинин крови, мкмоль/л |
30 сутки |
131±22 |
144±34 |
0,122 |
|
180 сутки |
111±20 |
131±11 |
0,001 |
|
|
Мочевина крови, ммоль/л |
30 сутки |
17,2±5,1 |
18,3±4,4 |
0,43 |
|
180 сутки |
13,4±4,1 |
15,8±5,1 |
0,08 |
|
|
Скорость клубочковой фильтрации, мл/мин |
30 сутки |
55,4±16,1 |
49,1±18,8 |
0,22 |
|
180 сутки |
56,7±6,2 |
41,5±5,1 |
<0,001 |
|
|
Суточная протеинурия, г/сутки |
30 сутки |
0,83±0,14 |
0,96±0,18 |
0,01 |
|
180 сутки |
0,55±0,08 |
1,48±0,54 |
<0,001 |
|
Значительные различия в динамике скорости клубочковой фильтрации и, особенно, протеинурии могут свидетельствовать о лучшем прогнозе для функции трансплантата у больных основной группы.
Результаты биопсии трансплантата подтвердили острое отторжение трансплантата у 4 пациентов, получавших только медикаментозную иммуносупрессию без ТКИ (контрольная группа). При этом в 2 случаях острое отторжение стало причиной полной утраты функции трансплантата, а в одном случае - смерти пациента в результате увеличения медикаментозной иммуносупрессивной нагрузки в целях терапии отторжения трансплантата. Еще у одного пациента группы сравнения через 6 месяцев после трансплантации при биопсии диагностирован фокально - сегментарный гломерулосклероз, у двух - хроническая трансплантационная нефропатия 3 стадии. В свою очередь, ни у одного пациента, получавшего ТКИ, не диагностировано острое отторжение трансплантата, изменения в трансплантате соответствовали остаточным явлениям острого канальцевого некроза на 30 сутки или начальным проявлениям хронической трансплантационной нефропатии 1 - 2 стадии на 180 сутки после трансплантации (Таблица 3).
Таблица 3
Результаты протокольной биопсии почечных трансплантатов пациентов основной группы и группы сравнения на 30 и 180 сутки после трансплантации
|
Диагностические категории |
Основная группа |
Контрольная группа |
||
|
30 сутки (n=24) |
180 сутки (n=22) |
30 сутки (n=24) |
180 сутки (n=21) |
|
|
Тяжелый острый канальцевый некроз |
8 |
0 |
3 |
0 |
|
IA Banff |
0 |
0 |
1* |
0 |
|
IB Banff |
0 |
0 |
0 |
1* |
|
IIA Banff |
0 |
0 |
0 |
0 |
|
IIB Banff |
0 |
0 |
1** |
0 |
|
III Banff |
0 |
0 |
1* |
0 |
|
Фокально - сегментарный гломерулосклероз |
0 |
0 |
0 |
1** |
|
Хроническая трансплантационная нефропатия 1-2 ст. |
1 |
5 |
0 |
1 |
|
Хроническая трансплантационная нефропатия 3 ст. |
0 |
0 |
0 |
2* |
* - изменения, угрожавшие функциональному состоянию почечного трансплантата и потребовавшие дополнительной терапии
** - изменения, повлекшие за собой трансплантатэктомию
Приведенные выше данные подтверждаются также иммунологическими параметрами. В результате воздействия иммуносупрессивной терапии на 4 сутки после трансплантации количество клеток, экспрессирующих коактивационные молекулы CD28, было почти в 2 раза меньше, чем в норме у здоровых людей. При этом плотность коэкспрессии их на наивных лимфоцитах уменьшалась пропорционально количеству этих клеток, что подтверждалось прямой достоверной корреляционной зависимостью MFI и % клеток, экспрессирующих эти маркеры (r=0,58, p=0,01).
Через 30 дней после трансплантации в контрольной группе больных не происходило существенного изменения как количества клеток, экспрессирующих молекулы коактивации (57,7±18,2% и 52,7±23,2% соответственно, р>0,05), так и плотности их коэкспрессии (22,7±6,0 ед. и 19,6±7,0 ед., соответственно, р>0,05).
В тоже время, в основной группе больных с включением в стандартный протокол иммуносупрессивной терапии курса ТКИ, было обнаружено выраженное и статистически достоверное уменьшение как количества клеток, экспрессирующих коактивационные рецепторы (с 57,7±18,2% до 34,5±11,4%, р<0,05), так и плотности присутствия этих рецепторов на наивных хелперных Т-лимфоцитах (c 22,7±6,0 ед. до16,8±5,1 ед., р<0,05) (Рисунок 2 а,б).
При этом вариабельность полученных результатов была значительно меньше, чем в группе контроля. Это могло свидетельствовать об универсальности и большей чувствительности данного метода лечения в отношении ингибирования коактивационных молекул на наивных Т-лимфоцитах, через которые реализуется 2 сигнальный путь активации Т - клеточного рецептора. Полученные данные указывают на определенные недостатки существующей современной концепции преодоления механизмов реакции острого отторжения трансплантата и, тем более, индукции иммунологической толерантности к антигенам донорского органа при помощи лекарственных иммуносупрессивных препаратов.
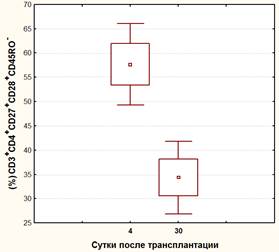
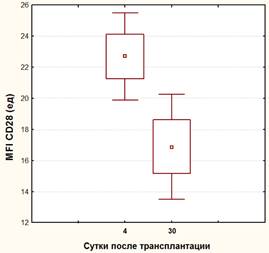
Рис.2. а) динамика коэкспрессии CD28 на наивных CD4+ лимфоцитах у реципиентов основной группы; б) динамика средней интенсивности флюоресценции (MFI) CD28 на наивных CD4+ лимфоцитах у реципиентов основной группы
Выводы
Доказано, что применение ТКИ эффективно в качестве предупреждения отторжения трансплантата в сочетании с контролем частоты инфекционных осложнений. Применение ТКИ после трансплантации почки сопровождается стабильной и с течением времени улучшающейся функцией почечного трансплантата. Анализ биопсийного материала свидетельствует, что ТКИ является эффективной методикой предупреждения острого отторжения почечного аллотрансплантата.
Частично большее количество случаев полной утраты функции трансплантатов можно объяснить статистически значимо большим числом острых кризов отторжения у больных группы контроля (4 случая). При этом в половине случаев первичным является повышение иммунологической напряженности между трансплантатом и организмом хозяина вследствие инфекции, в остальных случаях наоборот - инфекции появлялись на фоне лечения острого отторжения. В этой связи перспективным является внедрение трансляционной клеточной иммунотерапии при трансплантации почки, которая способна предупредить развитие реакции острого отторжения без увеличения риска развития инфекционных осложнений, что безусловно позволит улучшить результаты трансплантации почки.
Показано, что новый иммунобиологический метод - ТКИ обеспечивает индукцию толерантности к антигенам главного комплекса гистосовместимости при трансплантации почки. Механизм индукции обусловлен снижением экспрессии коактивационных молекул, обеспечивающих второй сигнальный путь активации Т-клеточного рецептора. Результаты наших иммунологических исследований и отсутствие клинических и гистологических признаков отторжения в основной группе через 4 года после трансплантации ставит перед нами задачу разработать иммунобиологические критерии толерантности, основываясь на которых, в дальнейшем можно редуцировать программы медикаментозной иммуносупрессивной терапии.
Рецензенты:
Пасов С., д.м.н., заведующий хирургическим отделением трансплантологии и диализа ГБУЗ МО МОНИКИ им. М.Ф. Владимирского, г. Москва;
Янковой А.Г., д.м.н., профессор, ведущий научный сотрудник хирургического отделения трансплантологии и диализа ГБУЗ МО МОНИКИ им. М.Ф. Владимирского, г. Москва.
Библиографическая ссылка
Федулкина В.А., Ватазин А.В., Кильдюшевский А.В. ТРАНСЛЯЦИОННАЯ КЛЕТОЧНАЯ ИММУНОТЕРАПИЯ – НОВОЕ НАПРАВЛЕНИЕ ТРАНСПЛАНТАЦИОННОЙ МЕДИЦИНЫ // Современные проблемы науки и образования. 2015. № 5. ;URL: https://science-education.ru/ru/article/view?id=21961 (дата обращения: 02.01.2026).



