Химиорезистентность у злокачественных новообразований, относящихся к группе сарком мягких тканей, является одним из ключевых факторов, оказывающих негативное влияние на характер течения и прогноз заболевания у больных с метастатическими и нерезектабельными формами заболевания [4; 12; 13]. Гастроинтестинальные стромальные опухоли (ГИСТ) долгое время относились к вышеуказанной нозологической группе злокачественных новообразований и также считались нечувствительными к большинству имеющихся в настоящее время химиопрепаратов. Ключевым моментом в появлении ГИСТ, как самостоятельной нозологической единицы, стало открытие активирующей мутации в гене c-kit в некоторых мезенхимальных и нейрогенных опухолях, экспрессирующих маркер CD-117. Результатом данной мутации является стимуляция митотической активности и пролиферация опухолевых клеток. Последующие (в том числе, проведенные нами) исследования показали, что наряду с таргетными препаратами первой и второй линии (иматиниб, сунитиниб) некоторые химиопрепараты также могут быть эффективными в отношении клеток ГИСТ как в отдельности, так и на фоне их преинкубации с иматинибом [2; 6; 9]. Данная концепция о возможности сенситизации иматинибом клеток ГИСТ к химиопрепаратам согласуется с данными единичных клинических наблюдений, свидетельствующих о том, что иматиниб может повышать чувствительность ГИСТ к малым дозам химиопрепаратов, в частности ингибитору топоизомеразы II типа – доксорубицину [11]. Данные факты явились предпосылками как для пересмотра существовавшего в течение долгого времени ошибочного мнения о химиорезистентности ГИСТ, так и для поиска новых химиопрепаратов, не обладающих селективностью действия в отношении рецепторов тирозинкиназ. Поиск новых лекарственных препаратов для терапии больных с метастатическими и неоперабельными формами ГИСТ также является актуальным по причине быстро развивающейся резистентности опухоли к таргетным препаратам. Показано, что более чем у половины пациентов с ГИСТ вторичная резистентность к иматинибу развивается в течение 2 лет с момента начала проведения им таргетной терапии [7; 14].
Проведенные нами ранее исследования выявили цитотоксическую активность некоторых соединений, относящихся к классу 4-пивоил-2-пирролонов, по отношению к различным опухолевым клеточным линиям in vitro, в том числе к различным линиям ГИСТ и саркомам мягких тканей [3].
Исходя из вышеизложенного, целью настоящего исследования явилось изучение молекулярных механизмов действия одного из вновь синтезированных нами соединений, относящихся к классу 2-амино-пирролов по отношению к клеткам ГИСТ, а также лейо- и рабдомиосарком.
Материал и методы исследования
В качестве объекта исследования были выбраны опухолевые клеточные линии гастроинтестинальных стромальных опухолей (ГИСТ-T1), а также сарком мягких тканей (лейомиосаркома SK-LMS-1, рабдомиосаркома RD). Клетки культивировали в стандартных условиях (37оС, 5%СО2 - LamSystems, Россия) в культуральной среде RPMI-1640 (ПАНЭКО, Россия) с добавлением эмбриональной телячьей сыворотки (15%) (HyClone, США), антибиотиков пенициллина-стрептомицина и L-глутамина (все реагенты ПАНЭКО, Россия).
В опухолевые клеточные культуры вносили химиопрепараты доксорубицин (ДОКС)(0.25 мкг/мл), паклитаксел (ПТ)(1 мкМ), винбластин (ВБ)(10 мкМ), нокадозол (НЗ)(10 мкМ) (все реагенты Sigma), а также этиловый эфир 2-амино-1-бензоиламино-5-(2-(4-хлорфенил)-2-оксоэтилиден)-4-оксо-4,5-дигидро-1Н-пиррол-3-карбоновой кислоты (2-АПК) в концентрации 5-10 мкМ. Опухолевые клетки инкубировали с вышеуказанными препаратами в течение 24-48 часов. Экспрессию белков, отражающих повреждение ДНК, а также активацию спасательных путей репарации повреждений ДНК и развитие апоптоза оценивали методом иммуноблоттинга с использованием соответствующих моноклональных антител (мАТ). Подсчет клеток в М-фазе клеточного цикла проводили общепринятым способом с использованием иммунофлюоресцентной микроскопии (Olympus BX63) и оценкой уровня экспрессии гистона 3, фосфорилированного по остаткам серина в положении 10. Статистический анализ результатов проводили методом t-критерия Стьюдента в программе Microsoft Excel 2007.
Результаты исследования и их обсуждение
На ранних сроках культивирования клеток ГИСТ-Т1 (24 ч) с 2-АПК наблюдалось значительное увеличение клеток округлой формы, что свидетельствовало о возможном накоплении клеток в М-фазе клеточного цикла под действием данного соединения (рис. 1). Эффект данного соединения был дозозависимым (5-10 мкМ) и сопоставимым с действием паклитаксела, также индуцирующего «арест» клеток в М-фазе клеточного цикла за счет его способности влиять на процессы деполимеризации тубулина (рис. 1).
A Б В
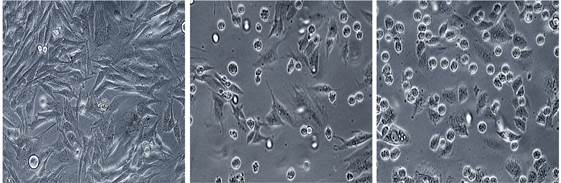
Рис. 1. Увеличение клеток округлой формы при культивировании опухолевых клеток линии ГИСТ-Т1 с 2-АПК- 5мкМ (Б) и паклитаксел - 1мкМ (В) в течение 24 часов. А - контроль.
Увеличение количества клеток, находившихся в стадии митоза, было подтверждено методом иммунофлуоресцентной микроскопии, показавшим значительное увеличение количеств клеток, экспрессировавших фосфорилированную (по остаткам серина в положении 10) форму гистона Н3 (p< 0.001). Данная форма гистона традиционно используется для выявления и подсчета количеств митотических клеток. Максимальное количество рН3-позитивных клеток наблюдалось спустя 24 ч после культивирования опухолевых клеток с вышеуказанными соединением, а также паклитакселом и другими препаратами, влияющими на процессы полимеризации/деполимеризаци тубулина и, таким образом, индуцирующими арест клеток в М-фазе клеточного цикла (положительный контроль).
Кроме того, инкубация клеток ГИСТ Т-1 с 2-АПК приводила к образованию двунитевых разрывов ДНК, о чем свидетельствовало накопление в опухолевых клетках гистона 2A, фосфорилированного по остаткам серина в положении 139 (γ-H2AX) (рис. 2). Как и предполагалось, образование двунитевых разрывов ДНК активировало в опухолевых клетках АТМ-опосредованные механизмы репарации повреждений ДНК, о чем свидетельствовал повышенный уровень экспрессии АТМ-киназы, фосфорилированной по остаткам серина 1981. Активация сигнальных путей репарации повреждений ДНК в клетках ГИСТ приводила к активации «точек рестрикции», регулирующих клеточный цикл (повышение экспрессии белка р53, фосфорилированного по остаткам серина в положении 15). Важно подчеркнуть, что, несмотря на наличие признаков двунитевых разрывов ДНК и активацию начальных этапов репарации повреждений ДНК, уровень экспрессии рекомбиназы Rad51 в опухолевых клетках ГИСТ Т1 после воздействия 2-АПК существенно снижался, что могло указывать на несостоятельность процессов гомологичной рекомбинации в данных экспериментальных условиях (рис. 2). Все описанные выше изменения также наблюдались в клетках лейо- и рабдомиосаркомы, инкубированных с данным соединением.
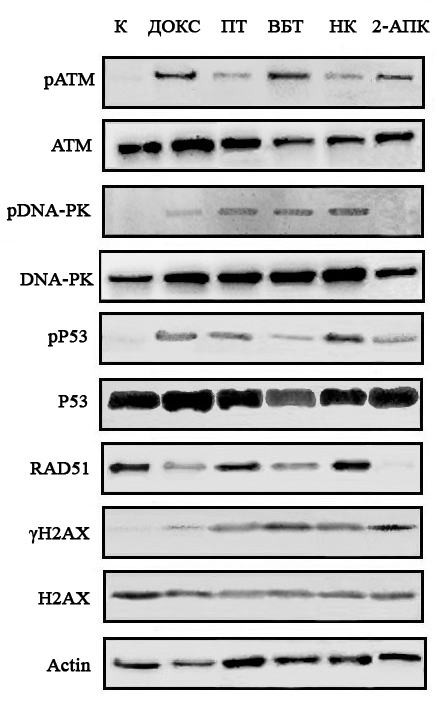
Рис. 2. Анализ способности доксорубицина (ДОКС), паклитаксела (ПТ), винбластина (ВБТ), нокодазола (НК) и соединения 2-АПК индуцировать в клетках ГИСТ Т-1 образование двунитевых разрывов ДНК (γ-H2AX), активировать спасательные пути репарации вышеназванных повреждений (фосфорилированные формы ATM-киназы и белка р53, изменение уровня экспрессии рекомбиназы Rad51).
Результаты проведенных исследований показали, что ингибитор топоизомеразы II типа доксорубицин, а также ингибиторы процессов полимеризации и деполимеризации тубулина (паклитаксел и др.) вызывали в опухолевых клетках ГИСТ и сарком мягких тканей аналогичные изменения – образование двунитевых разрывов ДНК и активацию АТМ-зависимого спасательного пути их репарации. Примечательно, что повреждения ДНК, вызываемые доксорубицином и препаратами, влияющими на динамическое состояние микротрубочек, также активировали DNA-PK-зависимые пути репарации повреждений ДНК, о чем свидетельствовал повышенный уровень экспрессии DNA-PK-киназы, фосфорилированной по остаткам серина 2056 (рис. 2).
Описанные выше различия в механизмах активации сигнальных путей репарации повреждений ДНК в опухолевых клетках под действием 2-АПК и препаратами контроля (ингибитор топоизомеразы II типа и пр.) могут свидетельствовать о специфическом характере повреждений ДНК, вызываемых 2-АПК. Для подтверждения правомочности данной гипотезы требуются дальнейшие исследования, в частности проведение анализа видов повреждений ДНК под действием синтезированного нами соединения (например, щелочная и нейтральная версии метода ДНК-комет).
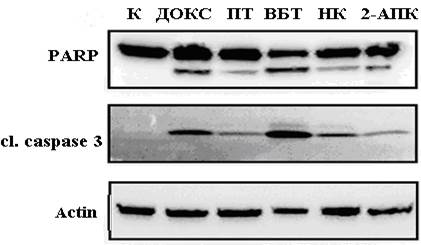
Рис. 3. Сравнительный анализ способности доксорубицина (ДОКС), паклитаксела (ПТ), винбластина (ВБТ), нокодазола (НК) и соединения 2-АПК индуцировать апоптоз клеток ГИСТ Т-1. Маркеры апоптоза - экспрессия расщепленных форм ПАРП и каспазы-3.
Тем не менее, несмотря на запуск спасательных путей активации в опухолевых клетках ГИСТ-Т1, а также лейо- и фибромиосарком, последующая их инкубация в течение 48 часов с 2-АПК приводила к их гибели по механизму апоптоза, о чем свидетельствовало накопление расщепленных форм поли-(АДФ-рибоза)-полимеразы (ПАРП), а также каспазы-3 (рис. 3). Одним из возможных механизмов, ответственных за гибель опухолевых клеток по механизму апоптоза, могла являться несостоятельность процессов гомологичной рекомбинации, о чем свидетельствовало значительное снижение уровня рекомбиназы Rad51 в данных экспериментальных условиях [5]. Для изучения возможных механизмов селективного снижения уровня экспрессии Rad51 требуется проведение дальнейших исследований, в частности с использованием ингибиторов протеасом для изучения возможных механизмов деградации данного белка. Полученные нами данные согласуются с общепринятой концепцией гибели опухолевых клеток по механизму апоптоза в условиях генотоксического стресса вследствие несостоятельности процессов репарации повреждений ДНК, вызванных химиопрепаратами, радиотерапией или другим генотоксическим воздействием [1; 8; 10; 15]. Про-апоптогенный эффект 2-АПК в отношении опухолевых клеток ГИСТ и сарком мягких тканей был сопоставим с эффектом ингибитора топоизомеразы II типа – доксорубицина и превышал эффект препаратов, влияющих на динамическое состояние микротрубочек (паклитаксела и винбластина).
Заключение
Результаты проведенного исследования свидетельствуют о способности 2-АПК вызывать в опухолевых клетках ГИСТ и сарком мягких тканей нарушения регуляции клеточного цикла и индуцировать селективное накопление опухолевых клеток в М-фазе клеточного цикла. Следствием нарушений сегрегации генетического материала в фазе митоза («митотическая катастрофа») явилась активация АТМ-опосредованного пути репарации повреждений ДНК в опухолевых клетках и последующий запуск программы апоптоза вследствие несостоятельности репаративных механизмов.
Исследования поддержаны грантом Российского научного Фонда (РНФ) - № 14-15-00342 (2014-2016).
Рецензенты:
Семина И.И., д.м.н., профессор, заведующий ЦНИЛ ГБОУ ВПО «Казанский ГМУ» Минздрава России, г. Казань;
Мухутдинова Ф.И., д.м.н., профессор ГБОУ ВПО «Казанский ГМУ» Минздрава России, г. Казань.
Библиографическая ссылка
Боичук С.В., Галембикова А.Р., Зыкова С.С., Хуснутдинов Р.Р. НАРУШЕНИЯ РЕГУЛЯЦИИ КЛЕТОЧНОГО ЦИКЛА И РЕПАРАЦИИ ПОВРЕЖДЕНИЙ ДНК В ОПУХОЛЕВЫХ КЛЕТКАХ ПОД ДЕЙСТВИЕМ ЗАМЕЩЕННОГО ЭТИЛОВОГО ЭФИРА 2-АМИНО-1Н-ПИРРОЛ-3-КАРБОНОВОЙ КИСЛОТЫ // Современные проблемы науки и образования. 2015. № 5. ;URL: https://science-education.ru/ru/article/view?id=21902 (дата обращения: 13.02.2026).



