Разработка тканеинженерных конструкций (ТИК) является одним из направлений регенеративной медицины [1,2] и может быть рассмотрена в качестве альтернативного и, возможно, потенциально применимого способа лечения стенозов трахеи.
Одним из ключевых моментов после трансплантации ТИК трахеи является усиление механизмов регенерации, интеграции трансплантата с окружающими тканями за счет активации стволовых клеток, участвующих в заживление ткани, повышение концентрации биологически активных молекул [5]. Клетки, способствующие регенерации, могут быть активированы локально или привлечены из своих ниш, например, костного мозга. Молекулярные механизмы мобилизации стволовых клеток из костного мозга в настоящее время интенсивно исследуются. Повышение мобилизации стволовых клеток, с помощью специфических факторов роста, рассматривается как один из возможных способов усиления регенерации ткани [4, 5].
Цель: изучить мобилизацию стволовых клеток из костного мозга и биологически активных веществ после трансплантации тканеинженерной трахеи.
Материалы и методы
Материалами для изучения послужили образцы периферической крови 6 пациентов, которым была выполнена трансплантация тканеинженерной синтетической трахеи, засеянной аутологичными мононуклеарными клетками (МНК) пациента.
Забор периферической крови проводили однократно до- и во время операции, и в послеоперационном периоде через день на протяжении двух недель (всего 9 раз у каждого пациента).
Иммунофенотипирование мононуклеарных клеток
Для исследований использовали фракцию МНК, выделенную из периферической крови центрифугированием на градиенте Лимфолит (Cedarlane, США). Иммунофенотипирование МНК проводили с панелью моноклональных антител к поверхностным антигенам – CD 34, CD 45, CD11b, CD14, CD73, CD90, CD 105, меченных FITC (изотиоцианат флуоресцеина), PE (фикоэритрин), ECD (комплекс PE с техасским красным) или PC7 (комплекс PE с цианином-7) по протоколу фирмы-изготовителя (Beckman Coulter, США). Результаты оценивали на проточном цитометре Cytomics FC500 (Beckman Coulter, США).
Определение уровня биологически активных молекул в периферической крови
Для количественного определения биологических молекул использовали «сэндвич»-вариант твердофазного иммуноферментного анализа (ИФА). В работе применяли наборы моноклональных антител против фактора некроза опухолей–а (TNF-a), E-селектина, молекул межклеточной адгезии 1 типа (ICAM-1), молекул адгезии сосудистого эндотелия 1 типа (VCAM-1), васкуло-эндотелиальный фактор роста (VEGF), интерлейкин-1 (IL-1)и интерлейкин-2 (IL-2) (eBioscience, Австрия). Оптическую плотность раствора в лунках измеряли на автоматическом спектрофотометре (SpectraMax 250, Molecular Devices, США) при длине волны 450 нм. После измерения реакции в лунках на основании калибровочной кривой рассчитывалась концентрация цитокина в определяемых образцах.
Статистический анализ
Полученные результаты выражали в виде средних значений (M) и ошибки среднего (m). При сравнении средних значений изучаемых групп процент возможной ошибки находили по таблице t-критерия Стьюдента для связанных совокупностей, выражаемый в виде значений достоверности различия – «р», где р<0,05 считалось статистически достоверным. Анализ выборок производили с использованием программы GraphPad Prism 5 (GraphPad Software, США).
Результаты исследования и их обсуждения
С целью мобилизации мезенхимальных мультипотентных стромальных клеток (ММСК) из костного мозга пациенты получали стимулирующую или буст-терапию гранулоцитарным колониестимулирующим фактором (Г-КСФ) и эритропоэтином.
На фоне проводимой терапии пациентам с трансплантированной ТИК трахеей была отмечена мобилизация стволовых клеток в периферическом русле. В первую очередь было выявлено, что буст-терапия приводила к существенному увеличению концентрации CD34+ гемопоэтических стволовых клеток (ГСК). В нестимулированных условиях количество CD34+клеток составило 0,03±0,01 % среди МНК, выделенных из периферической крови, а в послеоперационном периоде (стимулированные условия) концентрация CD34+ возрастала с пиковым значением на 10-й день (0,34 %) после начала терапии. В среднем повышение популяции клеток CD34+ составило 0,21±0,04 %, p<0,05.
Буст-терапия приводила не только к мобилизации ГСК, но и вызывала повышение пула ММСК в системном кровотоке, которые идентифицировали по экспрессии маркеров CD105, CD73, CD90 и отсутствию маркеров CD34 и CD45.
Показано, что популяция клеток CD34-CD105+ не обнаруживалась в кровотоке до операции, а появлялась на фоне проводимой терапии на 4 сутки послеоперационного периода. В среднем относительное содержание CD34-CD105+ повышалось до 0,06±0,02 %, с максимумом на 10 день – 0,367 %, p<0,05.
Циркулирующие CD34-CD90+ клетки удавалось выявить в системном кровотоке только на 4 сутки после операции. Относительное содержание CD34-CD90+ клеток составляло 0,10±0,02 %. Популяция клеток CD90+ обнаруживалась в кровотоке с 4 по 14 сутки и достигала своего пика 0,14 % среди МНК на 12 сутки послеоперационного периода.
Популяцию клеток CD34-73+ также определяли только на 4 сутки после операции. Содержание CD34-CD73+ клеток составляло 0,06±0,02 %, максимальный уровень (0,097 % во фракции МНК) наблюдали на 10 сутки послеоперационного периода.
Таким образом, результаты исследования фенотипа ММСК выявили, что клетки с фенотипом CD34-45-11b-14-45+144+105+90+73+ не обнаруживались в кровотоке до операции, а появлялись с 4 дня и продолжали увеличиваться на всем протяжении буст-терапии при максимальном содержании на 10–14 дни послеоперационного периода. Результаты иммунофенотипирования образцов периферической крови представлены на рис.1.
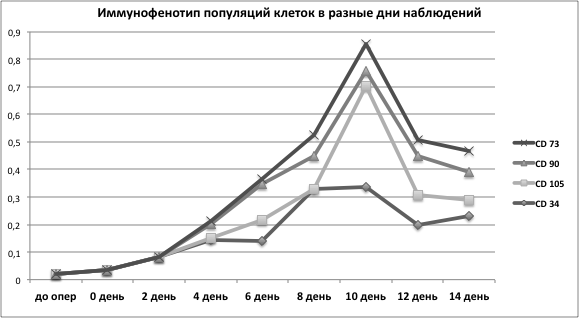
Рис.1. Динамика распределения относительного содержания разных популяций клеток во фракции мононуклеарных клеток, выделенной из периферической крови, в разные дни наблюдения
Анализ биологически активных веществ выявил следующие изменения, представленные на рис. 2. В раннем послеоперационном периоде было отмечено повышение провоспалительных цитокинов TNF-a, IL-1, IL-2 с 4-ого по 8-й дни. Вероятно, наблюдаемая цитокиновая реакция была индуцирована хирургическим вмешательством. Второй пик повышения этих цитокинов случился на 12–14-е сутки. Уровень TNF-a в сыворотке до операции и начала стимулирующей терапии составил 1,186 пг/мл, в послеоперационном периоде уровень TNF-a повысился в 2 раза до 2,22 пг/мл на 4–8-е сутки. Второй пик повышения цитокина TNF-a до 1,648 пг/мл наблюдали на 12–14 сутки. Уровень сывороточного IL-1 до операции и начала стимулирующей терапии составил 8,18 пг/мл. Наиболее высокий уровень IL-1 после операции был отмечен на 12-е сутки на фоне стимулирующей терапии и составил 9,27 пг/мл. Результаты сравнения уровня IL-2 в сыворотке в разные дни до и после операции выявили, что до операции концентрация IL-2 составила 14,46 пг/мл. В послеоперационном периоде было отмечено незначительное возрастание концентрации IL-2 на 4-е сутки до 15,34 пг/мл, и на 14-й день до 14,89 пг/мл.
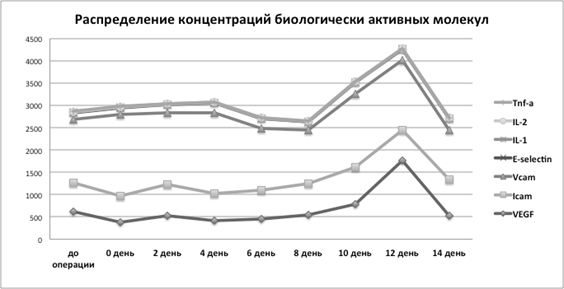
Рис. 2. Динамика изменений уровня TNF-a, IL-1, IL-2, E-селектина, ICAM-1, VCAM-1, VEGF в разные дни наблюдений
Изменения концентрации VCAM, ICAM, E-селектина, относящихся к молекулам адгезии, означает эндотелиальную активацию. Возрастание концентраций этих веществ наблюдалось на 10–14 сутки. Концентрация VCAM в сыворотке до операции составила 1429,02 нг/мл. В послеоперационном периоде повышение уровня VCAM было отмечено на 4-е сутки до 1803,89 нг/мл, и на 10–12-е дни до 1650,45 нг/мл. Уровень ICAM был повышен до 829,27 нг/мл между 10 и 14 днем после операции, по сравнению с исходным уровнем 640,46 нг/мл. До операции и проведения стимулирующей терапии уровень E-селектина составил 157,25 пг/мл, в послеоперационном периоде его максимальная концентрация составила 265,02 пг/мл.
При наблюдении за изменением концентрации эндотелиального фактора роста сосудов VEGF было отмечено постепенное повышение его концентрации в послеоперационном периоде до 1761,25 ± пг/мл на 12-е сутки. До операции концентрация VEGF составляла 620,72 пг/мл.
Изучение динамики биологических веществ у пациентов в послеоперационном периоде важно, так как они оказывают различные влияния на мобилизацию и активацию клеток, стимулируют пролиферацию и дифференцировку стволовых клеток, создавая микроокружение в месте повреждения.
Сравнительный анализ концентраций провоспалительных цитокинов, молекул адгезий и факторов роста выявил развитие цитокиновой реакции в периферическом русле преимущественно на 10 –14 дни после операции.
Наблюдаемые реакции как со стороны клеток, так и различных веществ могут свидетельствовать в пользу того, что собственный организм может быть использован как биореактор для развития органа. Предполагается, что после трансплантации ТИК организм начинает играть роль биореактора, создавая микроокружение для формирования тканеинженерной конструкции in situ [3], и рассматривается как обещающее направление регенеративной медицины. Такой подход, возможно, будет способствовать сокращению времени получения ТИК, уменьшению риска контаминации, снижению финансовых затрат.
Заключение
Полученные результаты иммунофенотипирования МНК периферической крови выявили мобилизацию как ГСК, так и ММСК под действием стимулирующей терапии Г-КСФ и эритропоэтином. Известно, что в норме ММСК циркулирует в периферической крови в ничтожно малых количествах, что затрудняет их выявление. Обнаружение этих клеток означало их мобилизацию и активацию. Выявлено повышение концентрации Е-селектина, ICAM, VCAM, VEGF, обладающих противовоспалительным, ангиогенным действиями и свидетельствующих об эндотелиальной активации. Таким образом, можно заключить, что после трансплантации тканеинженерной конструкции трахеи и на фоне проводимой стимулирующей терапии происходит активация процессов регенерации.
Работа финансирована грантом Правительства Российской Федерации для государственной поддержки научных исследований, проводимых под руководством ведущих ученых в российских образовательных учреждениях высшего профессионального образования от 19 октября 2011 г. № 11.G34.31.0065.
Рецензенты:
Гуменюк С.Е., д.м.н., профессор, заведующий кафедрой хирургии педиатрического и стоматологического факультетов ГБОУ ВПО КубГМУ Минздрава России, ГБОУ ВПО КубГМУ Минздрава России, г. Краснодар;
Павлюченко И.И., д.м.н., профессор, декан фармацевтического факультета ГБОУ ВПО «КубГМУ» Минздрава России, г. Краснодар.
Библиографическая ссылка
Гилевич И.В., Маккиарини П.Р., Гилевич И.В., Порханов В.А., Каде А.Х., Губарева Е.А., Сотниченко А.С., Куевда Е.В., Гуменюк И.С., Маккиарини П.Р. СИСТЕМНАЯ МОБИЛИЗАЦИЯ СТВОЛОВЫХ КЛЕТОК И БИОЛОГИЧЕСКИ АКТИВНЫХ ВЕЩЕСТВ ПОСЛЕ ТРАНСПЛАНТАЦИИ ТКАНЕИНЖЕНЕРНОЙ КОНСТРУКЦИИ ТРАХЕИ // Современные проблемы науки и образования. 2015. № 5. ;URL: https://science-education.ru/ru/article/view?id=21859 (дата обращения: 11.02.2026).



