Организм обладает многофункциональной и диффузной нейроиммунноэндокринной системой, которая интегрирует нервную, эндокринную и иммунную системы в единый комплекс [1]. Нейроэндокринные клетки могут выделять вещества, которые участвуют в паракринной регуляции органов и тканей. Общепризнано, что клетки диффузной нейроэндокринной системы, которые локализованы практически во всех органах, в том числе и аппендиксе, регулируют гомеостаз через нейрокринные и паракринные механизмы [3,7].
Эта связь осуществляется с помощью нейроаминов (катехоламины, серотонин, гистамин), расположенные в особых биоаминсодержащих структурах [2,4,5]. Посредством нервных волокон нейротрансмиттеры проникают в отдаленные места организма, взаимодействуя затем с тучными клетками, моноцитами, лимфоцитами и гранулоцитами, содержащими специфичные для них рецепторы [6]. Таким образом, нервная система может непосредственно влиять на иммунную систему при помощи сети нервных волокон в кроветворных органах.
Цель исследования – изучить нейроамины в структурах аппендикса после аллотрансплантации костного мозга.
Материал и методы исследования
Работа была выполнена на 30 мышах: 1 группа – интактные мыши (n=15). 2 группе проводили аллотрансплантацию (n=15) путем в/в ведения суспензии костного мозга, полученную из бедренной кости от другой мыши. 2 мл костного мозга помещали в 4 мл физиологического раствора и тщательно размешивали. 1 мл суспензии костного мозга вводили в хвостовую вену мыши. Другая часть объема полученной суспензии шла на подсчет числа клеток в полученной гетерогенной популяции клеток костного мозга с помощью проточного спектрофотометра «Ф-2000» с применением флуоресцеинаизотиоцианата (FITC). Число клеток в 1 мл суспензии было равно 2,1* 108.
Под местной анестезией извлекали аппендикс через 40 минут после аллотрансплантации.
Все процедуры по уходу осуществлялись по нормам и правилам обращения с лабораторными животными, в соответствии с «Международными рекомендациями по проведению медико-биологических исследований с использованием животных» (1985), правилами лабораторной практики в Российской Федерации (приказ МЗ РФ от 19.06.2003 № 267).
Использовались методы:
1.Для избирательного выявления катехоламинов и серотонина применялся
люминесцентно-гистохимический метод Фалька – Хилларпа (1969).
2. Люминесцентно-гистохимический метод Кросса, Евена, Роста (Сross S.A., Even S.W., Rost F.W., 971) для выявления гистамина.
3. Количественно уровень КА, СТ и гистамина в структурах оценивались с помощью цитоспектрофлуориметрии [1,3].
4. Для качественной и количественной характеристики тучных клеток после их изучения по Кроссу, Евена, Роста (1971) и цитоспектрофлуориметрии, обрабатывали полихромным толлуидиновым синим по А. Унна. Окраска по А. Унна применялась для определения сульфатированности гепарина и состояния тучных клеток.
5. Иммуногистохимическое исследование с антителами к нейроспецифической енолазе (Производство Daco, USA). Ядра клеток докрашивались гематоксилином. Подсчитывалось количество иммуноположительных клеток на квадратный миллиметр.
6. С помощью гистохимической окраски по Гленнеру выявляли моноаминоксидазу (МАО) – фермент, осуществляющий ингибирование нейроаминов (Glenner G.G. etal., 1957).
7. Методом одновременного азосочетания с эфирами нафтолов AS определяли кислую фосфатазу (КФ), выявляли клетки, способные к фагоцитозу (в основном макрофаги).
8. Цифровые результаты, полученные в ходе научной работы, подвергались статистической обработке посредством специально разработанной программы «Statistica», версия 6 (Copyright@StatSoft, 19842001, ИПЧИ 31415926535897).
Результаты исследования и их обсуждение
У опытных мышей при обработке препаратов по методу Фалька – Хилларпа в криптах слизистой оболочки выявлялись мелкие тучные клетки с зеленой флюоресценцией. Наблюдалось увеличение числа этих клеток до 7,6±2,3 при норме 5,4±2,3. Содержание КА и СТ в них возросло и составило 8,9±2,0 и 11,9± 2,8 соответственно при норме 8,0±1,2 и 11,1±1,7 у.е. Эпителий крипт имел темно-зеленую флуоресценцию.
Лимфатические узелки, которые обнаруживались в подслизистой основе, были заполнены ГЛК и тучными клетками. По краю лимфатического узелка прослеживался краевой синус, около которого обнаруживались наиболее крупные ГЛК. Как правило, эти клетки имели наиболее интенсивное свечение. После аллогенной трансплантации костного мозга наблюдалось увеличение числа внутри узелковых ГЛК до 19,8±1,1 при норме 11,4±1,1, тучных клеток до 9,3±0,7 при норме 5,2±0,6 (табл.1). ГЛК были небольшого размера, располагались преимущественно по периферии центра размножения и имели желто-зеленую флюоресценцию. Тучные клетки обнаруживались как и по периферии центра размножения, так и внутри его. Клетки обладали зеленой люминесценцией. Содержание биогенных аминов увеличилось в обоих типах клеток и составило: в тучных клетках 5,9±0,6 при норме 3,9±0,4 у.е. для КА и 11,5±0,7 для СТ при норме 5,8±0,6 у.е., в ГЛК 10,0±0,7 для КА и 13,4±1,3 для СТ при норме 7,1±0,5 у.е. и 10,4±1,8 у.е. соответственно (Диаграмма 1,2).
Люминисцирующих структур в мышечной оболочке обнаружено не было. В береговых макрофагах число клеток не изменилось, в них наблюдалось незначительное усиление свечения.
Люминесцентно-гистохимическая морфология аппендикса мышей через 40 минут после трансплантации костного мозга
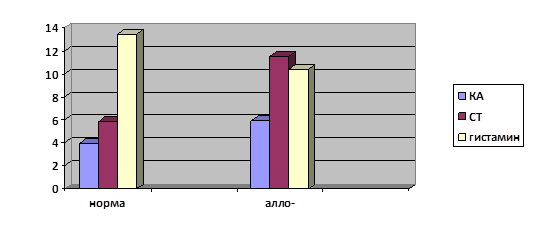
Диаграмма 1. Содержание биогенных аминов в тучных клетках лимфоидного узелка аппендикса мышей через 40 мин после трансплантации (у.е.)
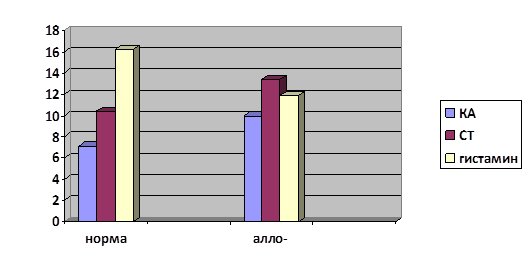
Диаграмма 2. Содержание биогенных аминов во внутриузелковых ГЛК аппендикса мышей через 40 мин после трансплантации (у.е.)
При обработке по методу Кросса наблюдалось увеличение числа тучных клеток крипт до 14,0±1,2 при норме 8,0±1,2. Светимость тучных клеток уменьшилась. Содержание гистамина уменьшилось и составило 17,0±0,5 при норме 21,2±0,3 у.е. Эпителий крипт имел зеленую флуоресценцию.
В лимфоидных фолликулах наблюдалось увеличение числа тучных клеток до 8,9±0,3 при норме 5,6±0,3. Тучные клетки имели желто-зеленую флюоресценцию, содержание гистамина в них составило 10,4±0,2 при норме 13,4±0,2 у.е. Гистамин во внутриузелковых ГЛК снизился до 11,9±0,5 при норме 16,2±0,7 у.е. В микроокружении внутриузелковых клеток содержание гистамина снизилось до 7,3±0,3 при норме 10,0±0,8 у.е. В подслизистой основе и в мышечной оболочке люминесцирующие клетки не выявлялись.
Таблица 1
Содержание биогенных аминов в аппендиксе мышей, в норме и через 40 мин после аллотрансплантации костного мозга (у. е.)
|
Структуры |
Интактные мыши |
аллопересадка |
||||
|
КА |
СТ |
Г |
КА |
С |
Г |
|
|
Подслизистая оболочка |
|
|
|
|
|
|
|
Тучные клетки лимфоидного узелка |
3,9±0,4 |
5,8±0,6
|
13,4±0,2 |
5,9±0,6 |
11,5±0,7 |
10,4±0,2 |
|
Внутриузелковые ГЛК |
7,1±0,5 |
10.4±1,8
|
16,2±0,7 |
10,0±0,7 |
13,4±1,3 |
11,9±0,5 |
|
Микроокружение внутриузелковых клеток |
2,7±0,3 |
4,6±0,5
|
10,0±0,8 |
3,0±0,2 |
6,4±0,5 |
7,3±0,3 |
|
Береговые макрофаги |
9,0±0,8 |
13,7±0,9 |
19,5±1,1 |
9,5±0,6 |
14,6±1,6 |
18,5±1,1 |
Таким образом, через 40 мин после аллотрансплантации увеличивается число внутриузелковых ГЛК и ТК с одновременным снижением в них биогенных аминов. В то время как в остальных структурных образованиях их число снизилось вплоть до исчезновения. Наблюдается дегрануляция ТК и увеличение нейроаминов в межклеточном пространстве.
При постановке реакции Гленнера на МАО в слизистой оболочке также были обнаружены тучные клетки. Клетки были окрашены в коричневый цвет, среди клеток можно было выделить следующие формы: 1. Клетки, подвергшиеся дегрануляции. 2. Недегранулированные формы клеток (компактные). Дегранулированные формы, как правило, преобладали, около них можно было наблюдать свободнолежащие черные гранулы. Кроме них в криптах обнаруживались и макрофаги, число которых, как и в срезах, обработанных на кислую фосфатазу, было не велико и составляло в среднем 0,5 клеток на поле зрения. После аллотрансплантации костного мозга наблюдалось увеличение общего числа тучных клеток крипт до 25,5±3,6 при норме 19,6±3,6. Число дегранулированных форм изменилось незначительно и составило 7,6±2,4 при норме 16,6±2,4. Наибольшие изменения наблюдались среди компактных форм клеток, их число составило 8,1±1,6 при норме 3,0±1,6. Активность МАО в тучных клетках увеличилась незначительно и составила 0,45±0,05 у.е. при норме 0,36±0,02 у.е. В энтерохромаффинных клетках также произошло увеличение активности МАО, которое составило 0,57±0,04 при норме 0,44±0,07 (табл. 2).
В подслизистой основе выявлялись тучные клетки коричневой окраски, преимущественно располагающиеся по краю лимфоидного узелка. Среди них также можно было выделить 2 формы клеток. После 40 минутной аллотрансплантации общее число клеток увеличилось до 16,6±0,7 при норме 5,8±0,6. Число дегранулированных и компактных клеток составило 13,6±0,5 и 8,6±0,6 соответственно при норме 4,2±0,3 и 2,2±0,6. Активность МАО увеличилась и составила 0,58±0,08 при норме 0,24±0,06 у.е.
В лимфоидном узелке было обнаружено два типа клеток: 1. Клетки, черного цвета, с большим количеством мелких МАО – положительных гранул (тучные клетки). 2. Клетки также черного цвета, но с крупными гранулами разного диаметра (макрофаги). У крыс, подвергшихся аллотрансплантации, общее число тучных клеток по сравнению с интактными животными увеличилось до 7,8±0,6, компактных до 2,1±0,2, дегранулированных до 6,0±0,3. Возросло число макрофагов до 11,4±0,8 при норме 10,4±0,8. Макрофаги преимущественно занимали центр узелка, тучные клетки находились по его периферии. Активность фермента в тучных клетках незначительно уменьшилась и составила 0,46±0,01 при норме 0,48±0,04 у.е. (табл. 2).
Через 40 минут после аллотрансплантации в препаратах аппендикса, окрашенных по методу одновременного азосочетания с эфирами нафтолов AS, наблюдалось увеличение КФ как в тучных клетках лимфатического узелка, так и в макрофагах. Следует отметить, что в макрофагах также произошло наиболее значительное увеличение активности КФ. В тучных клетках крипт и энтерохромафинных клетках, напротив, наблюдалось снижение активности указанного фермента.
Таблица 2
Число клеток в аппендиксе крыс, на одно поле зрения (увеличение: об. 90, ок. 7), выявленных при разных методах исследования, в норме и через 40 мин после трансплантации костного мозга.
|
Метод обработки |
Оболочка |
Клетки |
Норма |
Аллотрас- плантация |
|||
|
Метод Гленнера |
Слизистая |
Тучные клетки |
Компактные |
3,0±1,6 |
8.1±1,6 |
||
|
Дегранулированные |
16,6±2,4 |
17,6±2,4 |
|||||
|
О.Ч.К. |
19,6±3,6 |
25,5±3,6 |
|||||
|
Макрофаги |
0,6±0,5 |
|
|||||
|
Подслизистая основа |
Тучные клетки подслизистой основы |
Компактные |
2,2±0,6 |
8,6±0,6 |
|||
|
Дегранулированные |
4,2±0,3 |
13,6±0,3 |
|||||
|
О.Ч.К. |
5,8±0,6 |
16,6±0,7 |
|||||
|
Лимфоидный узелок |
Тучные клетки |
Компактные |
1,6±0,2 |
2,1±0,2 |
|||
|
Дегранулирован. |
4,2±0,3 |
6,0±0,3 |
|||||
|
О.Ч.К |
5,8±0,6 |
7,8±0,6 |
|||||
|
Макрофаги |
10,4±0,8 |
11,4±0,8 |
|||||
В лимфоидном узелке выявлялись как тучные клетки, так и макрофаги, причем последние преобладали. Макрофаги представляли собой клетки с четкими границами, содержащие крупные темные гранулы, разного размера. Тучные клетки, напротив, имели в своем составе светлые, мелкие гранулы одинакового размера. После аллотансплантации клетки располагались по периферии центра размножения, число центров размножения составляло 4–5 на узелок. Увеличение числа макрофагов и тучных клеток составило 1,2±0,1 и 0,80±0,04 соответственно при норме 0,84±0,06 и 0,65±0,03.
Число тучных клеток в мышечной оболочке увеличилось до 4,6±0,6 при норме 2,2±0,6. Клетки в основном располагались около кровеносных сосудов группами по 6–12 клеток, а также между мышечными слоями, но в гораздо меньшем количестве 1–3 клетки. Активность кислой фосфатазы возросла незначительно и составила 0,26±0,03 при норме 0,21±0,04.
При аллопересадке число положительных клеток на синаптофизин в эпителии уменьшается, а в слизистой и лимфоидных узелках увеличивается в 2,1 раза. Появляются дополнительные лимфоидные узелки, где эти клетки располагаются как по периферии узелков, так и в центре размножения.
Выводы
1. При аллопересадке изменяется содержание нейроаминов в клетках-регуляторах.
2. В лимфоидных узелках появляется от 3-х до 4-х герментативных центров, что, возможно, связано с усиленным размножением лимфоцитов.
3. При аллотрансплантации костного мозга через 40 минут в подслизистом слое аппендикса увеличивается активность ферментов, что приводит к изменению тучных и гранулярных клеток.
Рецензенты:
Малышев И.И., д.м.н., профессор кафедры общей и клинической морфологии и судебной медицины ФГБОУ ВПО «Чувашский государственный университет имени И.Н. Ульянова», г. Чебоксары;
Иванов Л.Н., д.м.н., профессор кафедрой нормальной и патологической физиологии ФГБОУ ВПО «Чувашский государственный университет имени И.Н. Ульянова», г. Чебоксары.
Библиографическая ссылка
Воробьева О.В., Любовцева Л.А., Любовцева Е.В., Романова Л.П. СРАВНИТЕЛЬНЫЙ АНАЛИЗ НЕЙРОМЕДИАТОРНЫХ ИЗМЕНЕНИЙ В СТРУКТУРАХ АППЕНДИКСА ПРИ ВВЕДЕНИИ ЧУЖЕРОДНОГО КОСТНОГО МОЗГА // Современные проблемы науки и образования. 2015. № 5. ;URL: https://science-education.ru/ru/article/view?id=21822 (дата обращения: 11.02.2026).



